8.1: Мікростани та терміни
- Page ID
- 18579
Більш пильний погляд на електронні спектри
Розглянемо докладніше оптичні спектри поглинання, також звані електронними спектрами координаційних сполук. Раніше ми стверджували, що теорія поля лігандів може передбачати і пояснювати електронні спектри. Однак лише у відносно небагатьох випадках теорія поля лігандів (LFT) є достатньою для пояснення спектрів. Наприклад, комплексний іон гексааква нікелю (2+) - це восьмигранний d 8 -комплексний іон. Згідно з теорією поля лігандів металевими d-орбіталями у восьмигранному полі є t 2g та e g —орбіталі (рис.8.1.1). Шість електронів знаходяться на орбіталах t 2g, а два електрони - на орбіталах e g. Теорія поля ліганду передбачала б, що можливий один електронний перехід, а саме просування електрона з t 2g в орбітальну e g. Цей процес буде викликаний поглинанням світла, внаслідок чого довжина хвилі світла залежатиме від Δ o між t 2g та e g орбіталями. В цілому, це повинно привести до єдиної смуги поглинання в спектрі поглинання комплексу. Ми можемо перевірити це прогнозування шляхом експериментальної реєстрації спектра поглинання комплексу (рис.8.1.1).
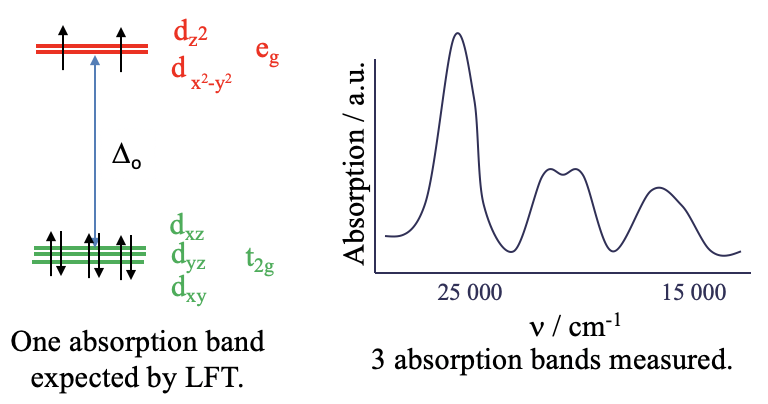
Ми виявляємо, що спектр поглинання набагато складніший, ніж очікувалося. Замість однієї смуги поглинання є кілька. Очевидно, що теорія поля лігандів не в змозі пояснити цей спектр. Питання в тому, чому? Відповідь така: LFT передбачає відсутність електронно-електронних взаємодій. Однак насправді існує відштовхування між електроном в d-орбіталах, і це впливає на їх енергію.
Вплив електронно-електронних взаємодій
Давайте розглянемо це докладніше. Для спрощення задачі розглянемо спочатку іон d 2 у восьмигранному лігандному полі (рис.8.1.2).
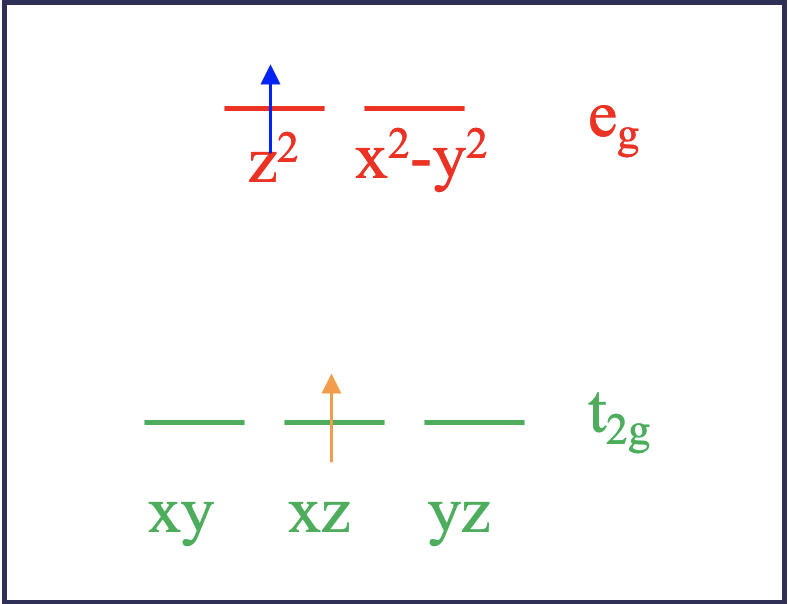
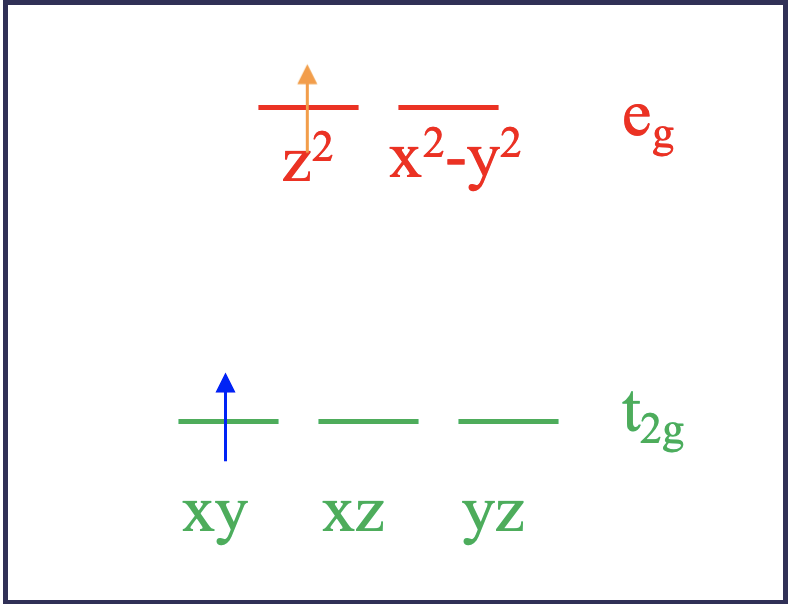
Згідно з теорією поля лігандів, два електрони були б на орбіталах t 2g, коли вони знаходяться в основному стані. Наприклад, вони можуть бути в xy, і xz орбіталів. Це називається мікростаном. Його називають мікростаном стану, оскільки можливі інші комбінації орбіталів. Наприклад, стан землі також було б реалізовано, якби два електрони знаходилися на орбіталах xz та yz. Ця комбінація була б іншим мікростаном, пов'язаним з електронною конфігурацією наземного стану. При збудженні за допомогою світла електрон в орбіталі d xy може бути просунутий в орбітальну e g, яка може бути або d z 2, або d x 2 -y 2. Ці дві можливості відображають різні мікростани, пов'язані з збудженим станом (рис.8.1.2). Припустимо, електрон йде в орбіталь d z 2. У цьому мікростані один електрон знаходився б в орбіталі d xz, а інший - в орбіталі d z 2. Тепер є ще одна можливість, як порушити електрон. Можна припустити, що електрон d xy не просувається в орбітальну d z 2, але електрон d xz отримує просування. У цьому випадку ми реалізуємо мікростан, в якому один електрон в орбіталі d xy, а інший - в орбіталі d z 2.

Тепер порівняємо два випадки. Теорія поля ліганда стверджує, що обидва збуджених мікростану мають однакову енергію. Однак насправді вони цього не роблять. Чому? Це тому, що електрони в двох збуджених мікростанах взаємодіють по-різному. Це стає правдоподібним при розгляді орбітальних форм (рис.8.1.3). Орбіталь d xz має електронну щільність на осі z, тоді як орбітальна d xy не має. Тому очікується, що електрони на цих орбіталах будуть по-різному взаємодіяти з електроном в орбіталі d z 2, яка має більшу частину своєї електронної щільності на осі z. В результаті два збуджених мікростану не володіють однаковою енергією. Це означає, що для просування електрона в два різних мікростани нам потрібна різна кількість енергій. Таким чином, комплекс поглинає світло з більш ніж однією довжиною хвилі. Це на відміну від того, що передбачає теорія поля лігандів. Що нам потрібно зробити, щоб правильно передбачити, скільки смуг поглинання ми отримаємо? Відповідь полягає в тому, що ми повинні знайти всі можливі мікростани для електронної конфігурації d 2 і згрупувати ті разом, які мають однакову енергію. Група мікростанів з однаковою енергією називається терміном. Кількість електронних переходів потім можна передбачити з числа членів.
Зв'язка електронів Рассела Сондерса у вільних іоні
Наше завдання тепер знайти всі терміни для восьмигранного комплексу з електронної конфігурацією d 2. Щоб спростити питання, давайте спочатку розглянемо вільний d 2 іон. Вільний іон - це іон, який не узгоджується жодним лігандом.

Енергія мікростанів залежить від квантових чисел m l і m s електронів (рис. 8.1.4 і рис.8.1.5). Це тому, що ці квантові числа визначають, як взаємодіють електрони. Це ще називають зв'язком електронів Расселла-Сондерса. Давайте спочатку подивимося, як квантове число m l електронів впливає на термін символ. Термін визначається мікростаном з найбільшим квантовим числом M L, при якому M L - сума квантових чисел m l окремих електронів. Максимальне значення M L також називається загальним квантовим числом орбітального моменту L. Значення L також говорить вам, скільки мікростанів належить терміну через ці магнітні взаємодії. Кількість мікростанів - 2L+1. Це пов'язано з тим, що M L може варіюватися між —L і+L. так, наприклад, якщо L = 2, M L може прийняти значення -2, -1, 0, +1 і +2, і це перекладається на 2L+1=5 мікростанів.
Одне лише квантове число L ще не визначає термін. Крім того, треба враховувати і взаємодію спінів електронів (рис.8.1.5).

Спіновий квантове число m s одного електрона може бути як +1/2, так і -1/2. Коли спини електронів взаємодіють, їх спінові квантові числа складаються, визначаючи сумарний момент спіна M s. Мікростан з максимальним значенням M s визначає сумарне квантове число спінового моменту S. Число мікростанів, обумовлених спін-спіновими взаємодіями, які належать до терміна, дорівнює 2S+1. Це ще називають кратністю спина (рис.8.1.6).
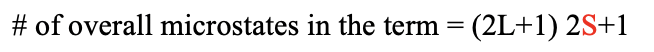
Загалом термін має (2L+1) (2S+1) мікростану. Загальне орбітальне кутове квантове число L і загальне орбітальне спінове квантове число S визначають термін символ (рис.8.1.7).
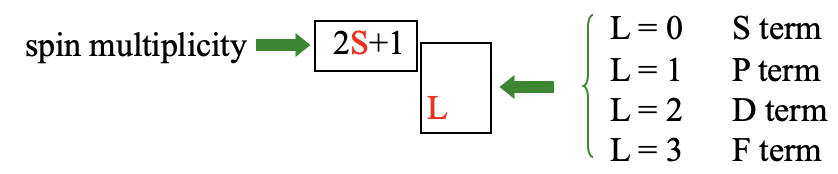
Коли L = 0 у нас є термін S, коли L = 1, у нас є P термін, коли L = 2, ми називаємо його терміном D, а коли L = 3 ми називаємо його терміном F. Ці символи вибираються за аналогією з символами s, p, d і f для орбіталей. Кратність спина 2S+1 потім записується у вигляді верхнього індексу перед літерою, визначеною L. Це дає загальний символ терміна для терміна. Ми називаємо термін зі спіновою кратністю 1 синглетним терміном, коли 2S+1=2 називаємо термін дублетом. Термін з кратністю спина три називається триплетний термін, один з спін-кратністю 4 квартет термін, і так далі.
Мікростани безкоштовно d 2 іон
Які можливі мікростани та загальна кількість мікростанів для вільного іона з конфігурацією d 2 -електронів? Ми можемо висловити це в так званій таблиці мікростанів (рис.8.1.8).
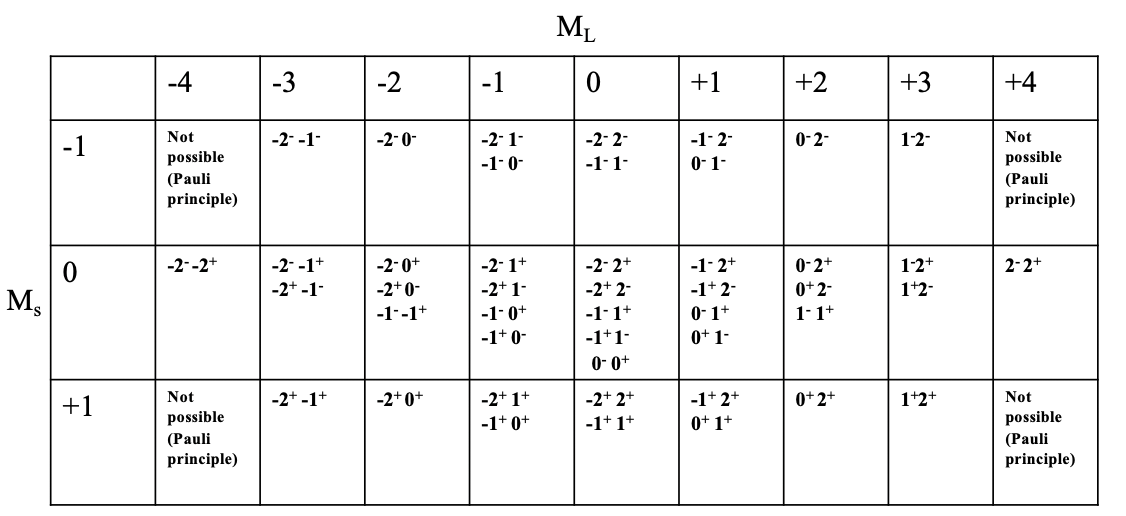
Ви можете побачити таблицю мікростанів для електронної конфігурації d 2, зображеної вище. Кожен стовпець представляє можливе значення M L. Для конфігурації d 2 M L може приймати значення від -4 до +4, отже, є 9 стовпців. Кожен рядок представляє можливе значення M s. Для електронної конфігурації d 2 M s може варіюватися від +1 до -1. +1 означає, що обидва електрони мають спін +1/2, 0 означає, що один електрон має спін +1/2, а інший має спін -1/2. Значення M s -1/2 приймається, коли обидва електрони мають спін -1/2. Тепер ми можемо об'єднати кожне M s значення з кожним значенням M L, яке визначає конкретне поле в таблиці. Ви можете бачити, що деякі поля порожні через принцип Паулі. Наприклад, поле для M L =-4 і M s =-1 не заповнене, оскільки в цьому випадку обидва електрони мали б однакові квантові числа, а саме m l =-2, а m s =-1/2. Далі ми бачимо, що для деяких полів можлива лише одна комбінація електронів, а для інших - кратна. Наприклад, для поля з M L =4 і M s =0 можлива лише одна комбінація електронів. У цьому полі ви можете побачити символ «2 - 2 +». Це означає, що перший електрон має m l значення 2 і спін -1/2, а другий електрон також має m l значення 2 і m s значення +1/2. Найбільш заповненим полем є поле для M L =0 і M s =0. Є загалом п'ять мікростанів з такою комбінацією значень M L і M s. Якщо порахувати загальну кількість мікростанів в таблиці, то ми приходимо до числа 45. Це узгоджується з тим, що ми очікуємо за формулою #microstates = (2L+1) (2S+1). У нашому прикладі L=4 і S = 1, і таким чином кількість мікростанів дорівнює ((2x4) +1) ((2x1) +1) =45. Загалом для електронної конфігурації d n з n d-електронами кількість мікростанів дорівнює (10!) /(10-н)! п!).
Однією з корисних властивостей таблиці мікростанів є те, що ми можемо вивести з неї терміни і термінові символи для конкретної електронної конфігурації. Заради спрощення ми вказуємо можливий мікростан в таблиці просто «х». Потім малюємо найбільшу можливу прямокутну коробку в мікростійку, яка містить тільки поля з хоча б однією можливою комбінацією електронів (рис.8.1.9).
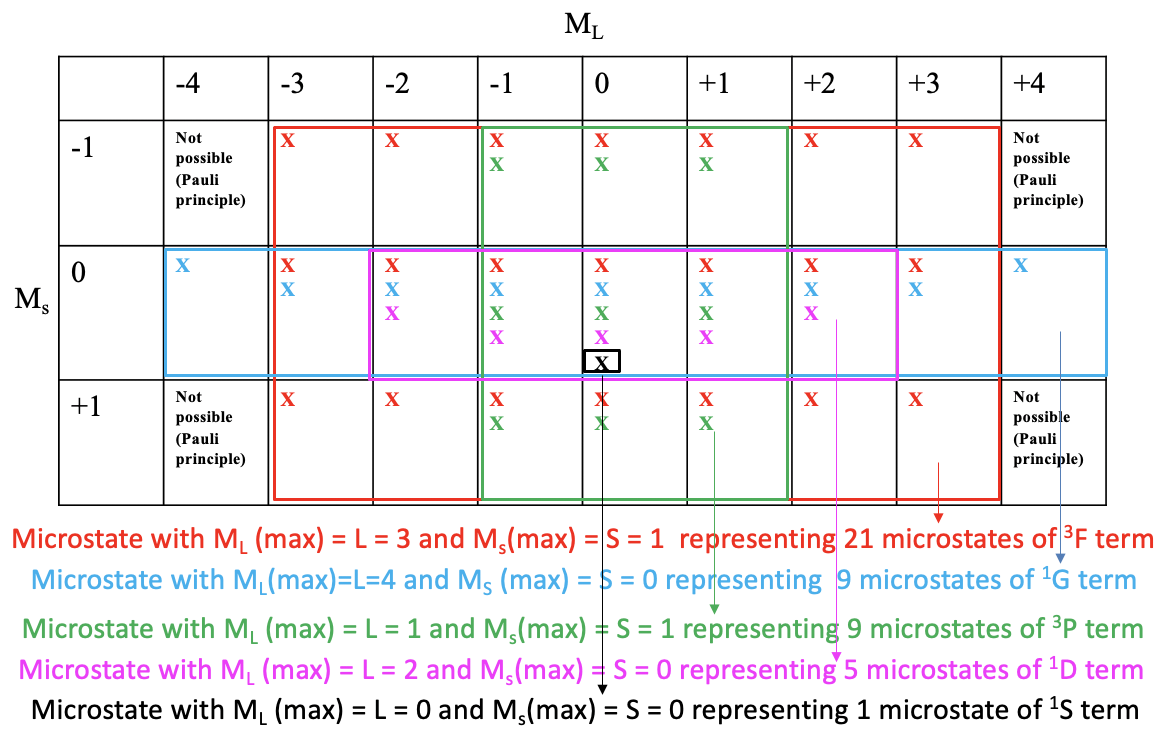
Ви можете бачити, що найбільша можлива коробка - це намальована червона коробка (рис. 8.1.9). У цій коробці містяться мікростани, які належать до першого члена електронної конфігурації d 2. Кількість мікростанів дорівнює кількості полів у червоному полі. Це робить 7x3 = 21 мікростанів. Що таке термін символ для цього терміна? Для того, щоб відповісти на це питання, нам потрібно знайти мікростан в червоному полі, який має найвищу M L і найвищу M s значення. Ви можете бачити, що це один з M L =3 і M s = 2. Таким чином, L=3 і S=1. Це визначає термін як термін 3 F, оскільки 2S+1 = 3, а L = 3 відповідає термінові символ F. Цей термін є триплетним терміном. Зверніть увагу, що триплет термін також включає мікростану з парними спинами. Загалом сім з 21 мікростанів мають M s = 0.
Далі ми дивимося, яку наступну за величиною прямокутну коробку ми можемо намалювати, і яка містить мікростану, які ми ще не розглядали. Ми бачимо, що синє поле містить дев'ять полів, що дорівнюють дев'яти мікростанам. Мікростан у цьому полі, який має найвищі значення M L та M s, - це той, у якому M L =4 та M s =0. Це визначає термін 1 G. Це синглетний термін. Зверніть увагу, що синглетний термін ТІЛЬКИ має мікростану з парними спинами (M s = 0).
Є ще одна прямокутна коробка, яка також містить дев'ять мікростанів. Він зелений. Мікростан з найвищими значеннями M L і M s є тим, що має M L =1 і M s =1. Таким чином, L = 1, і 2S+1=3, що визначає термін 3 P. Зверніть увагу, що незважаючи на те, що це триплет термін, термін також містить три мікростани з парними спинами.
Наступний за величиною ящик - фіолетовий, що містить п'ять полів і п'ять мікростанів. Що таке термін з найвищими значеннями M L і M s? Це один з M L =2 і M s =0. Це означає, що L = 2 і S = 0, які визначали термін 1 D. Це синглетний термін. Синглетний термін містить тільки мікростану з парними спинами. Залишилося одне мікростан, який ми не розглядали досі. Це один з M L = 0 і M s = 0. Це найвищі значення M L і M s, оскільки іншого мікростану немає. Таким чином, цей термін містить тільки одне мікростан і термін символ 1 S. Тепер ми знайшли всі терміни і термінові символи.
Енергія термінів
Що таке відносна енергія термінів? Спочатку нам потрібно розглянути правило Гунда, яке стверджує, що чим вище кратність спина, тим нижча енергія терміна.
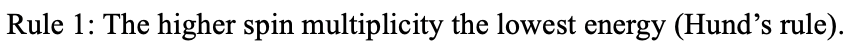
Тому спочатку потрібно ранжирувати терміни щодо кратності спина. По-друге, потрібно розглянути значення сумарного орбітального кутового моменту квантового числа L. Чим вище значення, тим нижче енергія для терміна. Це означає, що енергія термінів зменшується від S, до P, до D, до F.
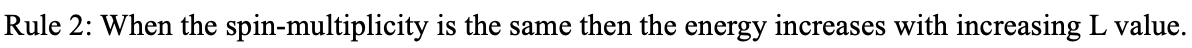
Зауважте, що це суперечить орбітальним енергіям, які збільшуються від s, до p, до d, до f Отже, якою буде очікувана енергетична послідовність для термінів, пов'язаних з вільним іоном d 2? Він повинен бути: 3 F< 3 P < 1 D < 1 S. Однак фактична послідовність енергій дорівнює 3 F< 1 D< 3 P < 1 G< 1 S. Це означає, що несподівано термін 1 D енергетично нижчий. ніж термін 3 Р. З цього ми можемо зрозуміти, чому правило Гунда називається правилом, а не законом, тому що є винятки. У більшості, але не у всіх випадках триплетний термін має нижчу енергію, ніж синглетний термін.
Вільно-іонні умови інших конфігурацій d Electron
Що таке термін інших d-електронних конфігурацій (рис.8.1.10)?
Ви можете бачити вище, що існує лише один термін 2 D для d 1 вільного іона. Чим можна пояснити цей термін? Оскільки немає іншого електрона, немає електронно-електронних взаємодій, і таким чином кожен можливий мікростан має однакову енергію. Це пояснює, чому існує тільки один термін. Чому це 2 D? Термін символ визначається мікростаном з найвищим значенням M L і найвищим значенням M s. Це досягається, коли ми заповнюємо спін-ап електрона в d-орбіталь з m l =2 (рис.8.1.10). Тому що є тільки один електрон, m l =M L =L=2. Це робить термін терміном D. Це дублетний термін, оскільки M s максимізується, коли електрон спін-вгору або m s =+1/2. Таким чином, m s = M s = S = 1/2. 2S+1=2×1/2+1=2, таким чином, ми маємо стан дублета. Скільки мікростанів пов'язано з цим терміном? (2Л+1) (2С+1) = 5 × 2 = 10. Що це означає? Це означає, що ми можемо заповнити один електрон, який у нас є або спін-вгору, або обертатися вниз в будь-якій з п'яти d-орбіталей. Всі 10 мікростанів енергетично рівні.
Коли ви переходите від d 2 до d 3 до d 4 до d 5 ви можете побачити, що кількість термінів різко зростає. Це пояснюється тим, що зі збільшенням числа електронів збільшується кількість можливих перестановок, а отже, і кількість можливих мікростанів. Як наслідок, термінів більше. З d 6 до d 10 кількість членів знову зменшується. Терміни для d 6 такі ж, як терміни для d 4, d 7 -терміни ідентичні тим для d 3, d 8 -терміни такі ж, як d 2 і d 9 -терміни такі ж, як терміни для електронної конфігурації d 1. Чому це так? Це пов'язано з тим, що незайняті держави на орбіталах перебувають так само, як і зайняті. Наприклад, електронна конфігурація d 3 має три зайняті стани і сім незайнятих, тоді як електронна конфігурація d 7 має сім зайнятих станів і три незайнятих станів. Електронна конфігурація d 10 має також лише один термін з терміном символ 1 S (рис. 8.1.10). Чи можемо ми це пояснити? У конфігурації електронів d 10 немає можливості перемикати електрони, отже, можливий лише один мікростан. У цьому мікростані L=0. Чому це так? Коли підсумовуємо окремі m l -значення десяти електронів, то ця сума дорівнює M L = L = 2× (-2) +2 (-1) +2× (0) +2× (+1) +2× (+2) =0. Спінова кратність терміна дорівнює 1, тому що всі електрони парні (2S+1= (2×0) +1=1). Отже, у нас є синглет 1 S термін.
Спін-орбіта муфти
Ми досі не розглянули всі електронно-електронні взаємодії. Крім взаємодії між кутовими магнітними моментами та магнітними взаємодіями між спинами, існують також магнітні взаємодії між кутовими моментами та спинами. Це називається спін-орбітальної зв'язкою. Вона виражається додатковим квантовим числом J J може працювати від L+S до L-S.

Квантове число J додається як індекс за літерою, що описує термін. Таким чином, повний термін символ описується як 2S+ 1 L J. Спін-орбітальна муфта може призвести до додаткових термінів в залежності від L і S (рис.8.1.11).
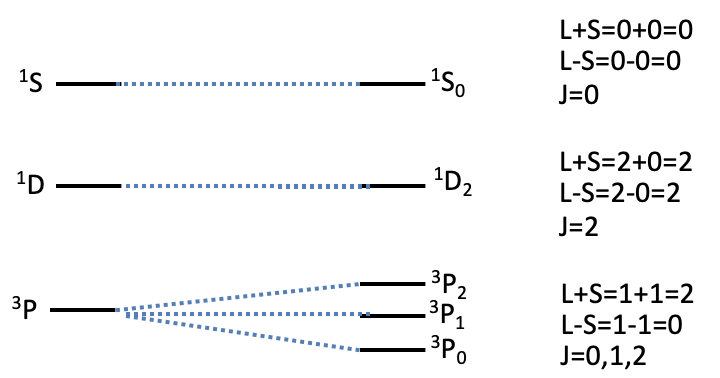
Наприклад, для 3 P термін, S = 1, і L = 1. Таким чином, J може приймати значення між L+S = 1+1 = 2 і L-S = 1-1 = 0. Таким чином, загальний J може прийняти значення, 0, 1, 2. Це означає, що термін 3 P розділяється на три терміни через спін-орбіту зв'язку. Їх термінові символи - 3 Р 0, 3 Р 1 і 3 Р 2. Їх енергія збільшується зі збільшенням квантового числа J. 1 S і 1 D члени з іншого боку, щоб не розщеплюватися на додаткові терміни. Для терміна 1 S L+S = 0+0+0 = 0, і L-S = 0-0=0. Символ повного терміну - 1 S 0. Для терміна 1 D, L+S = 2+0=2 і L-S = 2-0 = 2, таким чином, повний символ терміна дорівнює 1 D 2. Загалом, енергетичні відмінності між термінами, обумовленими J, дуже малі, в порядку десятків хвильових чисел, а порядки величин менші, ніж різниці енергії через RS-зв'язку, які, як правило, в порядку десятків тисяч хвильових чисел. Таким чином, ми зазвичай ігноруємо ефект J при інтерпретації електронних спектрів.
