9.8: Луги та електриди
- Page ID
- 20077
Ще одне цікаве наслідок енергій решітки передбачає утворення певних солей, що містять Na - і e - аніони. Ці сполуки відомі як луги та електроди відповідно. [9] Більшість цих сполук були виявлені професором Джеймсом Дайе в Мічиганському державному університеті.
Лужні метали мають один електрон в валентній оболонці. Наприклад, електронні конфігурації Na і K - це [Ar] 3s 1 і [Kr] 4s 1 відповідно. Хоча ми звикли бачити, як ці самі електропозитивні елементи відмовляються від своїх електронів, коли вони утворюють сполуки з електронегативними елементами, вони також можуть отримати електрон для досягнення конфігурації [благородного газу] ns 2. Це можливо при сильних донорах електронів, таких як лужні метали, особливо коли катіон, який утворюється, стабілізується координацією з коронковим ефіром. Зазвичай ці сполуки синтезуються шляхом з'єднання лужного металу і відповідного коронкового ефіру в рідкому аміаку, а потім випаровування аміаку.
|
Порожнини і канали в електроді |
Електридні солі утворюються в подібних умовах, за винятком цього випадку аніон - це просто електрон, який існує в аніонної «порожнині» в кристалі. Кристалічні структури чітко солеподібні, причому катіони (катіони лугу, стабілізовані коронкою або крітанд-лігандами), що чергуються в структурі з електронами.
лужна сіль
\[\ce{2Na ->[NH_{3}] Na^{+}(NH3)+ e^{-}(NH3) ->[18C6] [Na(18C6)]^{+} Na^{-}}\]
Електрична сіль
\[\ce{2Cs ->[NH_{3}][18C6] [Cs(18C6)]^{+} e^{-}}\]
Комплексування Na + (K +, Rb +, Cs +) коронковими ефірними лігандами стабілізує M + форму металу («сольова» форма). Оскільки катіон металу з його лігандною оболонкою досить великий, енергія решітки цих солей досить низька.
|
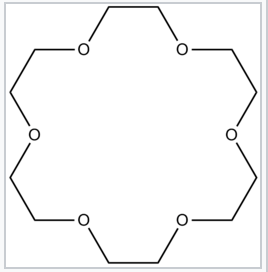
18-Crown-6, коронковий ефір, який сильно комплексує катіони Na + |
Розчини солей електридів є потужними відновниками, про що свідчить їх використання в відновленні Берези, в якому ароматичні сполуки гідрогенізуються з отриманням дієнів. Електроди також корисні для відновлення іонів металів до металів. Випаровування синіх розчинів електридів в безводному аміаку дозволяє дзеркало Na. Такі розчини повільно втрачають свій колір, оскільки електрони зменшують аміак до амідного аніону:
\(\ce{[Na(NH3)6]^{+}e^{-} + NH3 -> NaNH2 + H2}\)
Цікаво розглянути, в контексті ґратчастих енергій і циклів Борна-Хабера, що може статися без присутніх цих лігандів. Тобто ми можемо задати питання про те, чи вважав за краще б метал натрію існувати в металевій формі як Na (s), або утворювати натрієву сіль Na + Na -, або електричну сіль Na + e -. Звичайно, відповідь на це питання ми вже знаємо. Елементарний натрій явно є металом (він блискучий, проводить електрику і має кристалічну структуру ОЦК) і ніколи не спостерігався ні в одній з «сольових» форм. Але наскільки далеко ці форми енергетично?
Ми можемо обчислити енергетику, припускаючи, що Na- іон приблизно такого ж розміру, як і Br -, і що e - аніон приблизно такого ж розміру, як Cl -. Тоді енергії решітки в циклах стають такими ж, як енергії NaBr і NaCl:
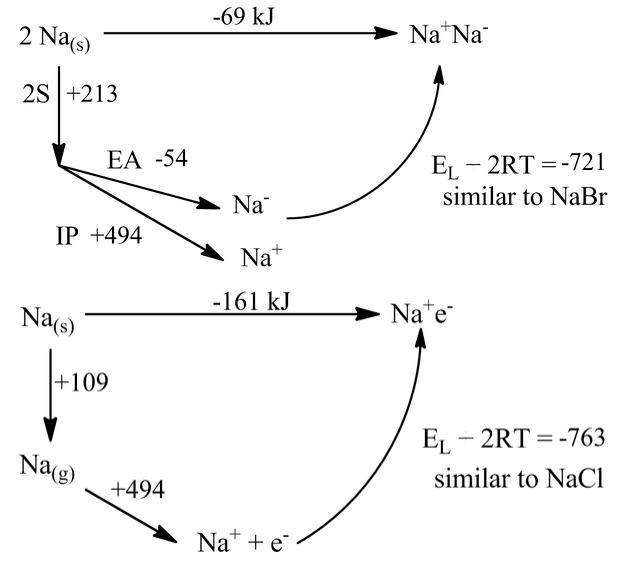
Досить дивовижним результатом цих розрахунків є те, що натрій був би незначно стабільним як натрієва сіль і дуже стабільним (на 161 кДж) як електрод. Всі терміни в цих простих циклах відомі точно. Але ми повинні робити щось не так, тому що Na (s) явно металевий.
Ключовим, тонким моментом тут є те, що цикли Борна-Хабера розглядають тільки потенційну енергію (а не загальну енергію) речовин в циклі. Зазвичай ми можемо ігнорувати кінетичну енергетичну частину загальної енергії, але в цьому випадку ми не можемо через квантовий механічний ефект резонансу.