9.1: Коефіцієнти іонних радіусів та радіусів
- Page ID
- 20124
Атоми в кристалах утримуються разом електростатичними силами, взаємодіями ван дер Ваальса та ковалентним зв'язком. Звідси випливає, що розташування атомів, здатних максимально збільшити силу цих привабливих взаємодій, повинні бути найбільш сприятливими і приводити до найбільш часто спостерігаються кристалічних структур.
Правила співвідношення радіусів
Ранні кристалографи мали проблеми з вирішенням структур неорганічних твердих тіл за допомогою рентгенівської дифракції, оскільки деякі математичні інструменти для аналізу даних ще не були розроблені. Після того, як була запропонована пробна структура, обчислити дифракційну картину було відносно легко, але було важко піти іншим шляхом (від дифракційної картини до структури), якщо апріорі нічого не було відомо про розташування атомів в одиничній комірці. Це було (і до сих пір є!) важливо розробити деякі керівні принципи для вгадування координаційних чисел і склеювання геометрій атомів в кристалах. Перші такі правила запропонував Лінус Паулінг, який розглядав, як можна зібрати разом протилежно заряджені сфери різних радіусів. Полінг запропонував з геометричних міркувань, що якість «прилягання» залежало від радіусного співвідношення аніона і катіона.
|
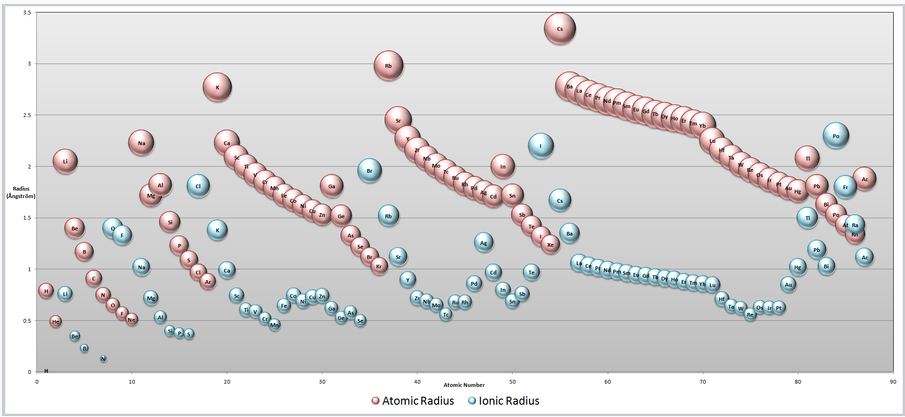
Атомні та іонні радіуси. Зверніть увагу, що катіони завжди менше нейтрального атома (рожевого кольору) того ж елемента, тоді як аніони більші. Переходячи зліва направо через будь-який рядок періодичної таблиці, нейтральні атоми і катіони скорочуються в розмірах через збільшення ядерного заряду. (натисніть для збільшення зображення) |
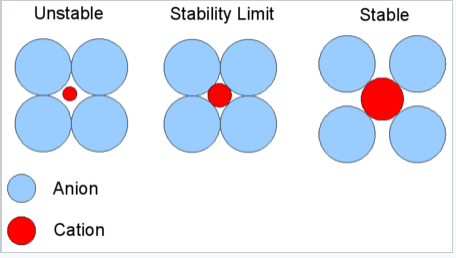
Основна ідея правил співвідношення радіусів проілюстрована праворуч. Вважається, що аніон є пакувальним атомом в кристалі, а менший катіон заповнює інтерстиціальні ділянки («дірки»). Катіони знайдуть розташування, в яких вони можуть контактувати з найбільшою кількістю аніонів. Якщо катіон може торкнутися всіх найближчих сусідів аніонів, як показано праворуч для невеликого катіона, що контактує з більшими аніонами, то придатність хороша. Якщо катіон занадто малий для даної ділянки, цей координаційний номер буде нестабільним, і він віддасть перевагу більш низькій координаційній структурі. У таблиці нижче наведено діапазони співвідношень радіусів катіон/аніонів, які найкраще підходять для заданої координаційної геометрії.
|
Коефіцієнт критичного радіуса. Ця діаграма для координації номер шість: показано 4 аніона в площині, 1 знаходиться над площиною і 1 внизу. Межа стійкості знаходиться при r C/r A = 0,414 |
| Номер координації | Геометрія | ρ = r катіон /r аніон |
|---|---|---|
| 2 | лінійний | 0 - 0,155 |
| 3 | трикутні | 0,155 - 0,225 |
| 4 | чотиригранний | 0,225 - 0,414 |
| 4 | квадратний площинний | 0,414 - 0,732 |
| 6 | восьмигранний | 0,414 - 0,732 |
| 8 | кубічних | 0,732 - 1,0 |
| 12 | кубоктаедричний | 1.0 |
На жаль, існує кілька проблем із використанням цієї ідеї для прогнозування кристалічних структур:
- Ми не знаємо радіусів окремих іонів
- Атоми в кристалах насправді не є іонами - існує різний ступінь ковалентності залежно від відмінностей електронегативності
- Відстані зв'язку (і, отже, іонні радіуси) залежать від міцності зв'язку та координаційного числа (згадайте правило Полінга D (n) = D (1) - 0.6 log n)
- Іонні радіуси залежать від ступеня окислення (більший заряд => менший розмір катіону, більший розмір аніону)
Ми можемо побудувати таблицю іонних радіусів, припускаючи, що довжина зв'язку є сумою радіусів (r + r -), якщо іони контактують у кристалі. Розглянемо для прикладу сполуки MgX і MnX, де X = O, S, Se. Всі ці сполуки кристалізуються в структурі NaCl:
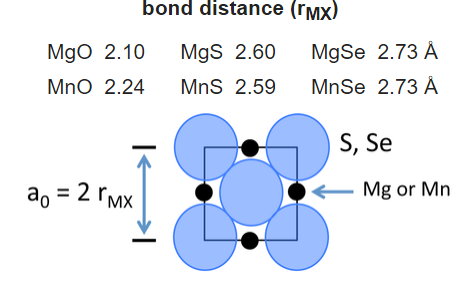
Для двох більших аніонів (S 2- і Se 2-) розміри одиничних комірок однакові для обох катіонів. Це говорить про те, що аніони контактують в цих структурах. З геометричних міркувань радіус аніона в даному випадку задається:
\[r_{_}= \frac{r_{MX}}{\sqrt{2}}\]
і таким чином радіуси іонів S 2- і Se 2- складають 1,84 і 1,93 Å відповідно. Після того, як розміри цих аніонів зафіксовані, ми можемо отримати самоузгоджений набір радіусів катіонів та аніонів з констант решітки багатьох сполук MX.
Наскільки добре працює ця модель? Розглянемо структури чотиривалентних оксидів металів (MO 2), використовуючи радіуси Паулінга і прогнози моделі радіусного відношення:
| Оксид МО 2 | Коефіцієнт радіусу | Передбачений корд. немає. | Спостерігається корд немає. (структура) |
|---|---|---|---|
| СО 2 | ~0.1 | 2 | 2 (лінійна молекула) |
| ІСО 2 | 0,32 | 4 | 4 (різні чотиригранні структури) |
| ГеО 2 | 0,43 | 4 | 4 (кремнеземиподібні структури) |
| « | 0,54 | 6 | 6 (рутил) |
| ТіО 2 | 0,59 | 6 | 6 (рутил) |
| ZrO 2 | 0,68 | 6 | 7 (баддлеїт) |
| « | 0,77 | 8 | 8 (флюорит) |
| Тхо 2 | 0,95 | 8 | 8 (флюорит) |
Зверніть увагу, що катіони мають різні радіуси залежно від їх координаційних чисел, і таким чином для Ge 4+ розраховуються різні радіусні коефіцієнти з координаційними числами 4 і 6, і для Zr 4+ з координаційними номерами 6 і 8.
Для цієї серії оксидів модель, здається, працює досить добре. Правильне координаційне число прогнозується у всіх випадках, а прикордонні випадки, такі як GeO 2 і ZrO 2, зустрічаються в структурах з різними координаційними номерами. Модель також правильно прогнозує структури BeF 2 (тип SiO 2), MgF 2 (рутил) та CaF 2 (флюорит).
А як щодо галогенідів лугів NaCl, KBr, LiI, CSF тощо? Всі вони мають структуру NaCl, крім CscL, CsBr та CSi, які мають структуру CscL (8-8). У цьому випадку модель співвідношення радіуса виходить з ладу досить погано. Прогнозується, що солі Li+ LiBr та LiI мають чотиригранні структури, а KF, за прогнозами, матиме структуру 8-8, як CSCL. Ми можемо спробувати регулювати радіуси (наприклад, зробити катіони більшими, а аніони меншими), але найкраще, що ми можемо зробити з галогенідами лугів, - це правильно передбачити близько половини їх структур. Оскільки галогеніди лугів - це явно іонні сполуки, цей збій говорить про те, що з моделлю радіусного співвідношення є щось дуже неправильне, і його успіх із сполуками MO 2 був випадковим.
На додаток до правила співвідношення радіуса, Лінус Полінг розробив інші корисні правила, які корисні для раціоналізації, а також прогнозування структур неорганічних сполук. Правила Паулінга [1] стверджують, що:
- Стабільні структури локально електронно-нейтральні. Наприклад, в структурі подвійного перовскіта Sr 2 FeMoO 6, MO 6 (M = Fe 2+, Mo 6+) октаедри поділяють всі свої вершини, а іони Sr 2+ заповнюють кубооктаедричні порожнини, які фланковані вісьмома октаедрами МО 6. [2] Кожен іон O 2 узгоджується з одним Fe 2+ та одним іоном Mo 6+ для досягнення локальної електронейтральності, і, таким чином, октаедри FeO 6 та MoO 6 чергуються в структурі.
- Катіонно-катіонне відштовхування повинно бути зведено до мінімуму. Аніонні багатогранники можуть ділитися вершинами (як у перовскітной структурі) без будь-якого енергетичного штрафу. Спільні багатогранні краї, і особливо спільні обличчя, викликають відштовхування катіонного катіону, і їх слід уникати. Наприклад, у рутилу, найбільш стійкого поліморфа TiO 2, октаедри TiO 6 поділяють вершини і два протилежних ребра, утворюючи стрічки в структурі. В анатазі TiO 2 кожен октаедр розділяє чотири ребра, тому поліморф анатазу менш термодинамічно стабільний.
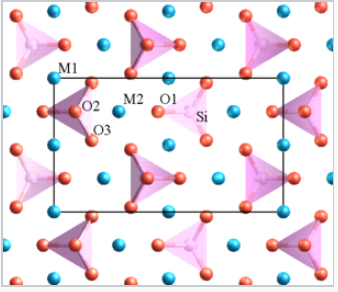
- Високо заряджені катіони в аніонних багатогранниках, як правило, не мають спільних країв або навіть вершин, особливо коли координаційне число низьке. Наприклад, в ортосилікатах, таких як олівін (M 2 SiO 4), є виділені SiO 4 4- тетраедри.
|
Будова олівіну. M (Mg або Fe) = сині сфери, Si = рожеві тетраедри, O = червоні сфери. |
Як ми скоро побачимо, всі правила Полінга виправдані на основі енергетичних міркувань решітки. В іонних сполуках розташування атомів, яке максимізує аніон-катіонні взаємодії, мінімізуючи катион-катіонні та аніон-аніонні контакти, є енергетично найкращим.