8.9: Проблеми
- Page ID
- 19780
1. Для кожної з наступних послідовностей близьких упакованих шарів вкажіть назву структури (тип структури), середовище координації катіонів (представлена малими літерами) та координаційне середовище аніонів (великі літери). Наведіть два додаткових приклади (крім самого типу структури) з'єднань з однаковою структурою.
(а) Абба Абба Абб...
(б) ААББК БКК...
(c) ACBACBACB...
(d) Каб | Каб | Каб |... («|» = ван дер Ваальса розрив)
2. Нижче наведені секції елемента блоку оксиду літію.
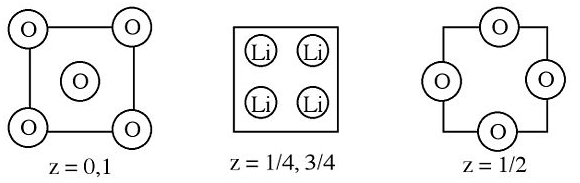
(а) Опишіть, як отримати (і отримати) емпіричну формулу.
(b) Яке координаційне число та геометрія для кожного типу іонів?
(c) Який атом щільно упакований?
(d) Який тип і фракція отворів заповнені іншим іоном?
3. Гексагональна одинична комірка нітриду металу показана нижче в розділах.
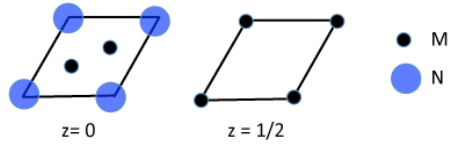
(а) Що таке емпірична формула сполуки?
(b) Скільки атомів M узгоджено з кожним атомом N?
(c) В якій групі періодичної таблиці ви очікуєте знайти M?
4. Намалюйте кубічну клітинку Li 3 Bi в секціях.
5. Якщо половина цезію видаляється зі структури CScL, таким чином, що кожен атом Cl потім чотиригранно координується, який тип структури генерується?
6. Кристалічна структура титанату барію показана нижче.
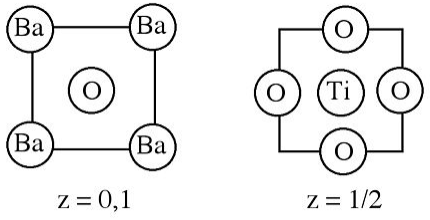
(а) Що таке емпірична формула сполуки?
(b) Які атоми (якщо такі є) близько упаковані?
(c) Скільки атомів кисню координати (i) Ti 4 + і (ii) Ba 2 +?
(d) Чому координаційні номери відрізняються?
7. Структури дисульфідів (MS 2) демонструють явно незвичайну тенденцію, що йде зліва направо через перехідний ряд. З лівого боку (TiS 2, ZrS 2, MoS 2 та ін.) знаходять шаруваті структури, тоді як посередині (ReS 2, FeS 2, RUS 2) розташовані тривимірні структури типу пірит і марказит. Праворуч (ПТ 2, СНС 2) знову розташовуються шаруваті структури. Коротко поясніть ці тенденції.
8. Поясніть, чому іонні з'єднання рідко мають шаруваті кристалічні структури.
9. Намалюйте структуру zincblende в перерізах.
10. Структура цинкбленда рідко зустрічається з дуже полярними або іонними сполуками. Однак деякі полярні та іонні сполуки (BeO, NH 4 F та ін.) мають структуру вурциту.
(a) Опишіть подібності та відмінності між структурами цинкбленда та вурциту (з точки зору координаційних чисел, послідовності укладання катіонів та аніонів тощо) (б) Чому вурцит більш іонний, ніж цинкбленд?
11. Нещодавня стаття Р.Кава та колег (Nature Materials 2010, 9, 546-9) описує незвичайні електронні властивості сплаву Y-Pt-Bi, структура якого показана в розділах нижче:
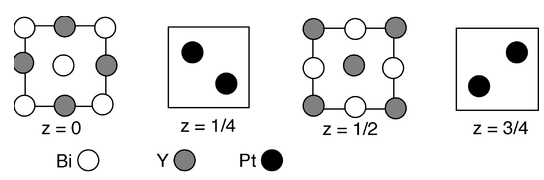
(а) Що таке стехіометрія сполуки?
(b) Скільки Y і скільки атомів Pt координують кожен атом Bi?
12. Структура флюориту, CaF 2, яка генерується шляхом заповнення всіх чотиригранних отворів у масиві FCC, є загальним типом структури MX 2.
(а) Що таке координаційне середовище F в гіпотетичному відносному CaF 2, в якому Ca утворює hcp масив, а F займає всі чотиригранні ділянки?
(б) Запропонуйте причину, чому структура, описана в (а), дуже рідкісна.
13. Структура куприту (Cu 2 O) пов'язана з цинкблендом (або алмазом) тим, що кисень займає як позиції Zn, так і S, а між ними мідь. Це зображено схематично праворуч. Власне, в куприте є дві такі взаємопроникаючі мережі без зв'язків між ними. Намалюйте другу мережу в порожній осередку. Якщо скласти дві половинки разом і вийняти мідь, яку кубічну пакувальну решітку ви отримаєте? Це найближча пакувальна решітка? (Підказка #1: почніть з атома O на 1/2,1/2,1/2) (Підказка #2: спочатку спробуйте це олівцем)
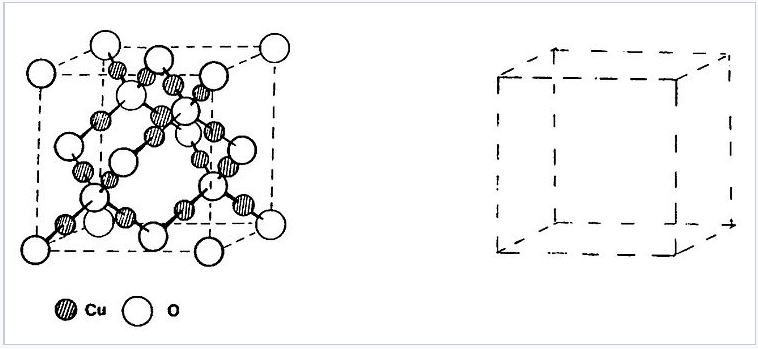
14. Намалюйте структуру рутилу на ділянках одиничної клітини і переконайтеся, що стехіометрія дорівнює MX 2. Які координаційні номери Ti і O?
15. Стішовіт - це форма високого тиску SiO 2, виявлена в метеоритних кратерах. У той час як нормальний SiO 2 має кварцову структуру, в якій кожен Si координується чотирма атомами O, стішовіт має рутилову структуру. Чи очікуєте ви, що зв'язок Si-O буде довшим у стішовите, або в кварці? Який порядок зв'язків у кожному поліморфі?
16. Na і Cl об'єднуються в співвідношенні 1:1, щоб зробити іонну решітку NaCl. Цікаво, що останні теоретичні прогнози (підтверджені синтезом високого тиску і кристалографією) виділили кілька інших стехіометрій, які утворюють стабільні кристали при високому тиску. До них відносяться Na 3 Cl, Na 2 Cl, Na 3 Cl 2, NaCl 3 і кілька інших. [8] Структура одного з цих нових хлоридів натрію показана нижче в розділах.
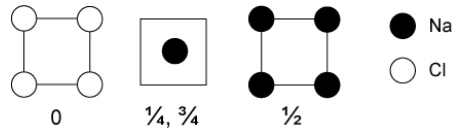
а) Що таке стехіометрія цієї сполуки?
б) Які координаційні числа Na і Cl, і як вони порівнюються з координаційними числами в металі NaCl і Na?
в) Виходячи з вашої відповіді на (б), поясніть, чому високий тиск повинен стабілізувати цю фазу.
17. Одним з нових сполук, виявлених в дослідженні, описаному в задачі 16, є NaCl 3. Існує два поліморфа цієї сполуки, один з яких містить лінійний Cl 3 - іони. Точні молекулярно-орбітальні розрахунки свідчать про те, що заряд на центральному атомі Cl у цих лінійних аніонів близький до нуля. Намалюйте структуру валентного зв'язку для Cl 3 - іона, яка узгоджується з цими спостереженнями. Чи очікуєте ви, що облігація Cl-Cl буде довшою або коротшою, ніж облігація в Cl 2?
18. Деякі солі MX можуть існувати або в структурі CscL або NaCl. Використовуйте формулу Паулінга для прогнозування довжини зв'язку M-X у структурі CScL сполуки, яка має довжину зв'язку 3,5 Å в структурі NaCl. Чи буде застосування високого тиску стабілізувати форму CScL або форму NaCl цієї сполуки? (підказка: обчислити обсяг на одиницю формули)
19. Mn 3 O 4 і Fe 3 O 4 є обидва оксиди змішаної валентності. В обох випадках на одиницю формули припадає один іон M 2+ і два іони M 3+ (M = Fe, Mn).
- (а) Однією з них є звичайна шпінель, а одна - зворотна шпінель. Поясніть, що є, і чому. (підказка: подумайте про CFSE)
- (б) Для Mn 3 O 4 якого магнітного впорядкування (феррі-, ферро- або антиферомагнітного) ви очікуєте, і чому? Можна припустити, що сусідні тетраедричні і октаедричні іони в структурі антиферомагнетично пов'язані.
- (c) Намалюйте приблизну форму кривих θ проти T та 1/θ проти T для Mn 3 O 4. Позначте будь-які спеціальні значення температури на ваших графіках.
20. Передбачте, чи повинен кожен з наступних формувати нормальну або зворотну шпінель: mGV 2 O 4, VMg 2 O 4, NiGA 2 O 4, ZnCr 2 S 4, NiFe 2 O 4. Чи могли б ви передбачити магнітне впорядкування (ферро-, феррі- або антиферомагнітні) для NiFe 2 O 4?
