5.4: Спектрохімічна серія
- Page ID
- 20221
Сильні і слабкі польові ліганди. Спектрохімічний ряд ранжує ліганди відповідно до різниці енергій Δ O між орбіталями t 2g та e g в їх октаедричних комплексах. Ця різниця енергій вимірюється в спектральному переході між цими рівнями, який часто лежить у видимій частині спектра і відповідає за кольори комплексів з частково заповненими d-орбіталями. Ліганди, які виробляють велике розщеплення, називаються сильними польовими лігандами, а ті, що виробляють невелике розщеплення, називаються слабкими польовими лігандами.

Скорочений спектрохімічний ряд - це:
Слабке поле I - < Br - < Cl - < NO 3 - < F - < ОН - < H 2 O < піридин < NH 3 < NO 2 - < CN - < CO Сильне поле
Орбітальне перекриття
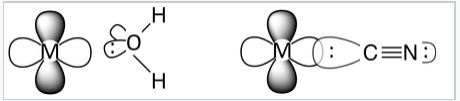
Посилаючись на молекулярну орбітальну діаграму вище, ми бачимо, що розщеплення між d-електронними рівнями відображає антизв'язуючу взаємодію між металевими орбіталями e g і лігандами. Таким чином, ми очікуємо, що напруженість поля ліганду корелюватиме з орбітальним перекриттям метал-ліганду. Таким чином, ліганди, які зв'язуються через дуже електронегативні атоми, такі як O та галогени, як очікується, будуть слабким полем, а ліганди, які зв'язуються через C або P, зазвичай є сильним полем. Ліганди, які зв'язуються через N, є проміжними за силою. Інший спосіб сказати це полягає в тому, що тверді основи, як правило, слабкі польові ліганди, а м'які основи - це сильні польові ліганди.
|
Вода є слабким польовим лігандом. Електронегативний атом O сильно відводить електрони, тому між електронною парою на O та металом d-орбіталі спостерігається погане орбітальне перекриття. Чим більше електропозитивного атома С в сильному полі ліганд СН - дозволяє краще перекривати орбіту і розділяти електронну пару. Зверніть увагу, що CN - зазвичай координує іони металів через атом С, а не атом N. |
|
Комплекси кобальту (II) мають різне забарвлення в залежності від характеру ліганда. У кристалах червоної сполуки дигідрату нітрату кобальту (II) кожен іон кобальту координується шістьма молекулами води. Катіони [Co (H 2 O) 6] 2+ і NO 3 - аніони кристалізуються, утворюючи сіль. Коли комплекс розчиняється у воді, Co (II) зберігає свою координаційну оболонку з шести молекул води і розчин має той же червоний колір, що і кристал. |
Енергетичні одиниці
Енергію можна обчислити різними способами, і корисно спробувати пов'язати енергію розщеплення Δ O з більш звичними величинами, такими як енергії зв'язку.
\[E=h\nu=h\frac{c}{\lambda} = hc{\tilde{\nu}}\]
Тут ν - частота електромагнітного випромінювання, h - постійна Планка (6,626х10 -34 Дж*с), а c - швидкість світла. \({\tilde{\nu}}\)називається «хвильовим числом» і є оберненою довжиною хвилі, зазвичай вимірюється в см -1. Енергетичні прогалини часто виражаються спектроскопістами в плані хвильових чисел.
Наприклад, червоний фотон має довжину хвилі близько 620 нм і хвильове число близько 16 000 см -1. В інших енергетичних одиницях той же червоний фотон має енергію 2,0 еВ (1 еВ = 1240 нм) або 193 кДж/моль (1 еВ = 96,5 кДж/моль). Якщо порівняти це з енергією дисоціації вуглецево-вуглецевого одиночного зв'язку (350 кДж/моль), то побачимо, що зв'язок C-C має приблизно вдвічі більшу енергію червоного фотона. Нам знадобиться ультрафіолетовий фотон (Е> 350 кДж/моль = 3,6 еВ = 345 нм = 29,000 см -1), щоб розірвати зв'язок C-C.
Ми побачимо, що Δ O широко варіюється для комплексів перехідних металів, від ближнього інфрачервоного до ультрафіолетового довжин хвиль. Таким чином, різниця енергій між орбіталями t 2g і e g може коливатися між енергією досить слабкої до досить міцної ковалентного зв'язку.
Δ O залежить як від металу, так і від ліганда. Ми можемо дізнатися щось про тенденції в Δ O, порівнявши серію d 6 металевих комплексів.
| Комплекс | Δ O (см -1) |
|---|---|
| [Ко (Н 2 О) 6] 2+ | 9 300 |
| [Ко (Н 2 О) 6] 3+ | 18 200 |
| [Ко (CN) 6] 3- | 33 500 |
| [Rh (Н 2 О) 6] 3+ | 27 000 |
| [Rh (CN) 6] 3- | 45 500 |
Важливі тенденції в Δ O:
- Комплекси Co 3+ мають більше Δ O, ніж комплекси Co 2+ з тим же лігандом. Це відображає електростатичний характер розщеплення кристалічного поля.
- Rh 3+ комплекси мають більше Δ O, ніж комплекси Co 3+. Загалом, елементи 2-го і 3-го перехідних рядів (елементи 4d і 5d) мають більший розщеплення, ніж у 3d ряду.
Для даного металу в одному стані окислення (наприклад, Co 3+) тенденція в Δ O слідує спектрохімічному ряду. При цьому Δ О більше для [Co (CN) 6] 3-, який містить сильне поле CN - ліганд, ніж для [Co (H 2 O) 6] 3+ зі слабким польовим лігандом H 2 O.
Елементи 4d і 5d схожі за своїми розмірами і хімією. Порівнюючи значення Δ O для комплексів у 3d, 4d та 5d рядах (наприклад, порівнюючи елементи в тріадах Co, Rh, Ir або Fe, Ru, Os), ми завжди знаходимо 3d << 4d 5d. Ця тенденція відображає просторову протяжність d-орбіталів і, таким чином, їх перекриття орбіталями лігандів. 3d орбіталі менші, і вони менш ефективні в склеюванні, ніж 4d або 5d. 4d і 5d орбіталі схожі один на одного через скорочення лантаноїдів. На початку 5-го ряду (між 56 Ба і 72 Hf) знаходяться чотирнадцять лантаноїдних елементів (57 La - 71 Lu).
Хоча валентні орбіталі 5d елементів знаходяться у вищій основній квантовій оболонці, ніж у 4d елементів, додавання 14 протонів до ядра при перетині лантанідного ряду скорочує розміри атомних орбіталей. Важливим результатом є те, що валентні орбіталі 4d і 5d елементів мають схожі розміри і, таким чином, елементи нагадують один одного за своєю хімією набагато більше, ніж нагадують своїх двоюрідних братів у 3-й серії. Наприклад, хімія Ру дуже схожа на аналогічну Os, як показано нижче, але досить сильно відрізняється від хімії Fe.
|
Обидва Os і Ru утворюють летючі молекулярні тетроксиди МО 4. OSo 4 використовується в реакціях епоксидування і як пляма в електронній мікроскопії. На відміну від цього, найвищим бінарним оксидом заліза є Fe 2 O 3. |
Кольори комплексів перехідних металів
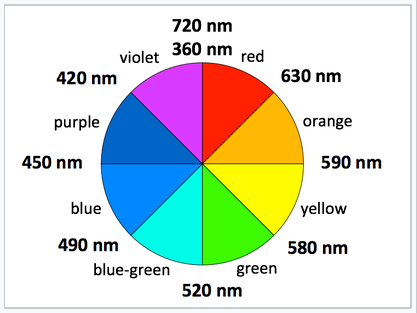
Простим, якісним способом побачити відносну енергію розщеплення кристалічного поля, Δ O, є спостереження за кольором комплексу перехідних металів. Чим вище енергія поглиненого фотона, тим більше енергетичний проміжок. Однак колір, який поглинає комплекс, доповнює колір, який він з'являється (тобто колір світла, який він відображає), що протилежно поглиненому кольору на колірному колі.
|
Додаткові кольори знаходяться через колірне коло один від одного |
Приклади: (всі d 7 Co 2+ комплекси)
[Co (H 2 O) 6] 2+ виглядає фіолетовим у своїх солей і в концентрованому розчині, оскільки він поглинається в зеленій гамі.
[Co (NH 3) 6] 2+ має солом'яний колір, оскільки він поглинає синю гаму.
[Co (CN) 6] 4-, виглядає червоним, поглинає в фіолетову і ультрафіолетову частину спектра. Це узгоджується з думкою про те, що CN - це більш сильний польовий ліганд, ніж NH 3, тому що енергія УФ-фотона вище, ніж у червоно-оранжевого фотона.
Цей метод застосуємо до більшості комплексів перехідних металів, оскільки більшість з них поглинають десь у видимому діапазоні (400-700 нм = 25000 до 14 300 см -1), або мають ультрафіолетові переходи, які хвостові у видиме, роблячи їх жовтими; однак існують такі комплекси, як [Rh (CN) 6] 3- які здаються безбарвними, оскільки їх переходи d-d знаходяться в ультрафіолеті. Інші комплекси, такі як [Mn (H 2 O)] 6 2+ слабо забарвлені, оскільки їх d-d переходи передбачають зміну спінового стану комплексу.