8.1: Карбоніли металу
- Page ID
- 17727
Цілі навчання
У цій лекції ви дізнаєтеся наступне
- Історичні передумови виникнення карбонільних комплексів металів.
- Ліганд СО і його зв'язує здатність до металу.
- Синергізм між лігандом до металу вперед σ—донорство та металом до ліганду назад π—донорство спостерігається при взаємодії метал-СО.
- Синтез, характеристика та їх реакційна здатність карбонільних сполук металів.
Карбоніли металів - важливий клас металоорганічних сполук, які вивчалися протягом тривалого часу. Ще в 1884 році Людвіг Монд, спостерігаючи, що нікелеві клапани поїдають газом СО в галузі переробки нікелю, нагрівав порошок нікелю в потоці газу CO, щоб синтезувати першу відому карбонільну сполуку металу у вигляді Ni (CO) 4. Таким чином, народився знаменитий процес переробки Монда, заснований на передумові, що летюча сполука Ni (CO) 4 може бути розкладена на чистий метал при підвищеній температурі. Згодом Монд заснував Mond Nickel Company Limited для очищення нікелю від своєї руди цим методом.
Карбонільний ліганд (СО) багато в чому відрізняється від інших лігандів. Наприклад, на відміну від алкільних лігандів, карбонільний (СО) ліганд ненасичений, що дозволяє не тільки ліганду π−донати, але й приймати електрони у своїй π* орбіталі з d π металевих орбіталів і тим самим роблячи ліганд CO π−кислим. Інша відмінність полягає в тому, що СО є м'яким лігандом порівняно з іншими поширеними π−та π−основними лігандами, такими як H 2 O або алкоксиди (RO−), які розглядаються як тверді ліганди.
Будучи π−кислотним за своєю природою, СО є сильним польовим лігандом, який досягає більшого d -орбітального розщеплення через метал до ліганду π−назад донорства. Таким чином, зв'язуюча взаємодія метал-СО включає донорство СО до металу σ−донорство та пожертвування металу до CO π−назад (рис.\(\PageIndex{1}\)). Цікаво, що як спектроскопічні вимірювання, так і теоретичні дослідження свідчать про те, що ступінь донорства металу до CO π−назад майже дорівнює або навіть перевищує ступінь донорства CO до металу σ−в металі карбонільних комплексів. Це спостереження узгоджується з тим, що центри низьковалентних перехідних металів мають тенденцію утворювати карбонільні комплекси металів.
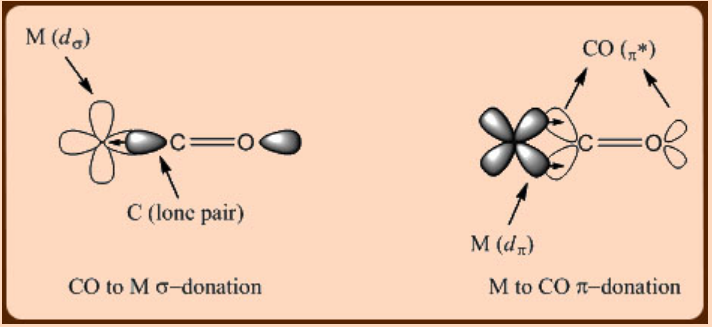
У карбонільних комплексах металів пряме перенесення π−зворотного пожертвування спостерігається на відстані зв'язку M−C, яка стає коротшою порівняно з нормальною відстані одиночного зв'язку M−C. Наприклад, комплекс CPMo (CO) 3 CH 3 демонструє два види міжзв'язкових відстаней M−C, які складаються з більшої відстані Mo−CH 3 (2,38 Å) та набагато меншої відстані Mo−Co (1,99 Å), що виникає з металу до ліганду π−назад пожертвування. Таким чином стає очевидним, що взаємодію метал-СО можна легко охарактеризувати за допомогою рентгенівської кристалографії. Інфрачервона спектроскопія також може бути однаково успішно використана при вивченні взаємодії метал−СО. Оскільки склеювання металу до СО π−назад включає π−донорство від металу d π орбіталі до π* орбіти зв'язку C−O, значний зсув частоти розтягування σ (СО) у бік нижчої енергії спостерігається у металевих карбонільних комплексах відносно вільного СО (2143 см −1). ).
Приготування карбонільних комплексів металів
Поширеними методами отримання карбонільних сполук металу є,
i Безпосередньо за допомогою СО
\[\ce{Fe ->[CO, \: 200atm, \: 200°C] Fe(CO)5}\]
Основна вимога цього методу полягає в тому, що металевий центр повинен знаходитися в зниженому стані низького окислення, щоб полегшити зв'язування СО з металевим центром через метал до ліганду π−назад донорство.
II. Використання СО і відновника
\[\ce{NiSO4 + CO + S2O4^{2-} -> Ni(CO)4}\]
Цей метод зазвичай називають відновним карбонілуванням і в основному використовується для сполук, що мають більш високі центри окислення металів. Відновлювач спочатку зменшує металевий центр до нижчого ступеня окислення перед зв'язуванням СО з утворенням карбонільних сполук металу.
iii. З карбонільних сполук
цей метод передбачає абстрагування СО з органічних сполук, таких як спирти, альдегіди і СО 2.
Реактивність карбонілів металів
i. нуклеофільна атака на вуглець
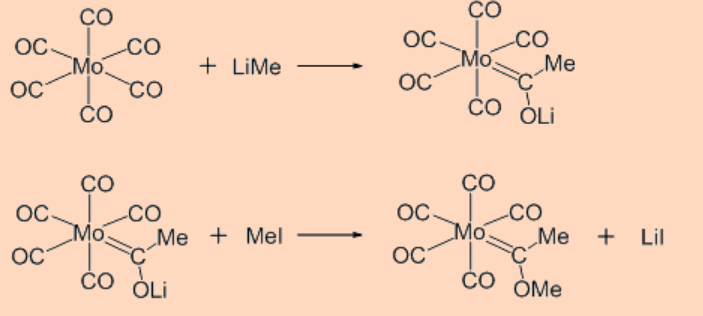
Реакція зазвичай породжує карбеновий фрагмент.
II. Електрофільна атака на кисень
\[\ce{Cl(PR3)4Re-CO + AlMe3 -> Cl(PR3)4Re-CO -> AlMe3}\]
iii. Реакція міграційної вставки
\[\ce{MeMn(CO)5 +PMe3 -> (MeCO)Mn(CO)4(PMe3)}\]
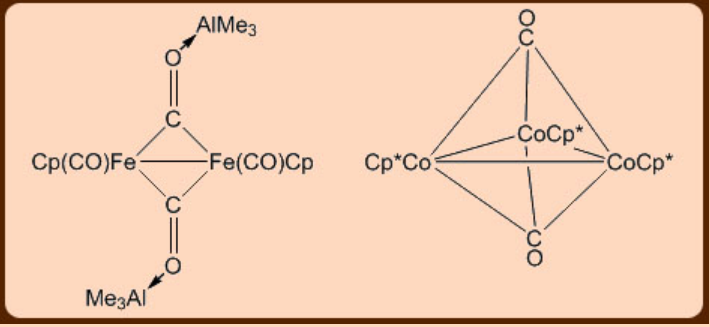
Карбоніл металу відображає два види зв'язків у вигляді термінального та мостового режимів. Інфрачервона спектроскопія може легко розрізнити ці два режими зв'язування карбонільного фрагменту металу, оскільки кінцеві показують смугу розтягування (СО) на відстані приблизно 2100-2000 см −1, тоді як мостові виявляються в діапазоні 1720−1850 см −1. Карбонільний фрагмент може перемикатися між більш ніж двома металевими центрами (рис.\(\PageIndex{2}\)).
Проблеми
1. Скільки самотніх пар в молекулі СО?
Відповідь: Три (один з вуглецю і два з кисню).
2. Незважаючи на те, що O є більш електронегативним, ніж C, дипольний момент СО майже дорівнює нулю. Поясніть.
Відповідь: Через донорство електронів з кисню до вуглецю.
3. Який тип металевих центрів утворюють карбонільні комплекси металів?
Ans: Центри низьковалентних металів.
4. Які два основні режими зв'язування виставлені лігандом СО?
Відповідь: Термінальний і мостовий режими прив'язки.
Тест на самооцінку
1. Передбачити продукт реакції?
\[\ce{Ni + CO_{Excess} ->}\]
Відповідь: Три (один з вуглецю і два з кисню).
2. При зв'язуванні з металевим центром частота розтягування C−O збільшується/зменшується відносно частоти вільного СО?
Відповідь: Зменшується.
3. Поясніть, чому центри низьковалентних металів стабілізують зв'язування СО в карбонільних комплексах металів?
Відповідь: Тому що метал до ліганду π−назад пожертвування.
4. Наведіть приклад хорошого π−донора та π−донорського ліганду?
Відповідь: Алкоксиди (RO -).
Резюме
СО є відмінною рисою ліганд металоорганічної хімії. Карбонільні комплекси металів вивчалися давно. Ліганди СО щільно зв'язуються з металевим центром за допомогою синергетичного механізму, який включає σ−донорство пари лігандів на метал з подальшим пожертвуванням π−назад із заповненого металу d орбітальної до вакантної σ* орбіти C−O зв'язку CO ліганду. Карбонільні комплекси металів готують декількома методами. Карбонільні комплекси металів зазвичай стабілізуються металевими центрами в низьких станах окислення.
