5.3: ХІМ АТЛАС_3
- Page ID
- 27780
Як це з'єднується: блок 3, лекції 21-30
Мета цього документа - служити керівництвом і ресурсом, який дає вам короткий огляд кожної лекції. Для кожної лекції є короткий виклад основних тем, які охоплюються, «Чому це важливо момент» та новий розділ «Чому це працює», а також кілька прикладів проблем. Так чому ж ми це зробили? Ми сподіваємося, що корисно отримати хороший знімок будь-якої прочитаної лекції. Незалежно від того, чи не змогли ви потрапити на лекцію чи не могли перестати думати про лекцію, це спосіб швидко зрозуміти зміст. Це також дає мені можливість надати додаткові деталі, на які я, можливо, не встигаю в прикладі Чому це має значення, а також дозволяє мені спробувати розділ Чому це працює, який я, звичайно, не встигну обговорити багато в лекції. Сподіваюся, ви знайдете його корисним!
Один момент про ці конспекти лекцій. Зверніть увагу, що конспекти лекцій не призначені для заміни конспектів лекцій. Якби ви читали лише ці резюме і не ходили на лекції, так, ви б отримали гарне розуміння лекції з дуже високого рівня зору, але ні, ви не отримаєте достатньо з цього, щоб це було вашим єдиним ресурсом для вивчення матеріалу!
Нижче наведено зображення Іспит 3 Концептуальна карта. Це демонструє, як кожен з аспектів курсу поєднується: у вас є багато ресурсів! Проблеми практики, декламації, Goodie сумки, і лекції не оцінені ресурси, які допоможуть вам підготуватися до вікторин та іспитів. Всі матеріали, перераховані на цій концептуальній карті, є чесною грою для іспиту 3.

Лекція 21: Закон Брегга та рентгенівська дифракція
Резюме
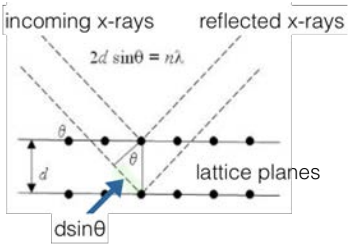
Рентгенівська дифракція (XRD) - метод, який використовується для характеристики твердих тіл. Він спирається на дифракцію рентгенівських променів на вражаючі кришталеві площини (літаки Міллера, про які ми дізналися!) Припускаючи, що кожна площина атомів є безперервною, і що вони відображають вхідні рентгенівські промені таким чином, що кут падіння та відбитий кут рівні, Бреггс вивів рівняння, яке носить їх назву, і пов'язує відстань між повторюваними площинами (\(\mathrm{d}\)) та рентгенівським кутом падіння ( \(\theta\)) до довжини хвилі рентгенівського випромінювання:
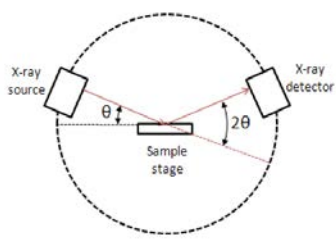
Два рентгенівських промені, що вражають еквівалентні площини Міллера з однаковим кутом падіння, будуть конструктивно заважати, якщо додаткова відстань, що одна з подорожей дорівнює довжині хвилі рентгенівського знімка. Кількісно\(\lambda=2 d \sin \theta\), якщо інтенсивність вихідних рентгенівських променів з довжиною хвилі\(\lambda\) посилюється. конструктивні перешкоди будуть виникати всякий раз, коли відстань довжини шляху є цілим числом кратним довжині хвилі:\(2 d \sin \theta=n \lambda\) для цілого числа\(\mathrm{n}\). Для\(3.091\), ми припустимо\(n=1\). Коли виникають конструктивні перешкоди, сигнал дійде до детектора в машині XRD, і пік буде спостерігатися на графіку інтенсивності рентгенівського випромінювання. При руйнівному втручанні ніякого піку не буде спостерігатися. Знання кута, який породжує пік, а також довжину хвилі падаючих рентгенівських променів дозволяє нам отримати відстань між площинами, які спричинили відображення. Це відомо як стан Брегга:
\(2 d_{h k l} \sin \theta_{h k l}=\lambda\)
Для даної площини Міллера, позначеної\((h k l)\), умова Брегга задовольняється парою\((d, \theta)\) міжплощинних інтервалів і кута падіння.
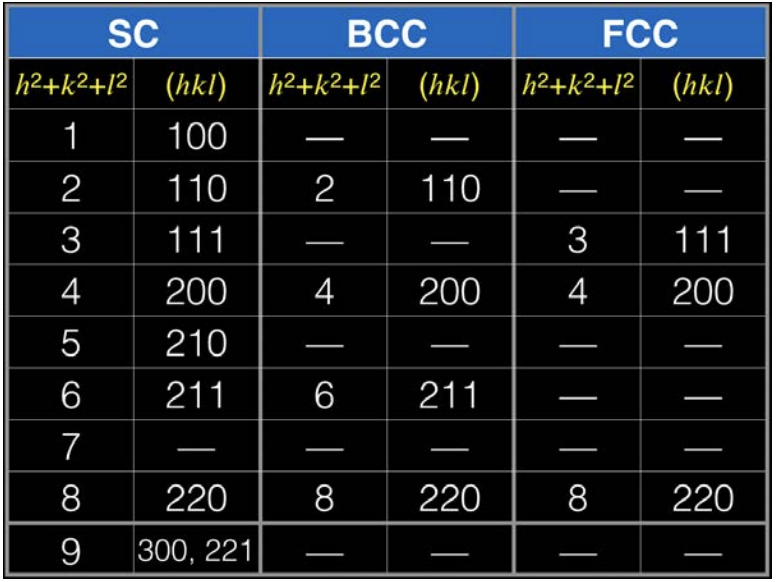
Для кожної з кристалічних структур (SC, BCC або FCC) існують відображення, які навіть при виконанні умови Брегга призводять до руйнівних перешкод, обумовлених кристалічною симетрією. Візерунок пікових абсансів використовувався для отримання набору правил, які називаються правилами вибору, які дозволяють нам знати або, принаймні, звузити можливості кристалічної структури матеріалу на основі його XRD-піків. Для випадку з СК немає ніяких правил і будь-яка площина - це нормально. Немає заборонених роздумів.
Для випадку\(\mathrm{BCC}\), дозволені роздуми -\(\mathrm{h}+\mathrm{k}+\mathrm{l}\) це ті, де парне число. Заборонене відображення\(\mathrm{h}+\mathrm{k}+\mathrm{l}\) - це ті, для яких непарне число. У випадку\(\mathrm{FCC}\), дозволені роздуми - це ті, де\(\mathrm{h}, \mathrm{k}, \mathrm{l}\) всі\(\mathrm{h}, \mathrm{k}, \mathrm{l}\) непарні або всі парні. Заборонені роздуми FCC - це ті, де h, k, l змішується непарна/парна.
Чому це важливо
Для твердих тіл структура може бути настільки ж важливою, як і сама хімія, і вони глибоко пов'язані між собою. Коли я дивлюся на кристалічну структуру елемента в Періодичній таблиці, я бачу, що це за земля або найнижчий енергетичний стан цього елемента. Це загальне «щасливе місце», енергетично кажучи, матеріалу. Але матеріали можуть взяти на себе інші, метастабільні структури і бути дуже щасливими там теж. І чому це має значення, тому що властивості можуть бути абсолютно різними залежно від того, яку кристалічну структуру приймає матеріал, а XRD є єдиним найважливішим методом характеристики, який ми маємо визначити кристалічну структуру. Ми вже бачили різницю між графітом і алмазом, який містить той самий точний елемент (вуглець), але просто розташований в іншій структурі. Те ж саме стосується, ну, майже все. Візьмемо для прикладу інший елемент, залізо.
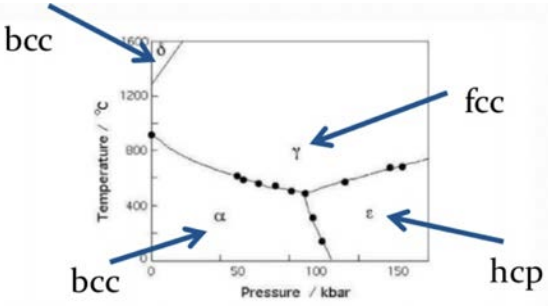
Ось діаграма фази для заліза. Як ви пам'ятаєте з лекції 14, фазова діаграма - це графік різних фаз матеріалу як функції деяких змінних, в даному випадку тиску та температури. Зверніть увагу, що при нормальних або «навколишніх» умовах температури (\(\approx 300\mathrm{K}\)) і тиску (\(\approx 1 \mathrm{bar}\)) залізо є\(\mathrm{BCC}\) кристал. Це також те, що ви знайдете, якщо ви подивитеся на його кристалічну структуру в PT. Але зверніть увагу, читаючи фазову діаграму, що якщо ми підвищуємо температуру\(\mathrm{FCC}\), вона стає, і якщо ми підвищуємо тиск, він переходить у фазу HCP (це не кубічна, тому ми її не покрили). Цікавий факт: якщо ви продовжуєте підвищувати температуру, врешті-решт, вона повернеться до буття\(\mathrm{BCC}\).
Причина, по якій все це має значення, полягає в тому, що структура змінює властивості. У випадку з залізом впливають магнітні властивості елемента. Якщо це FCC, то це буде «антиферомагнітний», на відміну від «феромагнітної» поведінки BCC. Я рекомендую пройти курс магнетики в майбутньому, щоб дізнатися більше про ці терміни! Це має величезні наслідки для магнітних технологій. І я знаю, що ви, мабуть, думаєте: звичайно, але ми не будуємо занадто багато технологій на основі заліза, які працюють на 1000\(\mathrm{K}\)! Ви маєте рацію, але хитрість полягає в тому, що часто ми можемо змусити ці матеріали застрягти в одній з цих метастабільних фаз, а потім використовувати його для технологій, поки він знаходиться в цій фазі. Знову ж таки, алмаз є чудовим прикладом: це не основний стан вуглецю, тому він метастабільний як алмаз замість графіту, але ми знаємо, що він застряг там протягом тривалого часу, тому для більшості технологій, які використовують алмаз (скажімо, ювелірний виріб), ми не турбуємося про те, що він зміниться з метастабільної фази.
Повертаючись до теми лекції, коли ми робимо щось, чи це щось таке старе, як елементарне залізо, або таке нове, як наноструктурований перовскіт, найпростіший і найпоширеніший спосіб, який ми маємо сказати, що його кристалічна структура - це\(\mathrm{XRD}\). У деяких випадках використання\(\mathrm{XRD}\) може розгадати структурну таємницю матеріалу, як у випадку з подвійною спіраллю для ДНК або багатьох білків з тих пір. В інших випадках він використовується для того, щоб не розблокувати секрет абсолютно нової структури, а скоріше класифікувати матеріал на ту чи іншу відому структуру. Іноді причина полягає в тому, щоб зрозуміти матеріал, іноді це розробити властивості матеріалу, і часто це обидва. Але якою б не була мотивація, цей неймовірно потужний інструмент характеризації зробив революцію в тому, що ми знаємо про тверді речовини.
Чому це працює
Ми посилалися на ці кристалографи (які дуже прискіпливі до позначення!) на кілька лекцій зараз. Але хто ці люди? І ще до справи: хто їх наймає? Багато рентгенівських кристалограф робочих місць є в біотехнологічній промисловості, в компаніях будь-якого розміру. Blueprint Medications, який виглядає як Гарвардський спін-аут і знаходиться просто вниз по вулиці, має відкриття тепер з назвою «Старший вчений/головний науковий співробітник, рентгенівська кристалографія», з першим опису функції роботи є: «Забезпечити рентгенівський кристалографічний і білкову структурно-функціональну підтримку, в тому числі структурований дизайн лікарських засобів, до поточних проектів з виявлення наркотиків та нових ініціатив щодо виявлення цілей». А більші фармацевтичні та біотехнологічні компанії мають ще більше робочих місць. Візьміть Novartis, який також має велику штаб-квартиру поблизу MIT, просто вниз Mass Ave. Вони наймають людей для виконання» експериментів з кристалографії, включаючи скринінг кристалізації з використанням автоматизованої обробки рідини. GlaxoSmithKline має отвір для когось, щоб «включити більш високу пропускну здатність рентгенівської кристалографії». Джонсон і Джонсон наймають людей з рентгенівською експертизою кристалографії, щоб зробити «автоматизовану хімію». І я повинен згадати останній приклад через назву їх нинішнього відкриття, Брістоль-Майєрс-Сквібб шукає «Дослідник, твердотільна хімія». Повинен любити його! Вони хочуть, «вчений початкового рівня з досвідом рентгенівської кристалографії, рентгенівської дифракції та твердотільної характеристики». Ось тепер ви!
І справа не вся в фармі. Лікарні також наймають рентгенівських кристалографів (це не така ж позиція, як рентгенолог), для роботи над дослідницькими проектами, наприклад, з відкриттями в Mass General та Dana Farber. І багато дослідницьких позицій в рентгенівській дифракції теж там, від позицій в медичному інституті Говарда Х'югса до університетських лабораторій і центрів по всій країні.
Приклади проблем
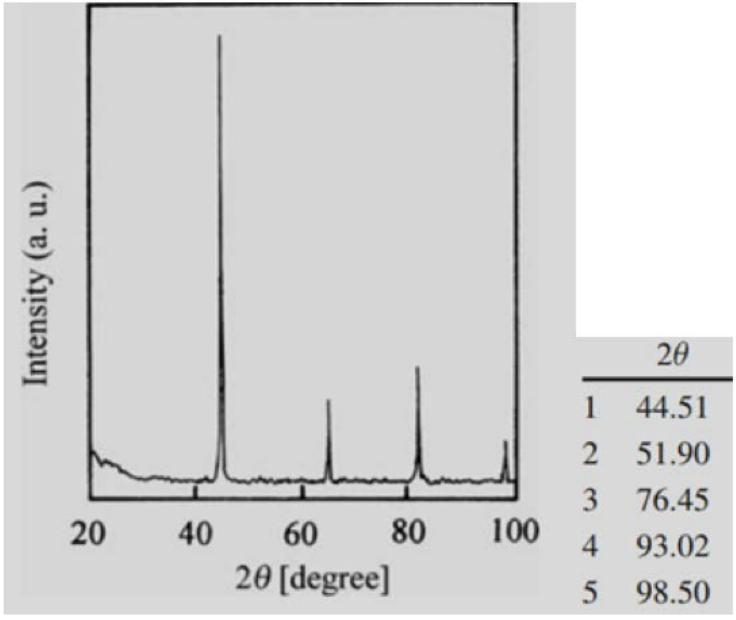
1. Визначте структуру (проста кубічна, кубічна по центру тіла або кубічна грань по центру), якій ця\(\mathrm{XRD}\) картина, швидше за все, відповідає (використовувалися\(\kappa_{\alpha}\) рентгенівські промені міді).
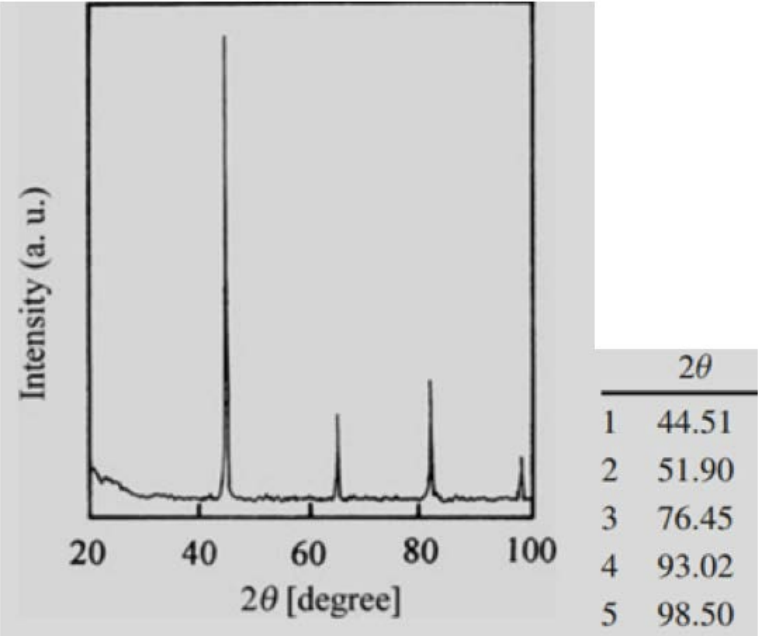
- Відповідь
-
З огляду на, що індекси кожної площини або всі непарні, або всі парні, за допомогою правил вибору ми можемо визначити, що ця структура є\(\mathrm{FCC}\).
Лекція 22: Від рентгенівської дифракції до кристалічної структури
Резюме
Цю лекцію ми закінчили, аналізуючи\(\mathrm{XRD}\) спектр\(\mathrm{Al}\) вибірки, показаний нижче.
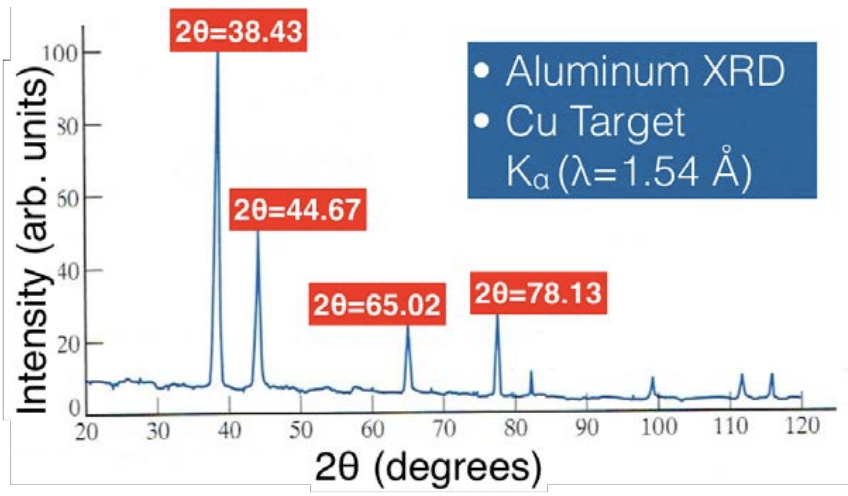
Сюжет був отриманий шляхом сяючих\(\mathrm{K}\) -альфа-рентгенівських променів від\(\mathrm{Cu}\) мішені на наш\(\mathrm{Al}\) зразок. Що ми хочемо зробити, це з'ясувати кристалічну структуру та постійну решітки\(\mathrm{Al}\). Щоб відповісти на ці питання, нам знадобиться наше зручне рівняння відстані між площинами Міллера (де\(\mathrm{d}\) '' - відстань між двома повторюваними площинами Міллера з індексами\(\mathrm{hkl}\) в кубічній системі, а\(a\) '' - константа решітки):
\(d_{h k l}=\dfrac{a}{\sqrt{h^2+k^2+{ }^2}}\)
і стан Брегга:
\(2 d_{h k l} \sin \theta_{h k l}=\lambda\)
Зверніть увагу, що обидва ці рівняння включають\(d_{h k l}\). Ми можемо використовувати це на нашу користь і замінити одне рівняння\(d_{h k l}\) на інше, щоб отримати наступне:
\(\left(\dfrac{\lambda}{2 a}\right)^2=\dfrac{\left(\sin \theta_{h k l}\right)^2}{h^2+k^2+l^2}\)
Ми знаємо значення довжини хвилі, тому що вона фіксується\(K_a\) рентгенівськими променями від джерела міді. Ці рентгенівські промені мають довжину хвилі\(1.54 \AA\). Так вираз для нашого прикладу стає:
\(\left(\dfrac{1.54 \AA}{2 a}\right)^2=\dfrac{\left(\sin \theta_{h k l}\right)^2}{h^2+k^2+l^2}\)
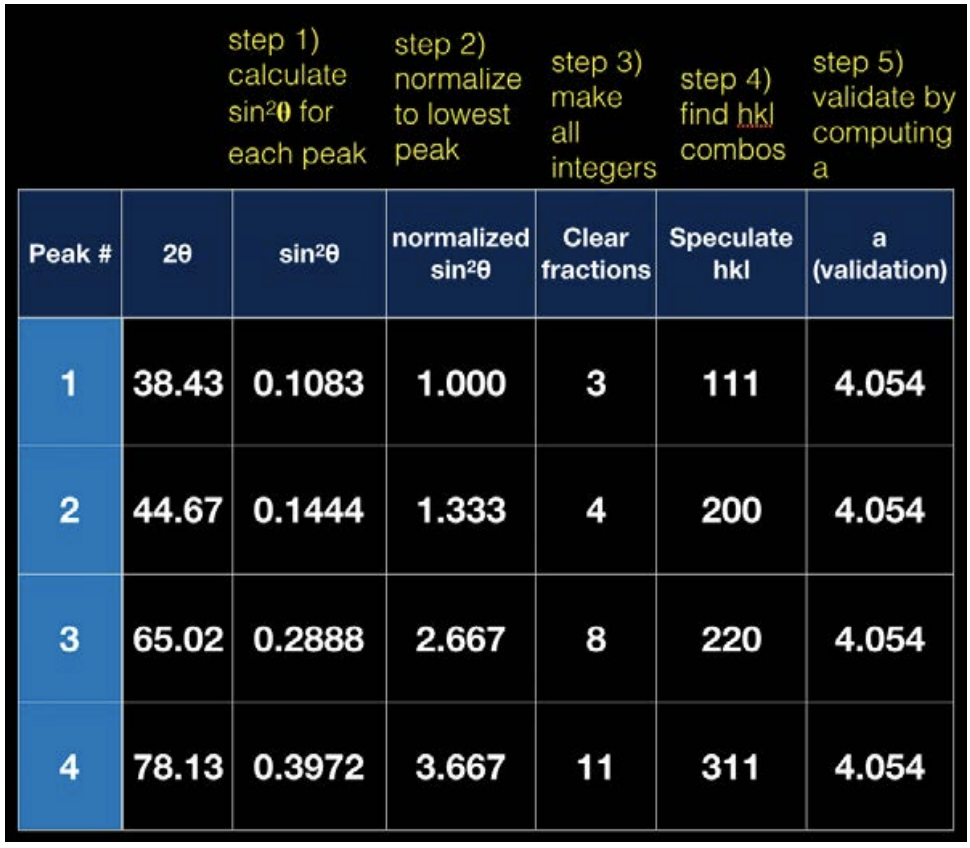
Тепер у нас є константи по обидва боки знака рівності, тому що параметр решітки не змінюється. Ми можемо зробити освічене здогадання про\(\mathrm{hkl}\) значення, дотримуючись процедур, викладених на діаграмі на наступній сторінці.
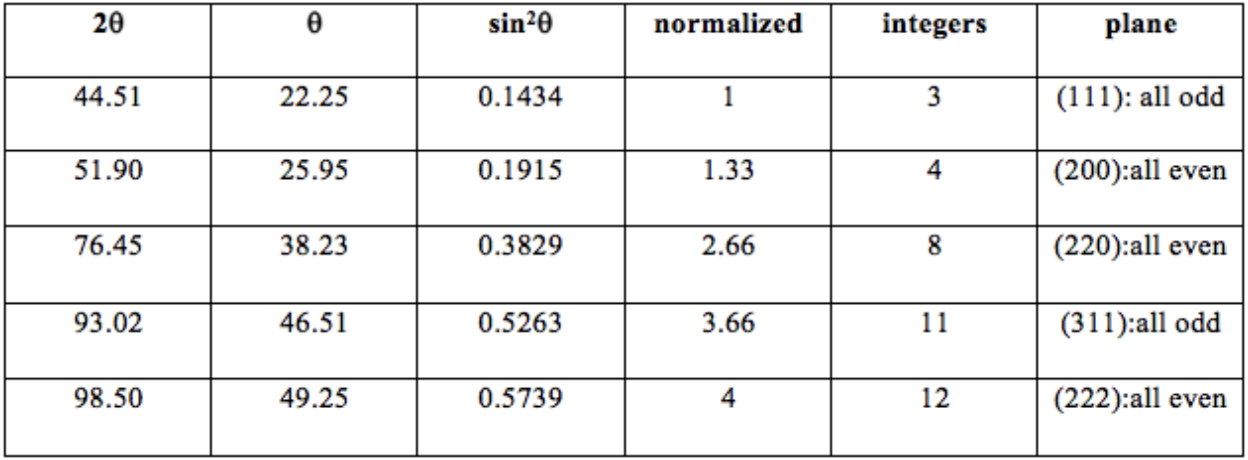
З правил вибору ми знаємо, що\(\mathrm{Al}\) це\(\mathrm{FCC}\) метал, оскільки комбінації (\(\mathrm{hkl}\)) завжди або всі парні, або всі непарні. Ми також можемо взяти значення\(\theta\) і значення h, k і l і підключити їх до рівняння вище, щоб знайти параметр решітки, вказаний в крайньому правому стовпці діаграми.
Чому це важливо

Фото Генрі Мозлі знаходиться у відкритому доступі.
Це Генрі Мозлі (образ, Королівське товариство хімії). Він зображений там, у своїй лабораторії, тримаючи в руках, звичайно, модифіковану електронно-променеву трубку. Він експериментував з рентгенівськими променями. Але інтереси Мозлі були менше щодо кристалічних структур та умов Брегга, а більше про самі рентгенівські лінії та те, що вони означали. Він проводив систематичне дослідження металів, що використовуються для генерації рентгенівських променів, порівнюючи рентгенівське випромінювання 38 різних хімічних елементів.
Деяка робота вже була зроблена, яка привела до нашого розуміння характерних і безперервних частин спектру генерації рентгенівських променів, як ми обговорювали кілька лекцій тому. Але повного систематичного дослідження не проводилося до роботи Мозлі. Погляньте на різницю між двома рентгенівськими спектрами, що генеруються з двома різними цілями:\(\mathrm{Mo}\) і\(\mathrm{Cu}\). Зверніть увагу на\(\mathrm{K}_{\beta}\) лінії\(\mathrm{K}_{\alpha}\) і для кожного з них, і що вони зміщені на нижчу довжину хвилі для\(\mathrm{Mo}\) порівняно з\(\mathrm{Cu}\). Як ми знаємо, це пов'язано з різницею в енергії між оболонками\(n=1\) і\(n=2\) (для\(\mathrm{K}_{\alpha}\)) або\(n=1\) і\(n=3\) (для\(\mathrm{K}_{\beta}\)), і має сенс ця різниця енергії більша (відповідає меншій довжині хвилі),\(\mathrm{Mo}\) оскільки вона важча, ніж \(\mathrm{Cu}\). Але в чому саме полягає залежність, і чому вона присутня? Давайте розглянемо дані для послідовності цілей, безпосередньо з підмножини даних Мозлі.
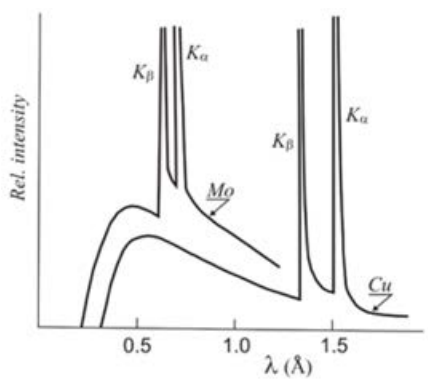
Це характерні рентгенівські лінії для\(\mathrm{Ca}\) наскрізних\(\mathrm{Zn}\), так що йдуть поперек\(\mathrm{d}\) -блокових елементів четвертого ряду в ПТ. Зауважте, що це не насправді,\(\mathrm{Zn}\) а скоріше латунь, яка, як ми вже дізналися, є сумішшю\(\mathrm{Zn}\) з\(\mathrm{Cu}\) - це тому\(\mathrm{Zn}\), що вона плавиться під високоенергетичною бомбардуванням електронів, перш ніж вона може видавати будь-які характерні рентгенівські промені, тому Мозлі надав йому додаткову силу, яку вона потребувала. шляхом виготовлення латуні, а потім віднімається викид з\(\mathrm{Cu}\). Приємний трюк!
Мозлі виявив, що якщо характерні лінії випромінювання були побудовані як квадрат їх енергії проти атомного номера, то ви отримаєте пряму лінію. Він підходить до даних, враховуючи лінії, що надходять від збудження ядра, тому різниця рівнів енергії від моделі Бора:
\(E_{x-r a y}=13.6[e V](Z-1)^2\left(\dfrac{1}{1^2}-\dfrac{1}{2^2}\right)=\dfrac{3}{4}(13.6[\mathrm{eV}])(Z-1)^2\)
Це тепер називається законом Мозлі. Чи можете ви зрозуміти, чому це\(\mathrm{Z}-1\) замість того\(\mathrm{Z}\), як у моделі Бора? Це тому, що електрон, що каскадується вниз, щоб генерувати рентген, «бачить» 1-електронний скринінг ядра. Це тому, що один з цих електронів ядра 1s був вибитий, але є один залишився там, який екранує позитивний заряд, отже,\(\mathrm{Z}-1\). Так що ж означала ця тенденція в даних? Ось що сказав Мозлі у своїй статті 1913: «У нас є доказ того, що в атомі є фундаментальна величина, яка збільшується регулярними кроками, коли один переходить від одного елемента до іншого. Ця величина може бути лише зарядом на центральному позитивному ядрі, існування якого ми вже маємо певні докази».
Причина цього така велика справа, і чому я роблю це Чому це має значення для цієї глави, полягає в тому, що навіть через Менделєєва Менделєєва була навколо і більше елементів були виявлені і додаються, був великий недолік в періодичній таблиці: позиція, передбачена атомною вагою елемента не завжди відповідав позиції, передбаченій його хімічними властивостями. Пам'ятайте, що позиціонування Менделєєва базувалося на вазі та властивостях, і коли періодичність вимагала цього, він вирішив впорядкувати елементи на основі їх властивостей, а не їх атомної ваги. Але чи було щось більш фундаментальне, ніж атомна вага?
Дані Мозлі мали сенс лише в тому випадку, якщо позитивний заряд в ядрі збільшувався рівно на одну одиницю, коли ви переходите від одного елемента до наступного в ПТ. Іншими словами, він виявив, що атомний номер елемента ідентичний тому, скільки протонів він має! Я знаю, що це здається очевидним для нас зараз, але тоді «атомний номер» був просто числом без сенсу, крім місця елемента в періодичній таблиці. Вважалося, що атомний номер не пов'язаний з будь-якою вимірною фізичною величиною. Для Менделєєва періодичність була за атомною масою і хімічними властивостями; для Мозлі - за атомним номером. Це призвело до набагато глибшого розуміння таблиці Менделєєва і його прозріння відразу допомогло зрозуміти деякі ключові таємниці, наприклад, де розмістити лантаноїди в ПТ\((\mathrm{La}=\# 57, \mathrm{Lu}=\# 71)\), або чому\(\mathrm{Co}\) виникає раніше\(\mathrm{Ni}\). І прогалини, які Менделєєв блискуче залишив відкритими у своєму ПТ, щоб створити періодичність, тепер мали сенс, пропускаючи атомні номери в послідовності\(43,61,72\), наприклад елементи, і\(75\) тепер, як відомо, містять багато протонів (вони були виявлені пізніше іншими вченими: технецієм, прометиєм, гафній і реній).
Мозлі трагічно загинув у 1915 році у віці 27 років у битві в Першій світовій війні. У 1916 році не було присуджено Нобелівських премій з фізики чи хімії, що, як вважають, було зроблено для вшанування Мозлі, який, безумовно, заслужив.
Чому це працює
Ми розглянули генерацію рентгенівських променів та виробників машин дві глави тому, і в останньому розділі ми розглянули робочі місця, пов'язані з рентгенівською кристалографією. Для цього останнього Чому це працює, пов'язане з рентгенівськими променями, настав час піти великим або повернутися додому. І коли я кажу великий, я маю на увазі дійсно великий. Коли електрони або для цього питання будь-які заряджені частинки прискорюються до близьких швидкостей світла, то прискорення, яке вони відчувають, просто щоб залишитися в петлі, виробляє масово енергійне випромінювання. Довжина хвилі може різко змінюватися, але дуже часто ці величезні прискорювачі використовуються для виготовлення надвисоких енергій рентгенівських променів. Інтенсивність цих променів сліпуче яскрава, в мільйони разів яскравіше сонячного світла і в тисячі разів інтенсивніше, ніж рентгенівські промені, вироблені іншими способами. Цей рівень яскравості робить їх корисними практично для будь-яких і всіх областей досліджень і галузей науки. Деякі типи вимірювань можливі лише при використанні синхротронного світла, а для інших типів можна отримати більш якісну інформацію за менший час, ніж при використанні традиційних джерел світла. Вони виявилися корисними у багатьох областях, що неможливо перерахувати їх усіх, але, звичайно, в біології, хімії, фізиці, матеріалах, медицині, відкритті наркотиків та геології, щоб назвати лише кілька полів, синхронітрони зробили драматичний вплив. Вони користуються таким попитом, що часто потрібно бронювати час на них багато місяців вперед. Типовий синхротрон може мати цілих 50 «ліній променя», які захоплюють рентгенівські промені високої енергії з циклу і фокусують їх у промені, де проводяться експерименти. Ці лінії, як правило, бронюються і використовуються 24 години на день, 7 днів на тиждень, цілий рік. Ось фото одного з них, вдосконаленого джерела фотонів у Національній лабораторії Аргонна в штаті Іллінойс. Їх оглядова заява гласить: «Розширений джерело фотонів (APS) в Аргоннській національній лабораторії Міністерства енергетики США забезпечує надяскраві, високоенергетичні накопичувальні кільцеві рентгенівські промені для досліджень майже у всіх наукових дисциплін».

Працевлаштування частина цього досить прохолодно. Ці споруди, які називаються «синхронітронами», є у всьому світі, і вони вимагають тисячі людей, щоб побудувати, а потім запустити. Міжнародний характер їх вражає: просто виконайте пошук зображень для синхротрона, і ви знайдете їх фотографії по всій планеті. А це означає, що робочі місця в різних місцях. Деякі старі, як той, що в Національній лабораторії Берклі (але це все ще ногами!) , деякі з них середнього розміру, як APS на фото вище, а деякі величезні, як адронний колайдер, на який я посилався в останній лекції як місце, де було винайдено 3D-рентгенівське зображення. Коллайдери також є синхронними джерелами світла, оскільки вони створені для прискорення частинок на дуже високих швидкостях. Незважаючи на те, що колайдери можуть бути використані для розбивання частинок разом на цих швидкостях, вони також часто використовуються просто як спосіб генерувати світло високої інтенсивності.
У мене немає конкретної назви посади на увазі, але якщо ви подивитеся на такий список: https://en.wikipedia.org/wiki/List_of_synchrotron_radiation_facilities ви побачите, де ці синхронітрони, і для кожного з них є посилання «зайнятість», на яке ви можете натиснути, щоб вивчити можливі робочі місця.
Додаткова практика
1. Визначте елемент, який склав зразок з лекції 21 Додаткова практика Завдання 1. Рентгенівський малюнок відтворюється нижче (використовувалися\(k_a\) рентгенівські промені міді).
- Відповідь
-
Щоб дізнатися, який елемент використовувався як зразок, знайдіть параметр решітки (а), використовуючи рівняння для міжплощинних інтервалів\(\left(d_{h k l}\right)\), закон Брегга та закон Мозлі. Для\(\mathrm{h,k,l}\) і\(\theta_{h k l}\), виберіть площину і відповідний кут з діаграми, яку ми розробили в останній главі, показаної нижче:
\ почати {зібраний}
d_ {h k l} =\ dfrac {a} {\ sqrt {h^2+k^2+l^2}}\
\ лямбда = 2 d_ {h k l}\ sin\ ліворуч (\ theta_ {h k l}\ праворуч)
\ кінець {зібраний}Енергія\(\mathrm{Cu}(\mathrm{Z}=29) k_\alpha\) випромінювання відповідає:
\ почати {зібраний}
E=\ dfrac {h c} {\ лямбда} =13.6 [е V] (Z-1) ^2\ ліворуч (\ dfrac {1} {n_f^2} -\ dfrac {1} {n_i^2}\ праворуч)
\\\ lambda=\ dfrac {h} {-13.6 (Z-1) ^2\ ліворуч (\ розрив {1} {n_f^2} -\ розрив {1} {n_i^2}\ праворуч)}\\
d_ {h k l} =\ dfrac {h c} {-13.6 (Z-1) ^2\ ліворуч (\ frac {1} {n_f^2} -\ frac {1} {n_i^2 }\ праворуч) 2\ sin\ theta_ {h k l}}\\
a=\ dfrac {h c\ sqrt {h^2+k^2+l^2}} {-13.6 (Z-1) ^2\ ліворуч (\ frac {1} {n_i^2}\ праворуч) 2\ sin\ theta _ {h k l}} =3.53 А
\ кінець {зібраний}Цей параметр решітки відповідає\(\mathrm{Ni}\).
2. Ви хотіли б виконати XRD-експеримент, але ви не знаєте, яка мета використовується в дифрактометрі у вашій лабораторії. Ви ставите в калібрувальний зразок заліза, який є ОЦК і має параметр решітки\(2.856\) ангстрем. Якщо ви спостерігаєте наступну модель XRD, який матеріал є цільовим? Ви впевнені, що існує фільтр, який запобігає попаданню вашого зразка що-небудь з меншою енергією, ніж\(k_a\) випромінювання.
Спостережувані піки такі:
| підраховує | 10 | 1000 | 20 | 2200 | 8 | 5 | 1200 | 2500 |
|---|---|---|---|---|---|---|---|---|
| \(2\theta\) | 17.38 | 20.87 | 24.67 | 29.62 | 30.30 | 35.15 | 36.45 | 42.37 |
а) Який вид (и) рентгенівських променів потрапляють на зразок?
- Відповідь
-
\(k_\alpha \operatorname{AND} k_\beta\)
б) Скільки площин представлено даними? Які вони літаки?
- Відповідь
-
4 площини представлені:\((110),(200),(211)\), і\((220)\)
в) Які міжплощинні відстані пов'язані з цими площинами?
- Відповідь
-
\[\dfrac{2.856}{\sqrt{h^2+k^2+l^2}} \nonumber\]
Підключення до кожного (\(\mathrm{hkl}\)), інтервали становлять 2,02, 1,43, 1,17 та 1,01 А
г) Який елемент використовувався як мішень?
- Відповідь
-
\ begin {зібраний}
\ лямбда = 2 d_ {h k l}\ sin\ ліворуч (\ theta_ {h k l}\ праворуч)\
\\ лямбда_ {k_\ альфа} =0.73 A\\
\ lambda_ {k_\ beta} =0.61 A
\ кінець {зібраний}
- Відповідь
-
\[E=\dfrac{h c}{\lambda}=13.6(Z-1)^2\left(\dfrac{1}{n_f^2}-\dfrac{1}{n_i^2}\right) \nonumber\]
Для\(k_\alpha, n_i=2\) і\(n_f=1\). Для\(k_\beta, n_i=3\) і\(n_f=1\).
\ begin {вирівняний}
&h = 4.135\ раз 10^ {-15}\ mathrm {eV}. \ матрм {s}\\
&c = 3 х 10 ^ 8\ матрм {~ м}/\ mathrm {s}\\
&\ mathrm {Z} =42
\ кінець {вирівняний}
Лекція 23: Точкові дефекти
Резюме
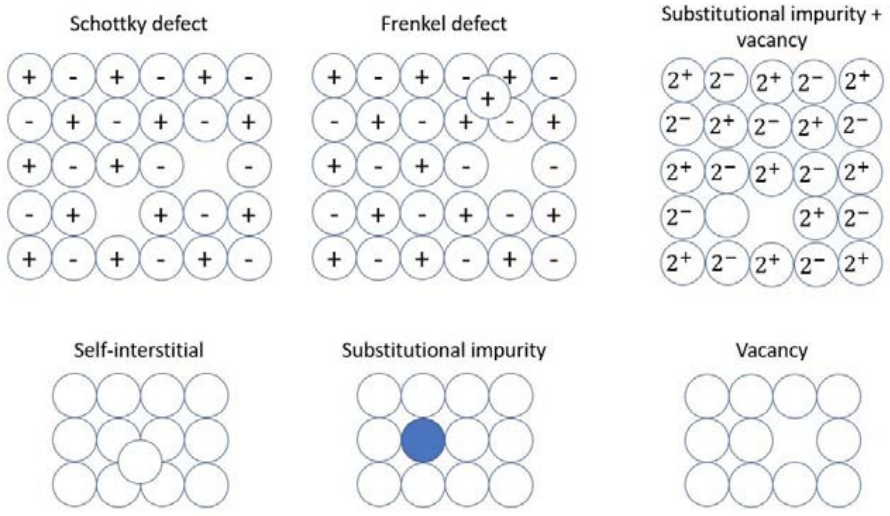
Точковий дефект - локалізоване порушення регулярності кристалічної решітки. Існує чотири типи точкових дефектів: вакансії, інтерстиціальні домішки, самоінтерстиціальні та заміщувальні домішки.
Арреній визначив закон температурної залежності швидкості, з якою відбуваються процеси:
\(k=A e^{-E_a / R T}=A e^{-E_a / k_B T}\)
де\(\mathrm{R}\) - газова константа (або\(k_B\) постійна Больцмана) і\(E_a\) енергія активації. Термін в експоненті повинен бути безроздільним: тому, якщо енергія активації дана в\(\mathrm{J} / \mathrm{mol}\), використовуйте варіант з\(R\), але якщо енергія активації дана в\(J\), використовуйте\(K_B\) варіант. Нагадаємо, що газова постійна якраз\(R=K_B * N_A\). Одиниці визначаються префактором\(\mathrm{A}\), який можна розглядати як середню кінетичну енергію системи.
Вакансії завжди присутні в кожному твердому тілі, оскільки вони є результатом термічно активованих процесів. Норму формування вакансії і норму видалення тієї ж вакансії можна розглядати як два термічно активованих процесу, кожен зі своєю нормою. При будь-якій заданій температурі, коли норма формування вакансії збігається з нормою «деформування» вакансії, тоді концентрація вакансії в кристалі буде знаходитися в рівновазі. Оскільки кожна швидкість термічно активована, ми можемо використовувати рівняння Арреніуса для опису як прямого, так і зворотного процесу, і встановлення їх рівних для рівноваги приходить до формули, що описує, як концентрація вакансії залежить від температури:
\(N_v=N e^{-E_a / k_B T}\)
де\(N_v / N\) - фракційна концентрація вакансій і\(E_a\) енергія активації,\([\mathrm{J}]\) необхідна для видалення одного атома. Якщо вакансія виникає в іонному твердому тілі, нейтральність заряду повинна підтримуватися. Тому дефект або утворюється у вигляді дефекту Шотткі, де видаляється пара зарядів (один катіон і один аніон), або як дефект Френкеля, де вакантний атом сидить в іншому місці решітки на інтерстиціальній ділянці. Для дефекту Шотткі в іонному твердому тілі\(\mathrm{CaCl}_2\), як, два аніони\(\left(\mathrm{Cl}^{-}\right)\) повинні бути видалені для кожної\(\left(\mathrm{Ca}_2^{+}\right)\) вакансії катіону, щоб зберегти нейтральність заряду. Френкеля і меншого катіона\(\mathrm{AgCl}, \mathrm{AgBr}\), як\(\mathrm{AgI}\), і, наприклад.
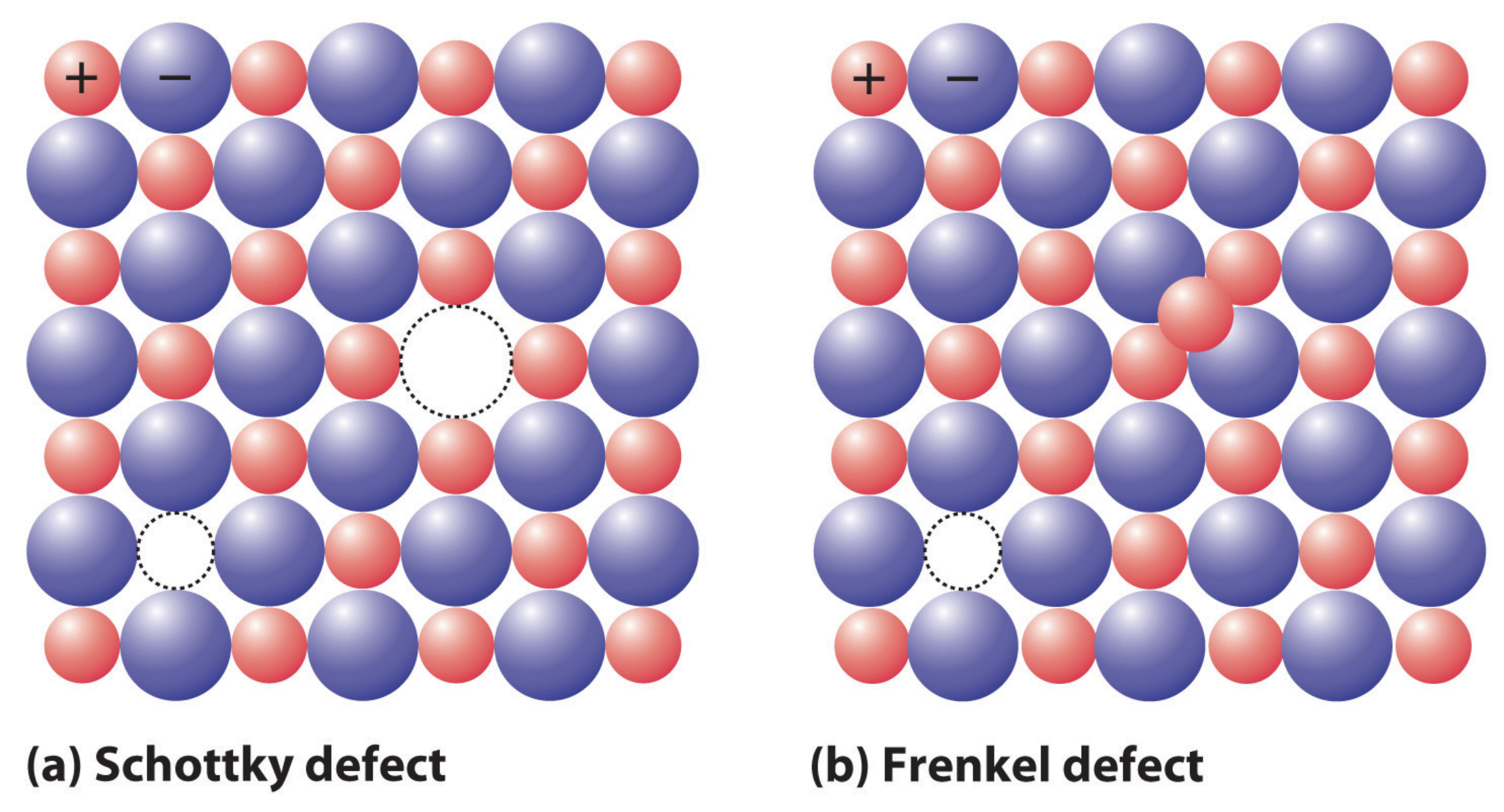
Інтерстиціальні дефекти можуть виникати і в ковалентних твердих тілах: у цьому випадку додатковий атом займає ділянку, який не є частиною решітки, але вимога нейтральності заряду не вимагає створення вакансії за умови, що інтерстиціальні атоми мають такий же заряд, як і атоми решітки. Наприклад,\(\mathrm{C}\) інтерстиціальний в\(\mathrm{Fe}\) заряду нейтральний. Якщо інтерстиціальний атом - це той же тип атома, що і решітка, як\(\mathrm{Si}\) атом у\(\mathrm{Si}\) решітці, але не на місці решітки, дефект називається самоінтерстиціальним. Енергія, необхідна для формування самоінтерстиціала,\((2-5 \mathrm{eV})\) набагато вища, ніж для вакансії\((0.5-1 \mathrm{eV})\), тому ці дефекти зустрічаються набагато рідше: це можна раціоналізувати, думаючи про те, наскільки важко було б стиснути атом між атомами аналогічного розміру, розташованими в тісно упакованій решітці.
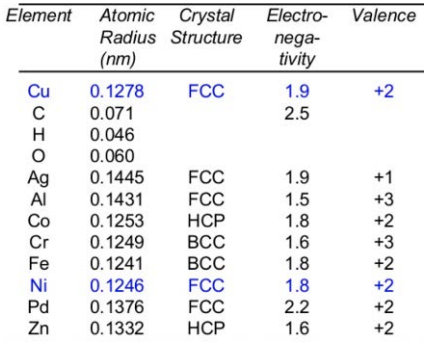
Атоми, які займають місце іншого атома в решітці, називаються дефектами заміщення. Як правило, правила Юма-Ротері дають вказівки, яким атоми можуть бути дефектом заміщення: розмір атома повинен бути всередині\(+/- 15\%\), кристалічна структура повинна бути однаковою, електронегативність повинна бути подібною, а валентність повинна бути однаковою або вищою.
Чому це важливо
Давайте підберемо інтерстиціальний дефект вуглецю в залізі, інакше відомому як сталь. Цей конкретний дефект має позитивні переваги, якщо він ретельно контролюється і потрібну кількість вуглецю (не багато, виявляється) розміщується в правильних положеннях всередині залізної решітки (чотиригранні отвори, наприклад, в ОЦК\(\mathrm{Fe}\)). Насправді зміна властивостей заліза абсолютно величезна і є вражаючим прикладом того, як дефекти можуть бути використані з користю. Якщо у вас виробництво проти часу цифра видаляється через взяття шматочка чистого заліза і ap- авторських обмежень. Шар боком напружується на ньому, то його дозволене напруження зсуву досить низьке, близько 10 МПа. Це означає, що якщо натиснути вбік на шматок чистого заліза, він деформується під тиском 10 МПа. Але лише 1%\(\mathrm{C}\) на міжстильних ділянках,\(\mathrm{C}\) леговане залізо може мати вирішене напруження зсуву до 2000 МПа, що в 200 разів більше, ніж нелегований випадок!
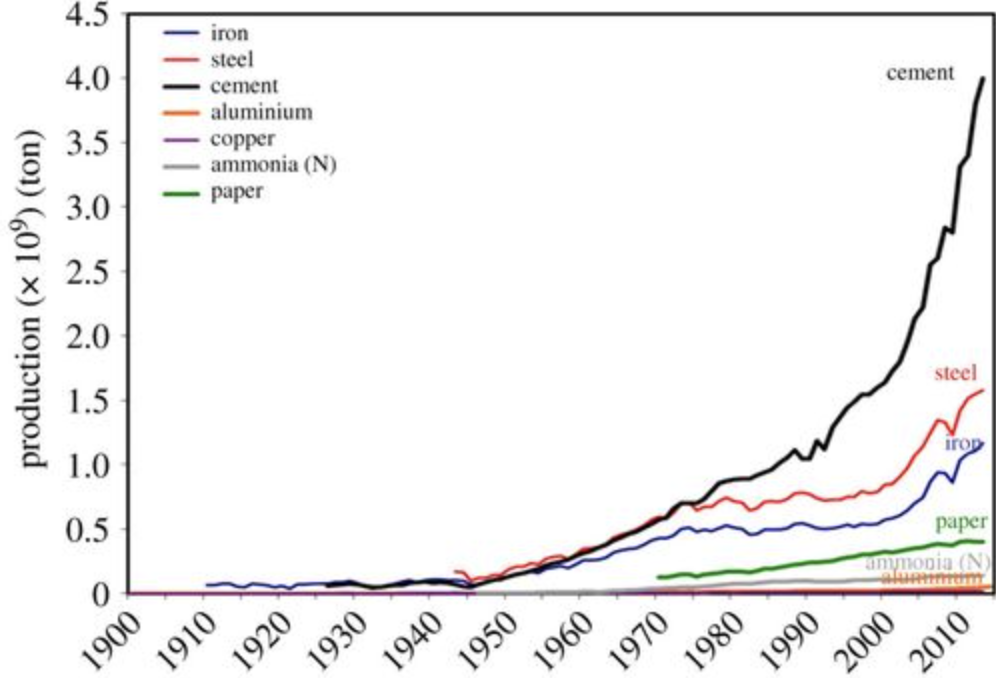
Зараз це явище відомо і практикується вже понад 2500 років, коли люди вперше спостерігали механічну міцність, яку надає залізо, коли воно нагрівалося вугіллям (вугільне вугілля було джерелом вуглецю). Але ось тільки все: 2500 років тому, або 1000 років тому, а то і всього 100 років тому, щороку вироблялося не багато сталі. Зараз це змінюється, і воно різко змінюється, і саме тому це важливо.
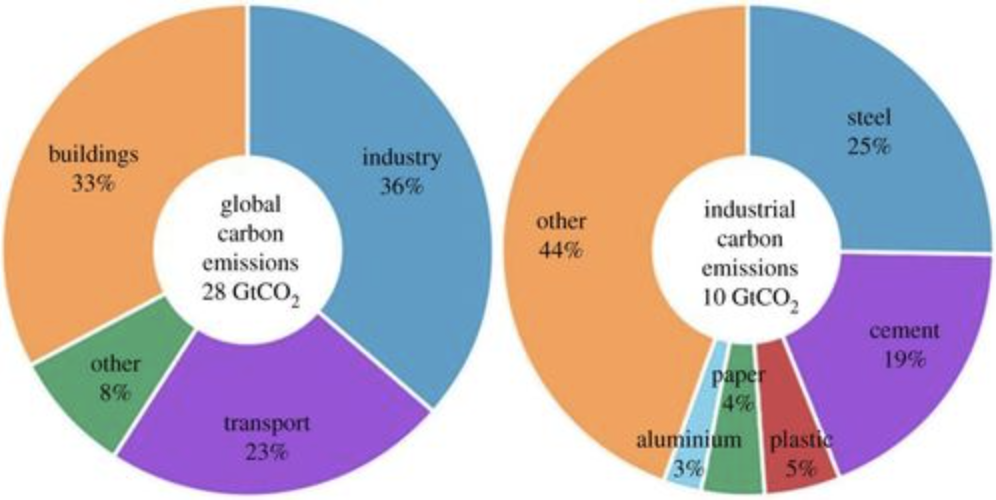
Діаграма промислових викидів вуглецю
Погляньте на діаграму вище (від Геологічної служби США, ООН, ФАО, Всесвітньої алюмінієвої асоціації) обсягу виробництва деяких матеріалів, які люди роблять у досить масивному масштабі, щоб вимагати величезних шматків світового споживання енергії. Цемент і сталь є двома лідерами, і оцінки ставлять їх на 10-15% в сукупності щорічних глобальних\(\mathrm{CO}_2\) викидів. Якщо ми подивимося лише на\(\mathrm{CO}_2\) викиди від промислових процесів, найбільшу частку стали складають 25% від загальної кількості. Але ще більш важливими є ті схили у виробничих тенденціях: зверніть увагу, що використання цих продуктів зростає і буде продовжувати різко зростати в майбутньому. Ще 2500 років тому не було значення, як виготовлялася сталь. Вони також не мали уявлення, чому деревне вугілля надає залізу ці властивості. Сьогодні нам потрібно не тільки знайти нові способи більш ефективного виготовлення сталі, але ми також знаємо, що відбувається в матеріалі в атомному та склеювальному масштабі. Іншими словами, ми розуміємо його хімію твердого тіла.
Як ми можемо зробити сталь більш енергоефективним способом? Відповідь на це питання спирається на знання точкових дефектів матеріалу, а саме на енергію, необхідну для потрапляння вуглецю в міжтканинну решітку. І це не завжди очевидно. Наприклад, якщо порівняти атомний розмір\(\mathrm{C}\) з розмірами наявних міжстиціальних об'ємів в\(\mathrm{Fe}\), то зрозуміло, що він не зовсім підходить, і деякий тип гратчастої спотворення доведеться мати місце для того, щоб вмістити міжстиціальний дефект, навіть такий малий, як\(\mathrm{C}\) атом. Але це означає, що це не так просто, як зайняти місце дефекту з найбільшою кількістю місця, оскільки нам потрібно знати, як атоми напружуються у відповідь на дефект, який там знаходиться. Візьмемо приклад -заліза: у цій фазі ви думаєте, що\(\mathrm{C}\) атом займає більший чотиригранний отвір, але насправді він вважає за краще переходити до октаедричного інтерстиціального ділянки. Причина цієї переваги полягає в тому, що коли\(\mathrm{C}\) -атом переходить у інтерстиціальний, деформація знімається для восьмигранного ділянки двома найближчими сусідніми атомами заліза, що рухаються трохи, тоді як для тетраедричного сайту чотири атоми заліза є найближчим сусідом, і зміщення всього цього вимагає більше енергія деформації. Це всього лише одна фаза заліза і дві різні ділянки. Можуть бути способи легше переміщати\(\mathrm{C}\) атоми в інші фази, що забирало б менше енергії і давало б таку ж силу. Або, можливо, є й інші способи поза вогнем (саме тому виготовлення сталі займає стільки енергії), щоб отримати хімію дефектів в самий раз. Це важка проблема, але вона критична: погляньте на цю діаграму з недавньої статті, опублікованої в Science, яка розбиває, які сектори найважче зробити «зеленими». Зверніть увагу на популярність сталі та цементу! Щоб вирішити такі важкі проблеми, нам знадобляться досягнення в хімії дефектів.
Чому це працює
Це просто: насправді є посада під назвою «Інженер дефектів»! У Global Foundries вони піклуються про дефекти основного виробництва напівпровідникових матеріалів, тоді як в Intel є отвори для інженерів дефектів для роботи над 3D XPoint, яка є новою енергонезалежною технологією пам'яті. Intel також має відкриття для «Інженера по зменшенню дефектів». Ці та багато інших подібних отворів призначені для галузей, де пристрої виготовляються в чистих приміщеннях, часто дуже чистих чистих приміщеннях. Наприклад, чисте приміщення «Класу 1» означає, що якщо ви берете метр куба повітря в будь-якому заданому місці в кімнаті, ви б порахували менше 10 частинок розміром 100 нанометрів, менше 2 частинок розміром менше 200 нанометрів і нульових частинок більше, ніж це. Причина, по якій виробничі установки потребують такого високого рівня чистоти повітря, полягає в тому, що вони роблять функції порядку 10 нанометрів, і тому будь-який невеликий дефект може бути великою проблемою.
Тепер, знову ж таки, це не обов'язково точкові дефекти (хоча, звичайно, 100 нм частинки, які потрапили в шар кремнію під час його обробки, можуть спричинити точкові дефекти). Як щодо технологій, де точковий дефект є ключовою частиною самої технології? У такому випадку ви можете говорити про твердому оксидному паливному елементі (\(\mathrm{SOFC}\)). Це, як правило, оксиди металів, і вони працюють, проводячи іони кисню через матеріал. Але єдиний спосіб переміщення іона кисню - це якщо є вакансії кисню, і в достатній щільності при розумних температурах. Багато компаній працюють над розробкою ефективних, недорогих та низькотемпературних твердооксидних паливних елементів. Наприклад, кожен виробник автомобілів зацікавлений у цьому як можливому майбутньому шляху до енергетичного транспорту (Nissan має класний демонстраційний автомобіль). Інші компанії, такі як Precision згоряння, Elcogen, або Bloom Energy всі працюють над створенням\(\mathrm{SOFCs}\), з останнім із зазначенням, «кращі електрони» * на своїй домашній сторінці. Приємно. (Хоча я думав, що всі електрони ідентичні... але все одно). Справа в тому, що зростає інтерес\(\mathrm{SOFC}\) і вже сильний ринок досягне 1 млрд доларів до 2024 року. При більшому контролі над цими кисневими вакансіями, можливістю зробити матеріали дешевшими та можливість контролювати дефекти при більш низьких температурах, використання\(\mathrm{SOFC}\) може збільшитися навіть набагато більше, ніж це!
Додаткова практика
1. Намалюйте наступні дефекти:
а) Шотткі
б) Френкель
в) Замінна домішка+вакансія
г) Самостійний інтерстиціальний
д) Замінна домішка
f) Вакансія
- Відповідь
-
2. Твердооксидні паливні елементи покладаються на реакцію палива з киснем з утворенням води. Керамічний оксид може бути легований для введення кисневих вакансій, які дозволяють заряду проводити через твердий електроліт. Цирконій\((\mathrm{ZrO} 2)\) можна легувати додаванням\(\mathrm{Sc}2\mathrm{O}3\). Якщо\(0.5 \mathrm{~g}\) з\(\mathrm{Sc}2\mathrm{O}3\) може бути включений в або\(10 \mathrm{~g}\)\(\mathrm{ZrO} 2\) при збереженні структури діоксиду цирконію, скільки утворюються вакансії кисню?
- Відповідь
-
Ми легуємо\(\mathrm{ZrO}_2\) с\(\mathrm{SC}_2 \mathrm{O}_3\). Іони замінюються\(\mathrm{Zr}^{4+}\)\(\mathrm{Sc}^{3+}\) іонами, створюючи дисбаланс заряду\(-1\) з кожною заміною. Це означає, що на кожні 2 такі заміни, або кожен доданий\(2 S c^{3+}\) іони, буде виникати\(-2\) дисбаланс, і\(\left(V_O^{\prime \prime}\right)\) буде створена вакансія кисню для компенсації і досягнення нейтральності заряду.
\[0.5 g \mathrm{Sc}_2 \mathrm{O}_3\left(\dfrac{1 \mathrm{molSc_{2 } \mathrm { O } _ { 3 }}}{137.9 g}\right)=0.0036 \mathrm{molSc}_2 \nonumber\]
\(0.0072 \mathrm{~mol} \mathrm{Sc} c^{3+}\)додано\(=0.0036 \mathrm{~mol} V_O "\)
Загальна кількість кисневих вакансій\(=2.18 \times 10^{21}\)
Лекція 24: Дефекти лінії та криві напруження-деформації
Резюме
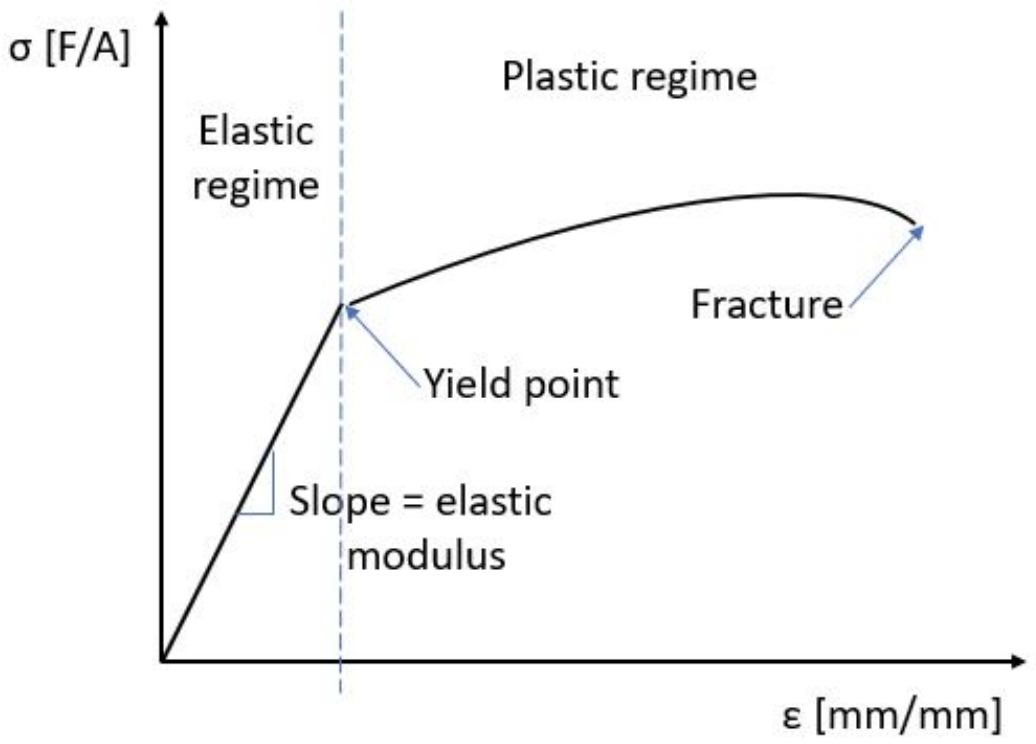
Лінійні дефекти - це 1-вимірні дефекти кристала, які впливають на багато макроскопічні властивості матеріалів, включаючи деформацію. У 3.091 ми зупинимося на двох типах деформації: пружна деформація, яка є оборотною (деформація виникає лише тоді, коли застосовується напруга, і вона повертається назад після зняття напруги), і пластична деформація, яка є постійною.
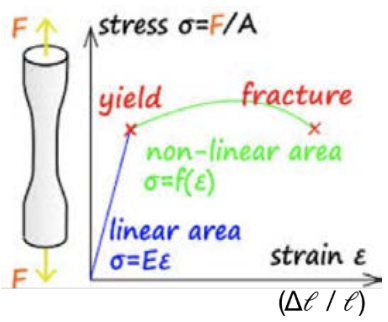
Пружну деформацію можна порівняти з з'єднанням всіх атомів пружинами: закон Гука, F = -kx, говорить нам, що існує відновлювальна сила, яка повертає матеріал у початковий стан. Це відповідає початковій лінійній області в кривій напруження-деформація. Якщо матеріал крихкий, він, швидше за все, порушиться в лінійному режимі. Однак якщо матеріал пластичний, він може піддаватися пластичній деформації: матеріал вже не реагує лінійно на прикладене напруження. Один механізм деформації, що виникає при пластичній деформації, називається ковзанням: окремі площини атомів ковзають один за одного через наявність дефекту лінії. Дислокація - це тип лінійного дефекту, який утворюється, коли атоми трохи зміщені: в кристалі існує додаткова площина атомів.
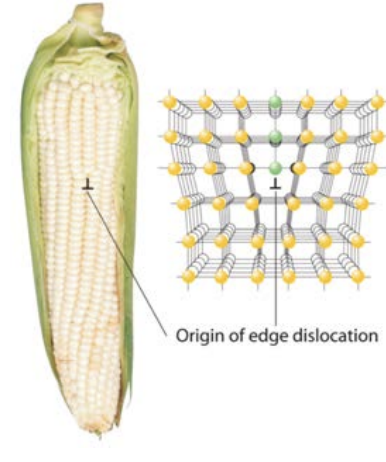
Вивихи можуть переміщатися через кристал при застосуванні сили. Атоми ковзають над іншим, щоб зняти внутрішню напругу, викликану прикладанням сили. Як ми можемо сказати, що таке площини ковзання? Для того щоб матеріал ковзав, дві суміжні площини атомів повинні ковзати один за одним. У міру того, як це відбувається, зв'язки між площинами повинні розриватися і заново формуватися. Тому площини ковзання повинні бути площинами, які мають найнижчу межплощинную щільність зв'язку. Ви можете переконатися, що це означає, що найбільш щільно упаковані площини будуть площинами ковзання, оскільки вони мають найвищу внутрішньо-площинну щільність зв'язку. Це означає, що ковзання відбувається паралельно тісно упакованим площинам: разом площини ковзання та напрямок ковзання утворюють систему ковзання кристала. Багато матеріалів можуть піддаватися ковзанню, опосередкованому дислокацією, але метали, зокрема, відомі цим механізмом деформації. Море електронів, про які ми дізналися в металах, дозволяють зв'язкам переміщатися (розриватися і переформуватися в новому місці) з легкістю в порівнянні з іонними і ковалентними твердими речовинами, які мають набагато більш жорсткі електронні структури.
Коли напруга вперше прикладається до еластичного матеріалу, спочатку утворюються дислокації, коли площини атомів витягуються. Якщо дві дислокації стикаються один з одним, коли вони рухаються навколо, дефекти можуть закріпитися, тому вони більше не можуть рухатися через кристал. Оскільки все більше і більше вивихів закріплюються, вони заплутуються і ковзання не відбувається: матеріал продовжуватиме пружно деформуватися, але для його деформування потрібно набагато більше сил. Іншими словами, закріплення дислокації робить матеріали важче. Цей механізм зміцнення матеріалу називається робочим загартуванням. Робоче зміцнення призводить до збільшення межі плинності, але за рахунок пластичності.
Чому це важливо
Поговоримо про вітроенергетику. Вітер має ті самі проблеми переривчастості, що і сонячна енергія (так що, іншими словами, він може бути дійсно корисним лише у великих масштабах, якщо ми зможемо зберігати енергію дешево та ефективно). Але вітер також має багато переваг і є дуже привабливим способом вироблення електроенергії. Ось чому за останні 20 років встановлена вітроенергетика зазнала величезного зростання у всьому світі. У США більше 5% всієї нашої електроенергії зараз виробляється вітром.
Глобальна кумулятивна встановлена вітроенергетика 2001-2016 (стор. 3) діаграма
Вітрова турбіна насправді заснована на досить простій технології, що є однією з причин, чому вона настільки приваблива. В основному вітер повертає лопаті, що забезпечує силу для запуску електродвигуна в зворотному напрямку для вироблення електроенергії. Завдання полягає в тому, що найбільш послідовні вітри з високою енергією відбуваються на великих висотах, тому лопаті є більш ефективними, чим більше і вище можна змусити їх піти. Це означає, що лопаті повинні витримувати величезні механічні навантаження від високої сили вітру. А щоб ускладнити ситуацію, лопаті повинні мати можливість рухатися вперед і назад між високим, низьким або без вітру залежно від часу доби. (як осторонь, я люблю дивитися на карти, і якщо вам цікаво побачити, як швидкість вітру змінюється по всьому світу, є багато крутих карт, які показують це вам).
Іншими словами, нам потрібні лопаті, які досить міцні, щоб вони не розбивалися під екстремальним напруженням сили вітру, але досить гнучкі, щоб вони могли згинатися без незворотної деформації. А що ж нам потрібно зрозуміти і спроектувати, щоб зробити леза краще? Дефекти лінії звичайно!!
Погляньте на цей сюжет матеріалів.
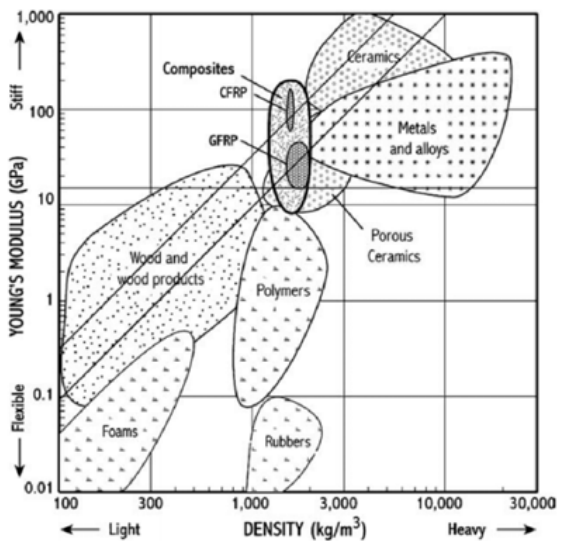
Тут ми дивимося на щільність матеріалу на осі x і модуль Юнга на осі Y. Модуль Юнга - це просто міра пружної жорсткості матеріалу, тому якщо ми повернемося до нашої кривої напруження/деформації на початку цієї глави, це пов'язано з нахилом лінійного пружного режиму. Для лопаті вітрової турбіни ми хотіли б, щоб він був легким і міцним, але також гнучким. Як ми дізналися в цій лекції, дефекти лінії пов'язані з пластичністю, яка пов'язана з напругою плинності, яка пов'язана з тим, наскільки матеріал може бути пружно напружений.
З діаграми ми можемо порівняти різні класи матеріалів (наприклад, метали проти кераміки проти полімерів тощо) для двох із цих властивостей: щільності та жорсткості. Цікаво, що є величезні частини діаграми, які в даний час порожні. Іншими словами, потрібно зробити багато роботи, щоб знайти та підготувати матеріали, які є важкими та гнучкими, або легкими та міцними. І ви знаєте, що це означає: нова хімія в поєднанні з контролем за дефектами лінії!
Чому це працює

Давайте підемо по-великому. Цей човен, наприклад, називається SS Schenectady, і у нього є трохи проблеми. Переважно те, що він тріснутий навпіл. Безліч кораблів, побудованих під час Другої світової війни, виготовлялися з низькосортної сталі, яку було занадто легко руйнувати при температурах моря. Насправді вони випробували міцність своєї сталі, але лише в сухому доці, тому температура випробування була вищою за робочу температуру. Після того, як корабель знаходився в більш холодній воді, сталь стала набагато крихкішою і утворюватися дефекти стало набагато легше, і як тільки вони утворилися, їм було легко рости під прикладеною напругою. Звичайно, не хоче пластичної деформації металу корабля, але такий тип крихкості теж не хоче. Отримання потрібної міцності для правильного застосування в правильних умовах вимагає великих знань матеріалів і їх дефектних властивостей. І в цьому просторі теж багато робочих місць. Подумайте про це: майже все, що ми будуємо сьогодні, має мати якісь умови експлуатації, де механічні властивості можна розраховувати, щоб працювати так, як очікувалося. В іншому випадку кораблі тріскаються навпіл, мости руйнуються, а дороги прямуються.
Оскільки я щойно навів приклад корабля, як щодо цього: Міністерство ВМС США має відкриття для «інженера з матеріалів», де вони явно просять досвіду в «міцності матеріалів (напружено-деформовані відносини)». Підрозділ виробництва, технології та інженерії Corning наймає «Вченого/Інженера» для моделювання міцності матеріалів, імовірно, в основному окулярів. Існує відкриття для «Інженера-дослідника - Поведінка матеріалів» в GE для розробки механічних властивостей нових конструкційних матеріалів та покриттів, що призначені для руху літаків. У цьому просторі так багато робочих місць, які я не міг навіть класифікувати їх усіх: майже будь-яка компанія, яка виробляє або займається матеріалами, має робочі місця, пов'язані з їх механічною міцністю та відмовою. Від кораблів, до будівель, медичних приладів до одягу, космічних кораблів до меблів, дефектів тримаємо ключ.
Додаткова практика
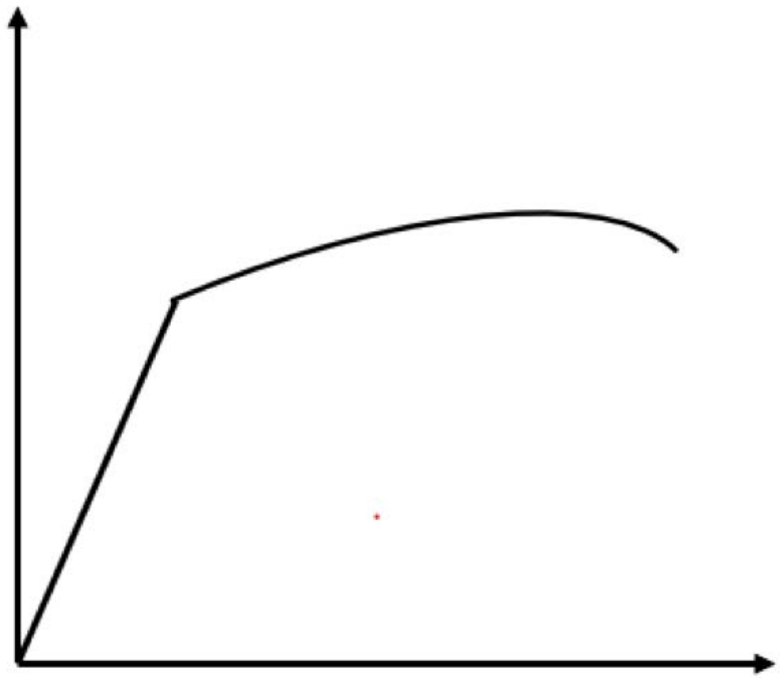
1. Ви отримуєте наступну криву напруження-деформації для зразка алюмінію (FCC).
а) Позначте наступні регіони на ділянці (і осі!) :
Пружний режим Пластичний режим Точка текучості Точка руйнування Модуль пружності
- Відповідь
-
Осі: напруга,\(\sigma\) на\(y\) -осі, має одиниці сили/площа. Деформація, $\ epsilon$ на осі x, є безодиничною, але часто представлена у вигляді довжини/довжини
б) Що таке система ковзання з алюмінію?
- Відповідь
-
Система ковзання для FCC - це тісно упакований напрямок та площина близько упакованої:\(\langle 110\rangle\) і\(\{111\}\) нагадаємо, що кутові дужки використовуються для позначення сімейств напрямків, а фігурні дужки використовуються для позначення сімей площин!
Лекція 25: Аморфні матеріали: склоподібні тверді речовини
Резюме
Скла - це «аморфні матеріали»: всі атоми випадково розташовані в неповторюваній структурі. В\(3.091\), ми зупинимося на одному типі скла: кремнезему, або\(\mathrm{SiO}_2\). Кожен атом кремнію має чотири валентних електрона, тому він із задоволенням утворює 4 одиночних зв'язку. Якщо кисень зв'язується з кожним з цих валентних електронів, кожен з кисню залишається з зайвим електроном, утворюючи\(\left(\mathrm{SiO}_4\right)^{4-}\) молекулу. Однак, коли з цих силікатних молекул утворюється тверде тіло, вони\(\mathrm{O}\) можуть ділитися між сусідніми силікатами, утворюючи міст.
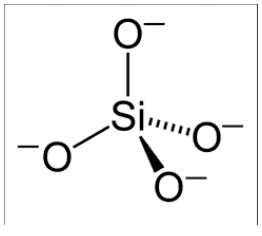
Окремі молекули тетраедричного силікату залишаються недоторканими, але вони можуть вільно обертатися щодо інших молекул силікату в твердому тілі. Коли вони не влаштовуються впорядкованим чином, утворюється кремнеземне скло. Чи тверде тіло, яке утворюється, є кристалічним або склоподібним, сильно залежить від умов обробки кремнезему.
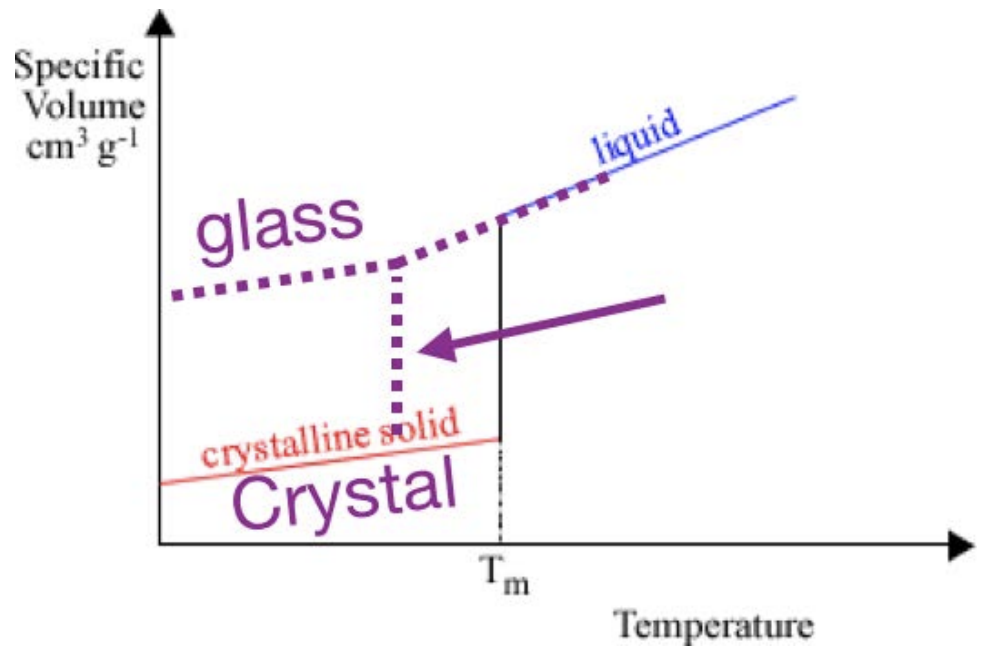
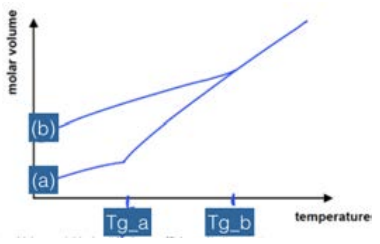
Однією з метрик кількісної оцінки умов обробки є перегляд того, як змінюється молярний об'єм в залежності від температури. Для кристала сюжет виглядає так. Існує похила лінія, яка відповідає твердому матеріалу, потім стрибок, потім інша похила лінія, яка відповідає рідкій фазі. Стрибок відбувається при температурі плавлення\(T_m\): коли матеріал плавиться або замерзає, він зазнає величезну зміну обсягу. Ухил кожної лінії визначається як коефіцієнт теплового розширення. Однак іноді при охолодженні матеріалу він може залишатися в рідкій фазі нижче\(T_m\): це називається переохолодженням. Коли рідина переохолоджується, продовжує діяти як рідина, поки не станеться одна з двох речей:
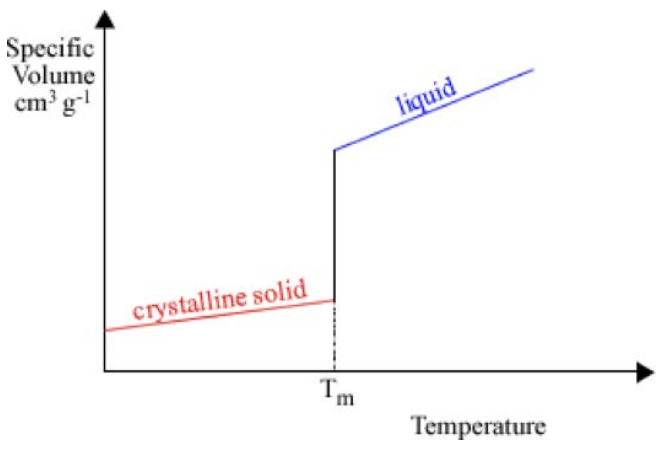
1. Він кристалізується, характеризується великим стрибком вниз до кристалічної твердої лінії, а потім твердою поведінкою.
2. Вона раптом стає твердою, «замерзаючи» в своєму невпорядкованому стані і перетворюючись в склянку. Цей перехід характеризується зміною нахилу в, точці\(T_g\), в якій утворюється тверде тіло (називається температурою скляного переходу), але відсутністю розриву в кривій замерзання.
Як ми можемо знати, яким шляхом піде матеріал? Це залежить від властивостей матеріалів: якщо рідина має високу рухливість (низьку в'язкість), молекули можуть легко переміщатися і влаштовуватися в енергетично переважну кристалічну структуру. Високов'язкі або малорухливі рідини набагато частіше застряють в склянці. Крім того, якщо кристалічна структура дуже складна, або якщо рідина охолоджується дуже швидко, атомам важко знайти кристалічні ділянки перед твердими формами: ці випадки також частіше призводять до утворення скла.
Обсяг на моль - хороша міра розладу в матеріалі: чим далі моляр
обсяг - від кристалічного корпусу, тим більше склоподібний матеріал. Хоча матеріал має лише одну температуру плавлення, він може мати кілька переходів скла залежно від того, як він обробляється. XRD - це один із інструментів, який можна використовувати для визначення того, чи є матеріал кришталем чи склом: оскільки матеріал стає все більш невпорядкованим, гострі піки, що спостерігаються в малюнку XRD, зникають у широкий аморфний ореол.
Чому це важливо
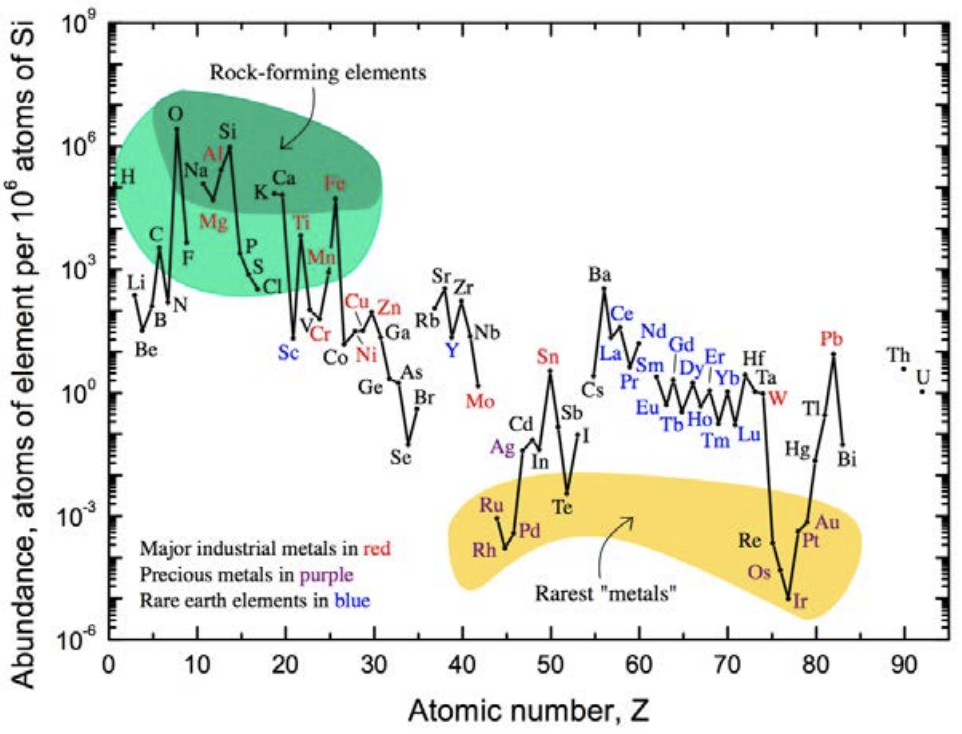
\(\mathrm{SiO}_2\)скло виготовляється з піску, і його багато на планеті. \(\mathrm{SiO}_2\)виділяється як базовий матеріал, який має дійсно дивовижні властивості. Почасти це через його величезну кількість. Перевірте цей сюжет про велику кількість атомів в земній корі. Зверніть увагу, що з усіх елементів таблиці Менделєєва кисень і кремній є #1 і #2. Це означає, що кремнезем дешевий, і ми не збираємося закінчитися, на відміну від інших елементів. Насправді існує багато «критичних елементів» на кшталт\(\mathrm{Li}\)\(\mathrm{Co}\)\(\mathrm{Ga}, \mathrm{Te}\), і\(\mathrm{Nd}\) щоб назвати декілька, позначені Міністерством енергетики як такі, оскільки існує занепокоєння, що в майбутньому їх не вистачить для задоволення глобального попиту. Але\(\mathrm{Si}\) і\(\mathrm{O}\) є протилежними критичним: їх різко рясно. І це дає величезну можливість використовувати в\(\mathrm{SiO}_2\) якості базового матеріалу для широкого спектру застосувань.
І ось чому хімія, яку ми вивчили в цій лекції, має значення: тому що ми це дізналися
ключові властивості скла та спосіб його обробки походять від хімії. Способи, якими ми продовжуємо використовувати скло на цій планеті, можуть збільшуватися, оскільки людське населення та технологічні потреби/використання продовжують зростати, але як ми можемо використовувати скло більш стійко, враховуючи, що основний матеріал настільки багатий? Або які інші програми можуть бути корисними для скла там, де воно в даний час не використовується сьогодні? Чи можна скло зробити «зеленішим»? Один класний приклад того, як це могло б спрацювати, - у творчості Маркуса Кейзера, який винайшов «Сонячний агломерат». Це самодостатній 3D-принтер скляних предметів, які можна вигнати в десерт, годувати пісок і сонячне світло, які одночасно рясні, і друкувати скляні предмети. Сонячне світло використовується як для живлення електродвигуна принтера, так і для створення достатньої теплової енергії, щоб отримати вище\(T_g\) для піску. Тепер ви можете придбати комерційні 3D-принтери для скла, але мені подобається цей приклад, оскільки він нейтральний щодо викидів.
Фото сонячного агломерата Маркуса Кайзера
Майбутнє того, наскільки далеко ми просуваємо подібні технології, буде залежати від того, наскільки далеко ми зможемо просунути властивості скла. У наступній лекції ми обговоримо кілька різних способів контролю властивостей скла, але вам потрібна лише сьогоднішня лекція та розуміння цих силікатних груп, щоб зрозуміти ключовий зв'язок між хімією та чому це важливо.
Чому це працює
Corning - один з найбільших і найвідоміших виробників скла у світі. Це відео, про яке я згадував у лекції вище, яку я показав на уроці, про падіння принца Руперта, це було з навчальної серії «Музей скла Корнінга». Вони дійсно, дійсно в скло. І вони великі: їхній дохід за 2018 рік був,\(\$ 11.4 \mathrm{~B}\) і зараз у них 51 500 співробітників. На їхньому веб-сайті, якщо ви натиснете на розділ «інженерія» на сторінці вакансій, ви знайдете сотні списків. Вони також отримали тонну стажування для студентів:, «Стажування Корнінг пропонує цінний практичний досвід для людей у обраній дисципліні, щоб включати, але не обмежуючись матеріалознавством, інженерією, дослідженнями, виробництвом, ІТ, HR, Маркетинг, Фінанси та ланцюг поставок». Це прохолодне місце, яке зробило його великим зі скла і зробило скло великою справою.
Corning працює на широкому спектрі застосувань скла, але давайте зосередимося лише на одному з них: волоконно-оптичних кабелів. Більшу частину магістралі сучасного Інтернету обслуговує волоконна оптика, яка виготовлена з кварцового скла, оскільки вони мають стільки переваг перед (старішою) мідною проводкою. Наприклад, волоконно-оптичні кабелі можуть нести набагато більшу пропускну здатність на більші відстані, ніж мідь, це означає, що потреба в підсилювачах сигналу зменшується, а волоконно-оптичні кабелі також менш сприйнятливі до перешкод від зовнішніх електромагнітних полів, тому вони не потребують екранування, і, нарешті, вони не ламаються вниз або роз'їдати майже так само часто, тому вони набагато дешевше підтримувати. Не дивно, що великі американські компанії, такі як Comcast FiOS та Google Fiber, працюють над тим, щоб отримати волоконно-оптичні кабелі, що не є лише магістраллю Інтернету, але буквально в кожній окремій будівлі в країні. На відміну від Corning, про який багато хто з нас, можливо, вже чули, деякі з провідних волоконно-оптичних компаній менш відомі, навіть будучи величезними компаніями (тобто: багато робочих місць!). Візьміть OFS Optics, яка робить волоконно-оптичні кабелі для понад 50 різних просторів застосування. Вони мають більше\(\$ 250 \mathrm{M}\) річних доходів, і в одному зі своїх робочих місць для «RD Engineer» стверджує, що вони шукають когось, щоб «очолити розвиток виробничих процесів для наступного покоління виробів зі скловолокна». Прохолодний.
Або як щодо того, щоб перейти на міжнародні компанії, такі як Prysmian (базується в Італії), яка має річний\(\$ 1 \mathrm{~B}\) дохід, має «Випускну програму» для останніх класів, щоб швидко занурити їх програмою наставництва, а також має найкрутішу назву для волокна з їх брендом «BendBright». Або є YOFC, що базується в Китаї з доходом понад\(\$1 \mathrm{~B}\) /рік, і приємним гаслом «Smart Link Better Life», або Fujikura з\(\$ 7 \mathrm{~B}\) річними продажами та претензією на те, щоб «Формувати майбутнє за допомогою технології Tsunagu». (що означає «підключення»). Ці та багато інших компаній працюють над виготовленням волоконно-оптичних кабелів наступного покоління, і якщо ви копаєте кілька шарів вглиб будь-якого з них, ви побачите, наскільки складним є виробництво волоконно-оптичних кабелів, скільки різних способів це можна зробити сьогодні і буде зроблено в майбутньому, і скільки робочих місць є які безпосередньо пов'язані зі знанням\(\mathrm{SiO}_2\) скла!
Справа не лише в обробці: є фундаментальні хімічні дослідження, які потрібно зробити і на кремнеземному склі. Легуючи кремнеземне скло іншими елементами, його властивості можуть бути змінені. Наприклад, додаючи іони Ербію, скло перетворюється з пасивного носія світла в підсилювач, здатний зробити сигнал на кілька порядків вище. І якщо ви зацікавлені в кодуванні, вам потрібно зробити багато роботи, щоб імітувати, як світло рухається в засобах масової інформації, як скло, і як воно взаємодіє з цими легуючими речовинами.
Додаткова практика
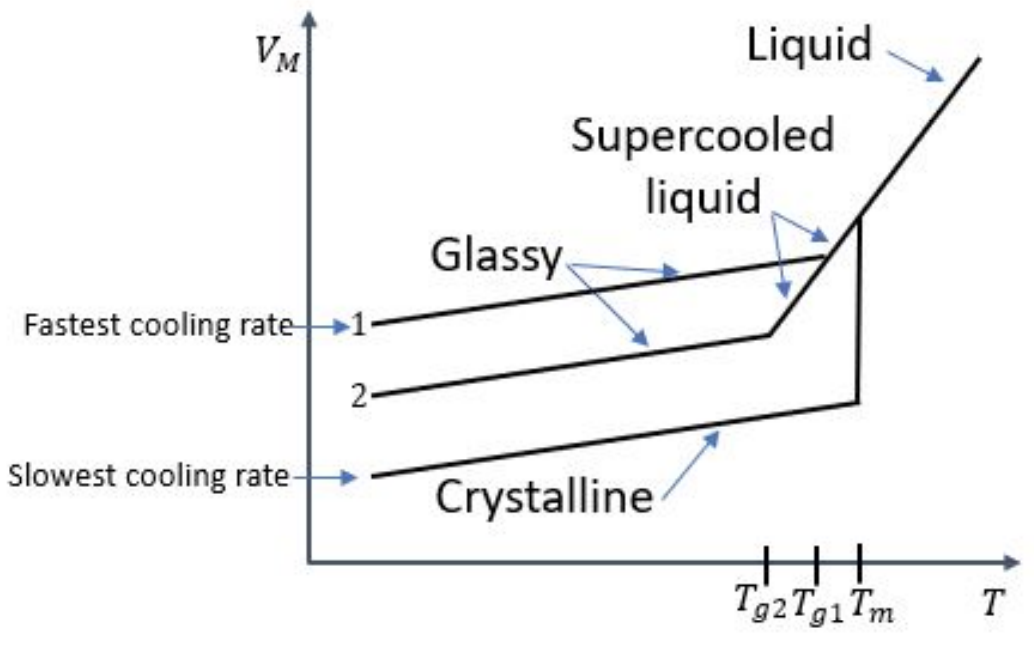
1. Ви отримуєте наступні криві вільного об'єму проти температури для матеріалу, охолодженого з трьома різними швидкостями. Позначте всі екземпляри наступних явищ на ділянці (і осі!) :
а)\(T_g\)
б)\(T_m\)
в) склоподібний режим
г) кристалічний режим
д) найшвидша швидкість охолодження
f) найповільніша швидкість охолодження
г) рідина
ч) переохолоджена рідина
- Відповідь
-
Лекція 26: Властивості інженерного скла
Резюме
Що означає інженерне скло? Це може означати додавання домішок, які змінюють властивості\(\left(\mathrm{T}_g\right)\), такі як температура скляного переходу, розчинність, довговічність тощо Що об'єднує більшість цих модифікаторів скла, це те, що вони є донорами оксиду, тобто вони віддають\(\mathrm{O}^{2-}\) іон. Це означає, що ці модифікатори мають стабільні катіони, тому часто метали хороші. Наприклад:
\(\mathrm{CaO} \rightarrow \mathrm{Ca}^{2+}+\mathrm{O}^{2-} \quad \mathrm{Na}_2 \mathrm{O} \rightarrow 2 \mathrm{Na}^{+}+\mathrm{O}^{2-} \quad \mathrm{Al}_2 \mathrm{O}_3 \rightarrow 2 \mathrm{Al}^{3+}+3 \mathrm{O}^{2-}\)
Подарований\(\mathrm{O}^{2-}\) іон атакує\(\mathrm{Si} - \mathrm{O} - \mathrm{Si}\) зв'язок і розбиває його на дві частини. Це як ніж, який розрізає скляний зв'язок, і тому цей процес називається ланцюговим розсіканням. \(\mathrm{O}^{2-}\)Здатний вставлятися в зв'язок і своїми двома зайвими електронами задовольняє стан заряду атомів кисню, які тепер «закривають» ланцюги на кожному кінці. Таким чином, ми маємо, що\(\mathrm{Si}-\mathrm{O}-\mathrm{Si}+\mathrm{O}^{2-} \rightarrow \mathrm{Si}-\mathrm{O} \mid \mathrm{O}-\mathrm{Si}\) з негативним зарядом на кожному\(\mathrm{O}\). Як показано на малюнку,\(\mathrm{Na}+\) іони звисають навколо кисню. Вплив ланцюгового розрізу на властивості окулярів величезний. Просто візьмемо для прикладу температуру плавлення: для кристалічних\(\mathrm{SiO}_2\) (кварцових\(\mathrm{Tm}\)) більше, ніж\(1200^{\circ} \mathrm{C}\). Для натрієво-вапняного скла температура скляного переходу, як правило, близько\(500^{\circ} \mathrm{C}\). Якщо силікатні ланцюги розрізати, то матеріал набагато менш в'язкий, і він може легше знайти кращу упаковку, що призводить до зниження обсягу на моль, а також більш низької температури склопереходу (більше переохолодження).
Базова хімія твердого тіла, яка в описаному вище випадку є\(\mathrm{SiO}_2\), є мережевим колишнім. Донор оксиду називається мережевим модифікатором. Додавання мережевих модифікаторів - ще один спосіб змінити криву охолодження скла. Наприклад, криву (b) праворуч можна отримати за допомогою\(\mathrm{SiO}_2\) with\(5 \% \mathrm{PbO}\) і curve (a) за допомогою\(\mathrm{SiO}_2\) with\(10 \% \mathrm{PbO}\). Причина полягає в тому, що більше різання ланцюгів робить матеріал менш в'язким, а це означає, що він може знайти кращу упаковку і більше переохолоджуватися.
Ми обговорили два способи розробки механічних властивостей у склі. По-перше, скло може бути загартоване: розплавлене скло охолоджується повітрям, і якщо зовнішня сторона скла твердне, а всередині все ще є рідиною, то зовні має зовсім інший обсяг на моль, ніж внутрішній. гарячий розплавлений\(\mathrm{SiO}_2\) твердне, але оскільки він не може мати менший обсяг, який він хотів би мати, він ставить внутрішній тиск (стискаюче напруження) на вже твердий зовнішній шар. Другий спосіб зміцнення скла називається іонним обміном. Він передбачає заміну іонів, залишених у склі, мережевими модифікаторами з іонами різного розміру, що створює напругу стиснення.
Чому це важливо
Можливість інжинірингу скла з широкими властивостями призвела до його використання в цілому набагато більше, ніж вікна. Як щодо: двері, фасади, тарілки, чашки, миски, ізоляція, зберігання продуктів, пляшки, сонячні батареї, вітрові турбіни, дзеркала, балюстради, столи, перегородки, кухонні вершини, духовки, телевізори, комп'ютери, телефони, літаки, кораблі, лобове скло, підсвічування, медична техніка, оптичне скло, біотехнологія, волоконно-оптичні кабелі , радіаційні бар'єри. І крім того, скло майже повністю підлягає вторинній переробці. Основна причина, чому скло стало настільки всюдисущим у всіх цих різних способах, полягає в його масовій хімічній перебудовуваності, як обговорювалося в цій лекції.
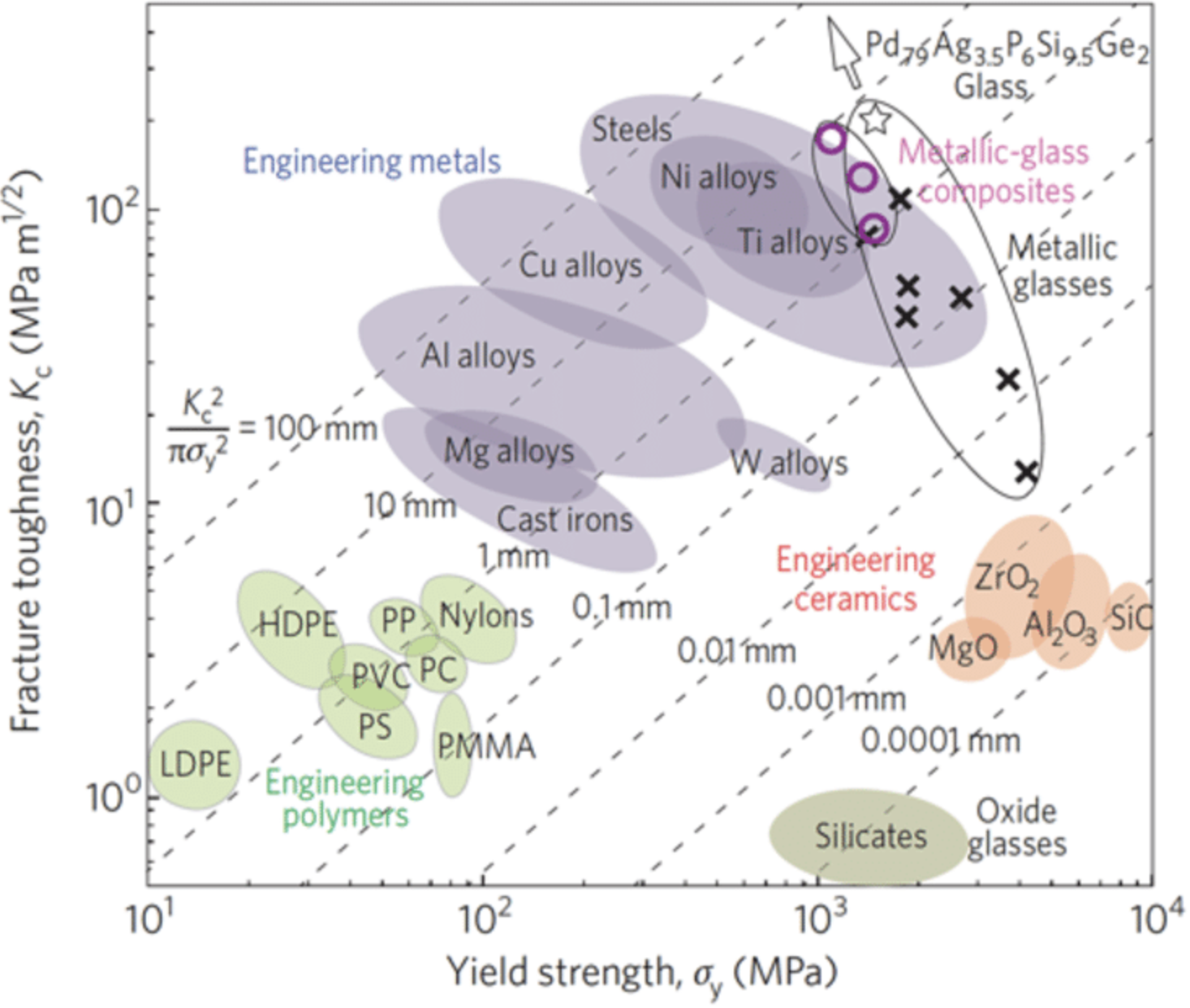
Але тут хочеться акцентувати увагу на одному конкретному властивості: міцності. Ми сьогодні говорили про використання стискаючого напруги, щоб зробити скло міцнішим. Але що робити, якби скло все-таки можна було зробити міцніше? Що робити, якщо його можна зробити міцніше, ніж основні конструкційні матеріали, такі як сталь? У дослідницьких лабораторіях це саме те, що відбувається. Наприклад, у папері Nature Materials від 2011 року (doi: 10.1038/nmat2930) автори зробили певний тип металевого скла міцнішим за сталь і критично також жорсткішим за сталь. Це означає, що він не тільки має високий модуль Юнга, але коли він розривається, він може деформуватися пластично, на відміну від руйнування. Вони створили цей новий матеріал завдяки його хімії, додавши до суміші дотику паладію та срібла. У ньому вже було трохи фосфору, кремнію та германію, але, додаючи паладій та срібло, скло змогло перевершити сталь як за твердістю, так і за в'язкістю. З тих пір було зроблено ще багато демонстрацій механічно надміцного скла (часто намагаючись уникнути паладію, який коштує 50 000 доларів за кг. Ось сюжет з того самого паперу, що показує в'язкість руйнування проти межі текучості різних матеріалів. Знову ж таки, вихід пов'язаний з тим, скільки сили може витримати матеріал, не порушуючи, а в'язкість - це те, наскільки він може зламатися, не руйнуючись. Піднятися на обох осях може бути дуже привабливим для багатьох застосувань. Я люблю такі сюжети (звані «сюжети Ешбі»), так як ми можемо відразу порівняти купу різних матеріалів, в даному випадку оксидів, кераміки, полімерів, металів, і, звичайно, свої нові речі (показані як позначки «х» на сюжеті). Зверніть увагу, наскільки міцні звичайні старі оксидні окуляри, а також те, наскільки мало міцності вони мають (коли вони дають, вони руйнуються). Але зверніть увагу також, наскільки жорсткіше вони можуть отримати шляхом інженерії їх хімії. Це може поставити аморфні матеріали на траєкторію, щоб стати одними з найбільш, якщо не найбільш стійких до пошкоджень матеріалів у світі!
Чому це працює
В останній лекції для цього розділу я перерахував виробництво скла та компанії, що працюють над інноваціями в хімії скла. Для цієї глави про інженерне скло, давайте поговоримо про розумні. Зокрема, «розумне скло». Наразі ця етикетка означає один конкретний тип скла на основі силікату: перемикається скло. Це існує вже давно, як навіть у 1980-х ви, можливо, помітили (добре, ваші батьки могли помітити) людей, які носять сонцезахисні окуляри, які автоматично тонуються та знебарвлюються у відповідь на сонце (які використовували те, що називаються «термохромними» матеріалами, вбудованими в скло, які змінюють колір на основі температура. Вони ніколи не працювали так добре, залишаючись занадто затіненими всередині і трохи занадто незатіненими зовні, але ідея була там. Але зараз ми перейшли від термо- до електрохромного скла, і можливості серйозно захоплюють. З крихітним прикладеною напругою скло може бути спроектовано так, щоб рухатися вперед і назад між майже повною прозорістю і майже повною непрозорістю. Окрім надзвичайно крутого, цей тип технологій може мати багато позитивних переваг, пов'язаних із стійкістю, оскільки скло може бути запрограмовано на автоматичне затемнення та освітлення у відповідь на умови зовнішнього освітлення - що, в свою чергу, може різко зменшити енергетичні потреби будівлі.
Цей тип розумного скла все ще знаходиться на ранній стороні, хоча ряд компаній злітає, а це означає робочі місця. Це будуть робочі місця на початках середнього або раннього діапазону, але в деяких випадках вони закрили мега (> $100 млн) раунди збору коштів, тому, безумовно, зростання є сильним. Деякі компанії в цьому просторі включають Kinestral, Smartglass, View, Suntuitive, Gentex, інтелектуальне скло або скляні додатки. Багато інвестицій у ці компанії надходять від великих, таких як Asahi Glass або Corning, які, звичайно, також розпочали власні програми розумного скла. Узяті разом все це заклинання завдання в майбутньому зі скла. І його майбутнє виглядає дуже яскравим, далеко за межами перемикання кольору або прозорості, оскільки теплові, електронні та оптичні властивості матеріалу продовжують розроблятися. Ми можемо або не можемо жити в «Вік скла», як любить говорити Корнінг, але ми впевнені, що живемо в захоплюючий час для цього матеріалу.
Приклади проблем
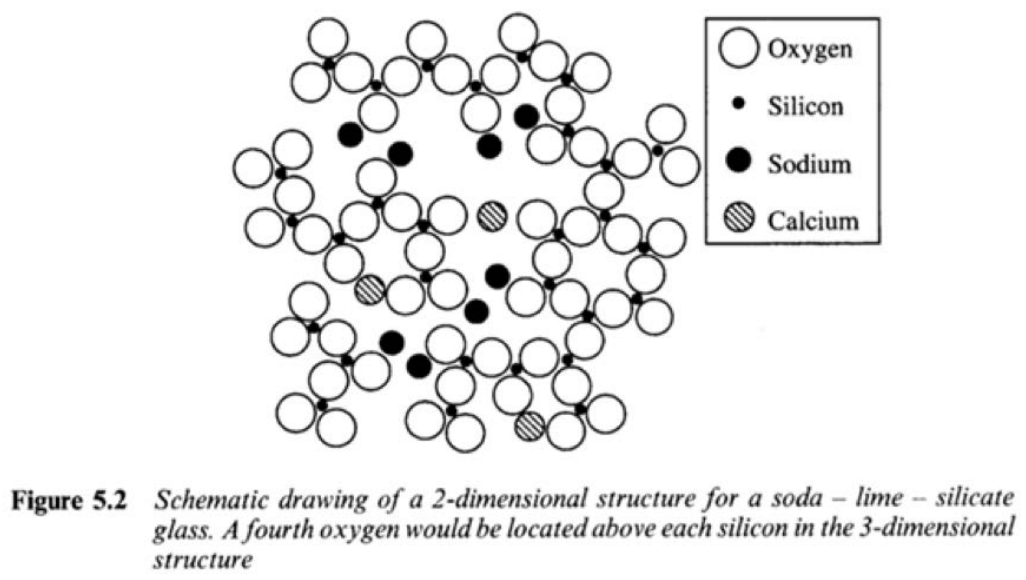
1. 2-D структура натрієво-вапняного скла (використовується у вікні) показана нижче.
а) Які сполуки використовувалися для виготовлення цього скла? Чи служать ці сполуки мережевими формувачами або модифікаторами мережі?
- Відповідь
-
\(\mathrm{SiO}_2\): network former
\(\mathrm{CaO}\): модифікатор мережі
\(\mathrm{Na}_2 \mathrm{O}\): модифікатор мережі
б) Як кожне з доданих сполук впливає на структуру зв'язку в склі?
- Відповідь
-
\(C a_O\): розриває одну зв'язку/створює два модифікатори мережі (узгоджені з\(1 \mathrm{Ca}^{2+}\) іоном)
\(\mathrm{Na}_2 \mathrm{O}\): розриває одну зв'язку/ створює два модифікатори мережі (узгоджені з\(2 \mathrm{Na}^{+}\) іонами)
3. Якщо вони охолоджуються з однаковою швидкістю, чи очікуєте ви, що кремнеземне скло з 14%\(\mathrm{Na}2\mathrm{O}\) або 25%\(\mathrm{Na}2\mathrm{O}\) матиме:
Вищий молярний об'єм?
Вища температура скляного переходу?
Вища в'язкість?
- Відповідь
-
\(14 \%\)б більший молярний об'єм мав
\(14 \%\) би більш високу температуру скляного переходу,
\(14 \%\) матиме вищу в'язкість
4. Якщо діоксид кремнію легований\(\mathrm{MgO}\), а потім іонний обмін виконується таким чином, щоб\(\mathrm{Ca}\) іони замінили\(\mathrm{Mg}\) іони, як змінилися б механічні властивості скла?
- Відповідь
-
\(\mathrm{Ca}\)іони займають більше місця, ніж\(\mathrm{Mg}\) іони, тому скло буде перебувати під внутрішнім стисненням (як крапля принца Руперта)
Лекція 27: Швидкість реакції
Резюме
Хімічна кінетика означає вивчення швидкостей реакції, які відповідають змінам концентрацій реагентів і продуктів з часом. Деякі терміни, які слід знати: концентрація\(=\) молів/літр\(=\) молярність\(=[]\)\(=\mathrm{d}[] / \mathrm{dt}\), швидкість, закон швидкості - це деяке рівняння, яке пов'язує швидкість до [], інтегрований закон швидкості пов'язує [] до\(\mathrm{t}\) (ime), і рівняння Арренія дає нам швидкість проти\(\mathrm{T}\) (температура)
Візьміть просту реакцію, коли,\(a A \rightarrow b B:\) оскільки маса зберігається, А зникає не швидше, ніж\(\mathrm{B}\) з'являється, тому фактична швидкість реакції є\(=1 / \mathrm{b} \mathrm{d}[\mathrm{B}] / \mathrm{dt}=-1 / \mathrm{a} \mathrm{d}[\mathrm{A}] / \mathrm{dt}\). Іншими словами, зміна концентрації\(\mathrm{B}\) повинна дорівнювати протилежній зміні концентрації\(\mathrm{A}\) зважених на одиницю над молярним коефіцієнтом a або b Ми можемо мати більше одного продукту реагенту і така ж ідея дотримується. Наприклад, припустимо, що у нас є по 2 з кожного:\(a \mathrm{~A}+\mathrm{bB} \rightarrow \mathrm{cC}+\mathrm{dD}\). У цьому випадку швидкість реакції буде:
\(\text { rate }=\dfrac{-1}{a} \dfrac{d[A]}{d t}=\dfrac{-1}{b} \dfrac{d[B]}{d t}=\dfrac{1}{c} \dfrac{d[C]}{d t}=\dfrac{1}{d} \dfrac{d[D]}{d t}\)
Загальний спосіб написання рівняння для швидкості для рівняння вище такий: швидкість\(=\mathrm{k}[\mathrm{A}]^m[\mathrm{~B}]^n\), де\(\mathrm{k}=\) швидкість постійна і залежить від умов (\(\mathrm{T}, \mathrm{P}\), розчинник), m і n - показники, визначені експериментально,\(m+n\) називається порядком реакції. Зверніть увагу, що одиниці швидкості завжди повинні бути м/с за визначенням, тому це означає, що одиниці\(\mathrm{k}\) залежать від\(\mathrm{n}\) і\(\mathrm{m}\). Для цього класу ми розглянемо три різних порядку реакцій:\(0^{th}, 1^{st},\) і\(2^{nd}\).
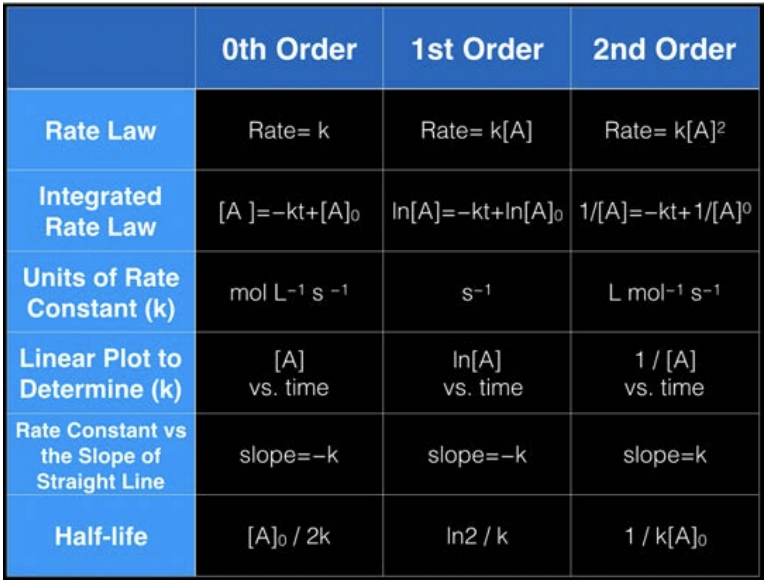
Щоб дізнатися порядок реакції на основі таблиць даних, як наведена нижче, візьміть будь-які два рядки даних: скажіть\(\mathrm{t}=26 \mathrm{~min}\) і\(\mathrm{t}=70 \mathrm{~min}\) рядки. Коефіцієнт концентрації між цими двома кратами становить\(0.0020 / 0.0034=0.5882\). Коефіцієнт ставки дорівнює\(1.8 / 5.0=0.36\)
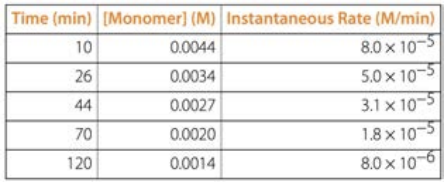
Перш за все, ставка змінюється, тому вона не може бути 0-й порядок. По-друге, у два різні часи співвідношення концентрацій не дорівнює співвідношенню норм, тому воно не може бути 1-го порядку. Але якщо квадратувати співвідношення концентрацій,\((0.0020/0.0034)^2 = 0.35\) яке дуже близько до\(0.36\), то тепер у нас є наша відповідь: з даних можна сказати, реакція 2-го порядку!
Щоб знати роль температури у визначенні швидкості реакції, ми повинні спочатку дізнатися про теорію зіткнення. Теорія зіткнення обрамляє реакцію між молекулами, скажімо A і B, наступним чином: 1) реакція може відбуватися тільки при зіткненні А і В, 2) не всі зіткнення призводять до утворення продукту, 3) є два фактори, які мають найбільше значення: енергія зіткнення і орієнтація молекули А по відношенню до B в момент зіткнення.
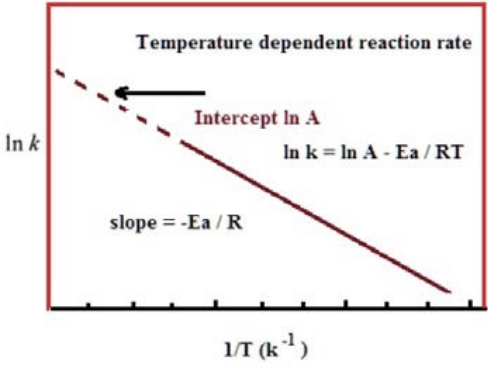
Ми можемо думати про енергію, необхідну для\(\mathrm{A}\) реагування,\(\mathrm{B}\) щоб бути своєрідною «енергією активації» або\(\mathrm{E}_a\). Як ми дізналися в розділі 14 (фази), молекули при заданій температурі мають розподіл кінетичних енергій, причому ця температура є середньою. Це означає, що деякі молекули мають набагато більше енергії, ніж середні, тоді як інші мають менше. Реакції схожі тим, що це частина розподілу вище, ніж енергія активації, яка має значення. Цей сюжет показує, як це працює: розподіл енергій для даної молекули при двох різних температурах показує, що для більш високої температури більше молекул матимуть енергії вище енергії активації, ніж для нижчої температури.
Рівняння Арренія дає нам вираз, який узагальнює модель зіткнення хімічної кінетики. Він йде наступним чином: швидкість = (частота зіткнень) * (стеричний коефіцієнт) * (частка зіткнень з\(\mathrm{E} > \mathrm{E}_a\)). У математичному плані, це показано тут для рівняння для rate (\(\mathrm{k}\)).
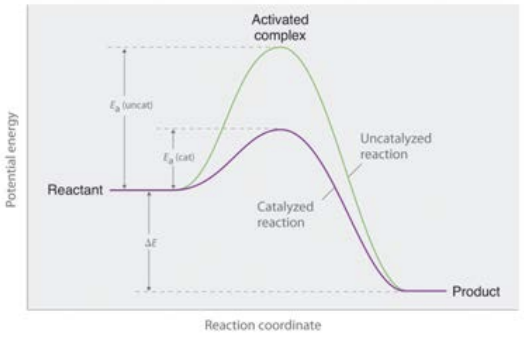
\(\mathrm{A}=\)коефіцієнт частоти, і його одиниці залежать від порядку реакції. Наприклад, якщо реакція першого порядку, то коефіцієнт частоти повинен мати\(s^{-1}\) одиниці енергії активації\(\mathrm{E}_a\), ми вже обговорювали. Якщо це дається в одиницях на моль, наприклад\(\mathrm{J} / \mathrm{mol}\), ми використовуємо,\(\mathrm{R}\) як написано, де\(\mathrm{R}\) ідеальна газова константа\(\mathrm{R}=8.314 \mathrm{~J} / \mathrm{K}^*\) моль. Якщо енергія активації задана в одиницях\(\mathrm{eV}\), то використовуваною постійною буде константа Больцмана в одиницях\(\mathrm{eV}\left(8.61733 \times 10^{-5} \mathrm{eV} / \mathrm{K}\right)\).
Цей зв'язок означає, що якщо ми будуємо\(\log\) природну швидкість проти,\(1 / \mathrm{T}\) то це повинна бути пряма лінія з нахилом\(=-\mathrm{Ea} / \mathrm{R}\) і\(=\ln (\mathrm{A})\) перехопленням, як показано на графіку вище.
Отже, ми охопили концентрацію, а тепер температуру. Останній приклад способу змінити швидкість реакції, що ми будемо згадувати (і на відміну від цих двох інших, ми дійсно просто згадати його і не вдаватися в деталі) є каталізатором. Каталізатор - це спосіб збільшити швидкість реакції, не маючи нічого спожитого як її частину. Це матеріал, який, на мові нашої дискусії про Arrhenius вище, знижує енергію активації реакції.
Чому це важливо
Давайте продовжимо йти з темою каталізатора для цього розділу. Підраховано, що\(\approx 90 \%\) з усіх комерційно вироблених хімічних продуктів задіяні каталізатори на якомусь етапі процесу їх виготовлення! Деякі з цих процесів я вже висвітлював в інших моментах Чому це важливо, як процес Haber-Bosch для фіксації\(\mathrm{N}_2\) або виснаження CFC.\(\mathrm{O}_3\) У той час ми не дізналися про швидкість реакції або каталізатори, тому я не заглиблювався в це. Але в обох випадках роль каталізатора є абсолютно важливою (насправді велике нововведення Хабер-Боша полягало не в тому, щоб виявити реакцію (яка була відома), а в тому, щоб виявити каталізатор, який знижує температуру, необхідну для того, щоб реакція відбулася економічно та у великих масштабах.
Давайте обговоримо ще одну змінну в світі каталітично посилену реакцію: а саме видалення більшості токсичних викидів від легкових і вантажних автомобілів. Я знаю, ви, можливо, думаєте, що вихлопна труба автомобіля пахне досить токсично. І це тому, що це так, але це набагато краще, ніж раніше, і причина в каталізаторах, які зараз є частиною кожної вихлопної труби у вигляді так званого каталітичного нейтралізатора. Навіщо нам це було потрібно в першу чергу? Все сходить до найпершої реакції, яку ми написали в перший день лекції: горіння. Одним із прикладів, який я наводив, було спалювання метану:
\(\mathrm{CH}_4+2 \mathrm{O}_2 \rightarrow 2 \mathrm{H}_2 \mathrm{O}+\mathrm{CO}_2\)
Це правда, що\(\mathrm{CO}_2\) шкідливо для навколишнього середовища з причин зміни клімату, але в цих продуктах немає нічого токсичного... так в чому проблема?

Ах, якби тільки машини спалювали чистий метан! Але бензин знаходиться далеко, далеко від чистого джерела палива. І крім того, навіть сучасні автомобільні двигуни далеко, далеко не здатні ідеально спалювати паливо без побічних реакцій. Бензин являє собою суміш близько 150 різних хімічних речовин, і до них відносяться не тільки ті вуглеводні, які спалюють, але і безліч добавок, які варіюються за призначенням від інгібіторів корозії до мастильних матеріалів до кисневих прискорювачів. Оскільки цей складний хімічний суп не горить чисто, ми отримуємо як прямі продукти, так і побічні продукти, які виходять далеко за межі чистого випадку\(\mathrm{H}_2\mathrm{O}\) і\(\mathrm{CO}_2\). Багато з цих продуктів є забруднюючими речовинами, а деякі з них дійсно погані. Неповний список включатиме: окис вуглецю (\(\mathrm{CO}\)), який є отруйним, оксиди азоту (як\(\mathrm{NO}\) і\(\mathrm{NO}_2\), або «\(\mathrm{NOX}\)» як їх називають), які викликають смог і мають багато несприятливих наслідків для здоров'я, оксиди сірки (так, ви здогадалися, «\(\mathrm{SOX}\)»), які викликають кислотний дощ, і незгорілі вуглеводні або леткі органічні сполуки (ЛОС), які викликають рак.
Подібно до видалення ХФУ з холодоагентів, очищення вихлопної труби є фантастичним прикладом того, як політика та регулювання можуть зробити світ кращим. Це був Закон про чисте повітря, який Конгрес прийняв у 1970 році, який дав новоствореному EPA юридичні повноваження регулювати цей токсичний безлад, який вийшов з автомобілів. Як результат, сьогоднішні автомобілі мають\(\approx 99 \%\) менше викидів порівняно з 1960-х роками! Паливо також чистіше (свинець був видалений і рівень сірки знижений), і разом взяті міста мають набагато здоровіше повітря. Погляньте на цю фотографію Нью-Йорка 1973 року (ліворуч) порівняно з 2013 роком (праворуч). У 1970-х роках смог з вихлопних газів автомобілів переповнив більшість великих міст США.
Ключовою технологією, яка дозволила цю драматичну очистку, є каталітичний нейтралізатор. Усередині каталітичного нейтралізатора насправді є кілька каталізаторів, кожен з яких посилює різні реакції. Більшість автомобілів сьогодні використовують те, що називається «тристороннім» каталізатором, що просто означає, що він вирішує всі три найбільших забруднюючих речовин: NOX, вуглеводні та\(\mathrm{CO}\). Ключовими матеріалами, які використовуються в якості каталізаторів, є комбінація платини, паладію та родію. Усередині каталітичного нейтралізатора зазвичай є стільникова сітка тільки для того, щоб отримати велику площу поверхні. Оскільки температура стає досить високою (і насправді повинна бути високою для роботи каталізаторів, тому холодні двигуни забруднюють більше, ніж гарячі), стільникова сітка виготовлена з керамічного матеріалу, такого як оксид алюмінію, щоб він міг обробляти\(\mathrm{T}=500^{\circ} \mathrm{C}\) без розтріскування або деградації. The\(\mathrm{Pt}\)\(\mathrm{Pd}\), і\(\mathrm{Rh}\) метали покривають\(\mathrm{Al}_2 \mathrm{O}_3\) сітку, і вихлоп протікає через.
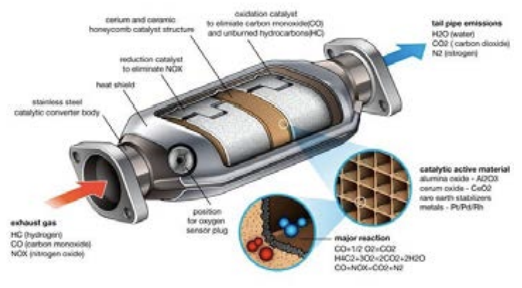
Погляньте на цю схему каталітичного нейтралізатора. Ви можете побачити дві різні камери, одна, де метал діє як «каталізатор відновлення» для видалення NOX, а інша, де інший метал (або комбінація металів) діє як «каталізатор окислення» для обробки\(\mathrm{CO}\) і незгорілих вуглеводнів. У камері каталізатора відновлення реакція, яку ми намагаємося прискорити, є\(2 \mathrm{NO} \rightarrow \mathrm{N}_2+\mathrm{O}_2\). Для цього каталізатор зв'язує\(\mathrm{NO}\) молекулу з нею, а потім здатний витягнути атом азоту\(\mathrm{NO}\) і утримувати його на місці. Потім інший\(\mathrm{N}\) атом, який також витягнув з іншої\(\mathrm{NO}\) молекули, застряє в каталізаторі десь поблизу, і ті Так само може утворюватися кисень\(\mathrm{O})2\). Вся справа в тому, що каталізатор знаходить інший спосіб провести ту ж реакцію з набагато нижчими бар'єрами. Каталізатор окислення спалює\(\mathrm{CO}\) і вуглеводні, використовуючи\(\mathrm{O} 2\) газ, що залишився, наприклад, щоб змусити цю реакцію йти:\(2 \mathrm{CO}+\mathrm{O}_2 \rightarrow 2 \mathrm{CO}_2\). Знову ж таки, ця реакція не відбуватиметься з високою швидкістю нормально, але каталізатор розбиває її на кроки (наприклад, розщеплення\(\mathrm{CO}\)), які відбуваються набагато легше.
Чому це працює
Швидкість реакції, звичайно, має центральне значення для всього, що робить, що включає реакцію. І скільки різних видів робіт роблять що-небудь, пов'язане з реакцією? Тонна! Ми могли б говорити про будь-яку роботу з хімічного синтезу, або в дизайні ліків, де швидкість реакції має вирішальне значення для ефективності та безпеки препарату, або про те, як про виробництво їжі (навіть за межами пива), де ставки визначають що-небудь, від того, як довго, щоб тісто піднялося до того, як швидко, що тісто коричневе в духовці проти яблук всередині повороту кашоподібний (я тільки що зробив яблучний пиріг на випадок, якщо ви не могли сказати), до того, як швидко їжа йде погано. Справа в тому, що виготовлення матеріалу за своєю суттю стосується ставок.
І тому замість того, щоб зосередитися на будь-якому з цих речей, які ми робимо, Я хотів би використовувати цей розділ Чому це використовує згадати той факт, що майже все, що ми робимо сьогодні, занадто багато природного капіталу витрачається, і це не повинно бути таким чином. Один комп'ютерний чіп займає більше 600 разів більше маси, щоб зробити його і величезну кількість як води, так і енергії (включаючи відпал кілька разів при температурі понад 1000° C. цемент чудовий матеріал («рідкий камінь»), але він вимагає випічки силікату кальцію при дуже високих температурах, щоб зробити крихітний частинки називають «клінкерами», які дають йому здатність приймати будь-яку форму в одну мить, а потім висохнути і так швидко після цього. Чому ми знову і знову не можемо робити те, що природа робить так добре? Тварини можуть будувати неймовірно міцні і складні конструкції, не переходячи ні на один градус над кімнатною температурою. Павуки крутять шовк міцніше сталі, не запалюючи багаття. Як ми можемо зробити краще? Значна частина цього зводиться до швидкості реакції. Ми використовуємо ці величезні обсяги енергії, високих температур і жорстких хімічних речовин, тому що ми хочемо зробити речі швидко і тому, що нам потрібно робити речі майже в неймовірних кількостях. Тільки Китай виробляв 2,5 трлн кілограмів цементу в минулому році!
Існують більш стійкі способи виготовлення матеріалу, особливо якщо ми можемо впоратися з швидкістю реакції. Десять років тому я пам'ятаю, як читав статті про нову революцію «зеленої хімії» (перевірити, наприклад, цю статтю 2010 року в Scientific American, https://www.scientificamerican. com/article/green-chemistry-benign-by-design/. Пам'ятаю, думав тоді, що це поле було готове до зльоту. Ну, насправді це не сталося з ударом, але повільно і стійко ця ідея доброякісного дизайну захоплюється. Якщо ви шукаєте зелену роботу хімії, ви знайдете багато компаній, які зараз інвестують в цю область істотно, і це заклинання нових робочих місць. Ідея зеленої хімії на ринку праці коливається досить широко, від пошуку способів синтезу матеріалів без токсичних хімічних речовин, щоб зробити процес відкриття наркотиків біологічно розкладається, до зниження температури, необхідних на етапі виробництва. Як би там не було, вся справа в ставках.
Приклади проблем
1. Оцтова кислота виготовляється з чадного газу і метанолу за наступним рівнянням:
\(CO(g)+MeOH(g) \rightarrow A c O H(g)\)
Ваша компанія хоче знати, як поліпшити цю реакцію: вони представляють вам, хімічному консультанту, наступні дані. Запропонуйте закон ставки для реакції.
| \(\mathrm{CO}\)тиск | \(\mathrm{MeOH}\)тиск | Утворюється оцтова кислота |
|---|---|---|
| \ (\ mathrm {CO}\) тиск">21,5 атм | \ (\ mathrm {MeOh}\) тиск">15,0 атм | 980 моль/год |
| \ (\ mathrm {СО}\) тиск">11.1 атм | \ (\ mathrm {MeOh}\) тиск">15,0 атм | 499 моль/год |
| \ (\ mathrm {СО}\) тиск">11.1 атм | \ (\ mathrm {MeOh}\) тиск">10,0 атм | 502 моль/год |
- Відповідь
-
Швидкість досить нечутлива до зміни\(\mathrm{MeOH}\), але швидкість падає приблизно вдвічі, коли тиск\(\mathrm{CO}\) знижується вдвічі. Тому норма\(0^{th}\) порядкова в метанолі, але\(1^{st}\) порядок в\(\mathrm{CO}\):
\(rate = k[CO]\)
Лекція 28: Рівноваження та розчинність
Резюме
Багато хто з вас, напевно, чули вираз «як розчиняється, як».. але давайте додамо трохи більше хімії до цієї фрази. Те, що насправді мається на увазі під словом «як», - це «подібні зв'язки», тому вираз можна також сказати: «подібні зв'язки розчиняють подібні зв'язки». Розчинність - це метрика, яка повідомляє нам, скільки розчинена речовина (тверда речовина, що розчиняється) може розпадатися і розчинятися в розчиннику (рідині, в якій розчиняється тверда речовина). Коли розчинність змішується, це означає, що вона може бути повністю змішана разом у будь-якій концентрації.
Величезну роль в розчинності грають міжмолекулярні сили. Воду називають полярним розчинником (також називають гідрофільним), оскільки це розчинник з великими дипольними моментами, тоді як вуглеводні є прикладами неполярних розчинників (також званих гідрофобними), оскільки домінуючим МВФ є Лондон. Полярні розчинники, як правило, не змішуються з неполярними розчинниками.
Що насправді відбувається в масштабі молекули та її різних IMF, полягає в тому, що якщо молекула може знизити або зберегти подібну свою енергію, вітаючи іншу молекулу в своє середовище зв'язку, то вона зробить це. Якщо з іншого боку, інша молекула не може зв'язатися таким же чином (як у прикладі більш тривалого ланцюга вуглеводнів, що має набагато більше лондонських сил, ніж здатність H-зв'язку), то це підвищить енергію системи для розчинника, щоб зв'язатися з ним над собою.
Частинки в розчині, які повторно приєднуються до твердого тіла, як кажуть, осаджують. як розчинення, так і осадження відбуваються одночасно і в точці насичення, або максимальної розчинності, вони відбуваються з точно такою ж швидкістю. Це називається динамічною рівновагою.
Ми знаємо з наших попередніх лекцій про іонні тверді тіла, що це катіони та аніони в твердому тілі, що є основою іонного зв'язку. При розчиненні у воді вони також залишаються іонами, тільки зараз в розчині, де вони сильно взаємодіють з водою. Ми можемо зрозуміти, чому, оскільки ми знаємо з нашої лекції МВФ, що іони будуть взаємодіяти з диполем молекули води. Причина, що існує тенденція в розчинності цих солей, пов'язана з міцністю зв'язку між іонами в твердому тілі щодо тих, що знаходяться в рідині. У міру того, як іонний зв'язок стає міцнішим (від найслабшого at\(\mathrm{NaI}\) до найсильнішого при\(\mathrm{NaF}\)), менше його розчиняється.
Припустимо, загальна реакція вже досягла свого динамічного рівноваги:
\(a A+b B \leftrightarrow c C+d D\)
Це означає, що чотири різні концентрації\([\mathrm{A}],[\mathrm{B}],[\mathrm{C}]\), і не\([\mathrm{D}]\) змінюються, навіть якщо реакція все ще йде в обох напрямках. Нижче наведено приємну картину того, що може статися з цими концентраціями як функція часу. Спочатку під час реакції концентрації змінюються, а потім всі вони розплющуються. У той момент, коли всі вони плоскі, система досягла динамічної рівноваги. Визначимо коефіцієнт реакції\(\mathrm{Q}\), як співвідношення
\(\dfrac{[C]^c[D]^d}{[A]^a[B]^b}\)

Цей вираз для\(\mathrm{Q}\) можна оцінити в будь-який момент реакції, чи досягла система рівноваги чи ні. \(\mathrm{BUT}\), у нас є особливий спосіб зателефонувати,\(\mathrm{Q}\) коли система знаходиться в динамічній рівновазі, і це з буквою\(\mathrm{K}\), або постійною рівноваги для реакції. Часто ми ставимо індекс «еквалайзер» на\(K\) просто, щоб переконатися, що ми знаємо, до чого він відноситься, так\(\mathbf{K}_{e q}=\mathbf{Q}\) (для коефіцієнта реакції в рівновазі). Keq для твердої речовини, що розчиняється у воді, є продуктом розчинності\(\left(\mathbf{K}_{s p}\right)\)
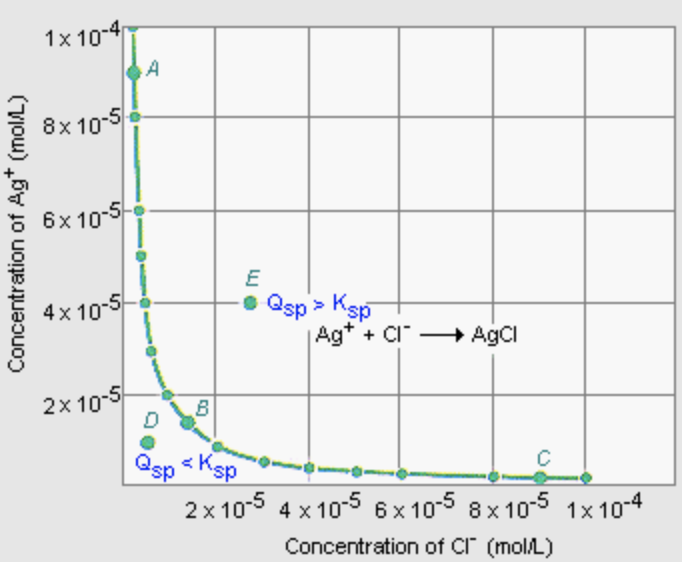
Порівнюючи значення з\(\mathrm{Q}\) постійною рівноваги\(\mathrm{Keq}\), для реакції, ми можемо визначити, чи буде сприятлива пряма реакція або зворотна реакція.
Якщо\(\mathrm{Q}=\mathrm{K}_{e q}\), реакція знаходиться в рівновазі. Якщо\(\mathrm{Q}<\mathrm{K}_{e q}\), як і в точці\(\mathrm{D}\), то реакція буде рухатися вправо (в прямому напрямку), щоб досягти рівноваги. Якщо\(\mathrm{Q}>\mathrm{K}_{\text {eq }}\), як в точці\(\mathrm{E}\), то реакція буде рухатися вліво (в зворотному напрямку), щоб досягти рівноваги. Le Chatelier приходить до нас в графічному вигляді!
Чому це важливо
Вивчаючи крихітні бульбашки, що потрапили в крижані ядра, ми знаємо, що рівень в\(\mathrm{CO}_2\) даний час в атмосфері більше, ніж за мільйон років, і кількість зростає в геометричній прогресії. Але хоча цей неймовірно важливий парниковий газ отримав величезну увагу за його роль у зміні клімату, набагато рідше\(\mathrm{CO}_2\) обговорюється вплив, який має на нашу планету. Можливо, це тому, що це відбувається в океанах, в яких ми не живемо, тому важче зробити таку ж велику угоду про зміни, що відбуваються. Але ми відчуємо ці зміни досить скоро. Океан поглинув понад 500 мільярдів тонн\(\mathrm{CO}_2\) з атмосфери, оскільки він спокійно захоплює приблизно чверть того, що викидається день у день (сьогодні ми, люди, викручуємо 1,200,000 грамів\(\mathrm{CO}_2\) в секунду). Так чому ж це має значення?
Проблема з усім, що зайве\(\mathrm{CO}_2\) в океанах полягає в тому, що це робить воду більш кислою. Тільки за останні 200 років океанська вода стала на 30 відсотків більш кислою. Ця зміна кислотності відбувається швидше, ніж будь-яка відома зміна хімії океану за останні 50 мільйонів років! У геологічному плані це вкрай різке збурення, і без кардинальних змін в поведінці людини ми бачимо тільки початок.
На жаль, одна з найважливіших захисних засобів для океанських істот - панцир - не може пережити підвищеної кислотності. Ось картина того, що відбувається з панциром птеронога, різновиду молюска лише кілька\(\mathrm{cm}\) довгих, через 45 днів у розчині\(\mathrm{pH}=7.8\). Тепер океани ще не настільки кислі (поточний океан\(\mathrm{pH}\) - 8.1), але вони добре на своєму шляху. Птероподи - один із небагатьох основних видів морських істот, який сидить на самому дні океанського харчового ланцюга, прямо над планктоном та морськими водоростями, а це означає, що якщо їх чисельність зменшується, впливає все вище на харчовому ланцюгу, від криля до лосося, оселедця та птахів, тюленів та білих ведмедів, і звичайно ж, до нас.
У сумці goodie, яка йде з цими лекціями, ви зможете побачити це розчинення в дії. Ми змушуємо це йти швидше, ніж 45 днів, оскільки я не хочу, щоб ви так довго чекали, але хімія в грі така ж. Я хотів, щоб ви торкнулися і відчули цю дорогоцінну втрату карбонату кальцію, щоб ви могли зазирнути в те, що починає відбуватися з 2/3 нашої планети.
Чому це працює
Для того щоб препарати надавали фізіологічний вплив на організм людини, вони повинні перебувати в розчині. Зокрема, їх необхідно розчиняти в розчині, якщо вони починаються в твердому вигляді, як це роблять таблетки. Зараз швидкість розчинення вкрай важлива, оскільки визначає, наскільки швидко препарат засвоюється в організмі. Ставки обговорювалися в останньому розділі. Але сама розчинність (тобто незалежно від того, як швидко вона розчиняється, яка його здатність повністю розчинятися взагалі?) також має вирішальне значення в дизайні ліків. Якщо препарат не дуже розчинний, склади можуть призвести до труднощів у використанні препарату, які в іншому випадку можуть мати дуже сприятливий вплив. Якщо препарат має низьку розчинність, це означає, що він, ймовірно, матиме низький рівень того, що називається «біодоступністю», що в основному просто означає, що він не отримає достатнього впливу в організмі.
У фармацевтичних компаніях, які роблять більшу частину розробки нових ліків, за оцінками, колосальні 40% всіх нових хімічних речовин (можливі нові корисні препарати) практично не розчиняються у воді, що робить їх ефективно марними. І що роблять ці компанії, щоб спробувати підвищити розчинність, особливо для перспективних в іншому випадку кандидатів? Хімічна модифікація, звичайно! І так це те, що всі великі фармацевтичні компанії шукають людей, які знають про розчинність! З точки зору, де шукати роботу, річ про наркотики дизайн компаній є те, що ви не повинні дивитися дуже далеко. Всього в 1 милі від кампусу, є десятки великих і малих компаній, що спеціалізуються на розробці наркотиків. Більш широко, на площі Кендалл зараз є найбільша біотехнологічна промисловість на квадратний фут, з більш ніж 120 компаніями в межах милі.
З точки зору того, які з цих компаній мають робочі місця, пов'язані з розчинністю, добре через те, наскільки важливою є розчинність, це майже всі з них. Перевірте, наприклад, оголошення про роботу в Takeda, Novartis, Alnylam, Sanofi, Pfizer та Genentech, щоб просто розпочати роботу, а потім йти по вулиці, щоб піти дізнатися більше про компанії, що вони роблять, і зустрітися з ними особисто!
Приклади проблем
1. Фторид кальцію має a\(\mathrm{K}_{sp}\)\(5.3×10^{-9}\). Скільки фторид кальцію може розчинити в 1\(\mathrm{L}\) частині води?
- Відповідь
-
\[k_{s p}=[C a][F]^2 \nonumber\]
Для кожної родимки,\(\mathrm{Ca}\) що розчиняється, вдвічі більше родимок\(\mathrm{F}\) повинні розчинятися, оскільки хімічна формула є\(\mathrm{CaF}_2\). Припускаючи, що\(\mathrm{x}\) родимки\(\mathrm{Ca}\) розчиняються:
\ почати {зібраний}
K_ {s p} = [x] [2 х] ^2\\
5.3\ раз 1-^ {-9} =4 х ^ 3\
x = 0,00109 М\\
78\ dfrac {г} {\ mathrm {~моль}}\ dfrac {0,00109\ mathrm {~моль}} {L} =85.9\ mathrm {мг}/1\ mathrm {~L}
\ кінець {зібраний}
Лекція 29: Загальні іони та кислоти/Основи
Резюме
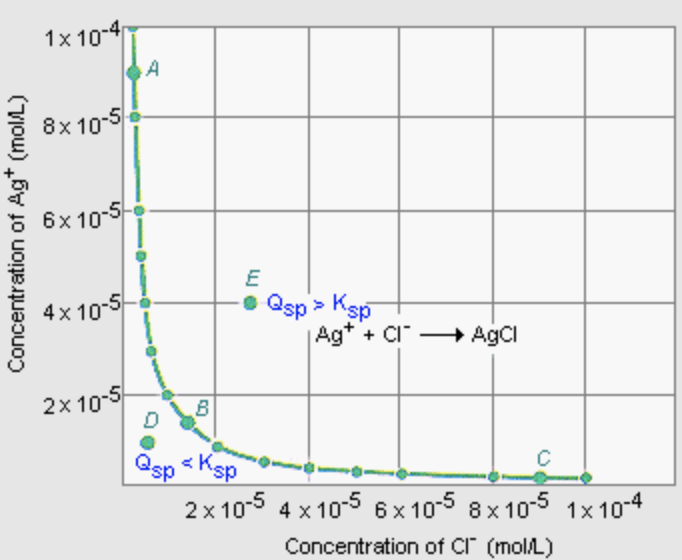
Принцип Ле Шательє стверджує, що положення рівноваги рухається з урахуванням змін в системі, таких як введення нового іона в розчин. Але що станеться, якщо ми додамо нову сполуку, яка має один іон спільного з існуючим розчином? Крива рівноваги для\(\mathrm{AgCl}\) дисоціації показана праворуч. Припустимо, додамо\(\mathrm{NaCl}\): він буде дисоціювати повністю на іони\(\mathrm{Na}^{+}(\mathrm{aq})\) і\(\mathrm{Cl}^{-}(\mathrm{aq})\). Ми можемо використовувати таблицю ICE для визначення зсуву рівноваги: якщо ми почнемо з точки\(\mathrm{B}\) і додамо\(0.1 \mathrm{M} \mathrm{NaCl}\), ми можемо використовувати константу рівноваги для\(\mathrm{AgCl}, \mathrm{K}_{s p}=1.7 \times 10^{-10}\). \(\left[\mathrm{Cl}^{-}\right]\)Зі збільшенням,\(\left[\mathrm{Ag}^{+}\right]\) повинен зменшуватися, щоб тримати\(\mathrm{K}_{s p}\) постійним.
| [\(AgCl\)] | [\(Ag^+\)] | [\(Cl^-\)] | |
|---|---|---|---|
| Я | \ (AgCl\)] "> (всі тверді) | \ (Ag^+\)] ">\(1.3 \times 10^{-5}\) | \ (Cl^-\)] ">\(1.3 \times 1^{-5}\) |
| C | \ (AgCl\)] ">+ x випадає в осад | \ (Ag^+\)] ">\(-x\) | \ (Cl^-\)] ">\(+0.1 - x\) |
| Е | \ (AgCl\)] ">Більш твердий | \ (Ag^+\)] ">\(1.3 \times 10^{-5} - x\) | \ (Cl^-\)] ">\(+0.1 - x\) |
\ почати {зібраний}
K_ {s p} =\ лівий [\ mathrm {Ag} ^ {+}\ праворуч]\ лівий [\ mathrm {Cl} ^ {-}\ праворуч] =( 0,1-x)\ лівий (1,3\ раз 10^ {-5} -х\ праворуч)\\
K_ {s p} =0,1\ ліворуч (1,3\ раз 10^ {-5} -х\ вправо) =1.7\ раз 10^ {-10}\ квад х = 1.7\ раз 10^ {-9}
\ кінець {зібраний}
Це називається загальним іонним ефектом: розчинність однієї складової пригнічується додаванням другого розчиненого речовини.
Для загального випадку будь-якої кислоти, називаючи її «А», пишемо її реакцію розчинення наступним чином:\(\mathrm{HA}+\mathrm{H}_2 \mathrm{O} \rightarrow\)\(\mathrm{H}^{+}+\mathrm{A}^{-}+\mathrm{H}_2 \mathrm{O}\). Хоча ми пишемо,\(\mathrm{H}^{+}\) щоб зробити дисоціацію протонів явною, ми ніколи насправді не маємо на увазі, що якщо це у воді. Це тому, що\(\mathrm{H}^{+}\) іон не є стабільним\(\mathrm{H}_2 \mathrm{O}\), замість цього він завжди стає\(\mathrm{H}_3 \mathrm{O}^{+}\). Першою людиною, яка визначила кислоти та основи будь-яким більш конкретним хімічним способом, був старий добрий Сванте Арреній. За його словами, кислота - це речовина, яка розчиняється у воді з утворенням\(\mathrm{H}+\) іонів, а основа - речовина, яка розчиняється у воді з утворенням гідроксидних\(\left(\mathrm{OH}^{-}\right)\) іонів.
Арреній визначав кислоти та основи з точки зору присутності\(\mathrm{H}^{+}\) або\(\mathrm{OH}^{-}\) іонів у розчині: наприклад,\(\mathrm{HCl}(a q) \rightarrow \mathrm{H}^{+}(a q)+\mathrm{Cl}^{-}(a q)\) є «Арренієва кислота», тоді як\(\mathrm{NaOH}(s) \rightarrow \mathrm{Na}^{+}(a q)+ O H^{-}(a q)\) «основа Арреніуса».
Соренсон придумав шкалу «потужність водню», або шкалу «pH» для стиснення. \(\mathrm{pH}=-\log \left[\mathrm{H}^{+}\right]\). \(\mathrm{pH}\)Шкала працює від 0 до 14, при цьому 0 є надзвичайно кислим, а 14 є надзвичайно основним. Ми можемо зробити те ж саме для концентрації\(\left[\mathrm{OH}^{-}\right]\): потужності\(\mathrm{OH}^{-}\) в розчині, або «PoH»\(=-\log \left[\mathrm{OH}^{-}\right]\), з протилежним визначенням.
Сильна кислота як\(\mathrm{HCl}\) би повністю дисоціює:\(\mathrm{HCl}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{H}^{+}+\mathrm{Cl}^{-}+\mathrm{H}_2 \mathrm{O}\), так\(0.1 \mathrm{M} \mathrm{HCl}\) має\(\left[\mathrm{H}^{+}\right]=0.1\), так\(0.1 \mathrm{M} \mathrm{HCl}\) розчин має\(\mathrm{pH}=-\log [0.1]=1.0\).
Деякі матеріали можуть бути як кислоти, так і основи. Ніхто інший, як вода сама по собі є одним з таких матеріалів! Коли молекула може або давати\([\mathrm{H}+]\)\([\mathrm{OH}-]\) іони або іони в розчин, це називається амфотерним:\(\mathrm{H}_2 \mathrm{O}(l)+\mathrm{H}_2 \mathrm{O}(l) \leftrightarrow \mathrm{H}_3 \mathrm{O}^{+}(a q)+\mathrm{OH}^{-}(a q) . \mathrm{K}_{s p}\) для води називається\(\mathrm{K}_w: K_w=\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\left[\mathrm{OH}^{-}\right]= 1.0 \times 10^{-14}\). Якщо в чисту воду додають кислоту, концентрація іонів водню збільшується (а концентрація\(\mathrm{OH}\) іонів зменшується). Основа йде іншим шляхом, додаючи гідроксидні іони в чистий водний розчин. Всі хитрощі, для яких ми навчилися\(\mathrm{K}_w\),\(\mathrm{K}_{s p}\) відносяться до, що особливо корисно в контексті кислот і підстав.
Визначення кислот та основ Арренія має два ключові обмеження: по-перше, оскільки кислоти та основи були визначені з точки зору іонів, отриманих з води, визначення Арренія застосовується лише до молекул у водному розчині. По-друге, і що важливіше, визначення Арренія передбачало, що лише матеріали, які розчиняються у воді, щоб дати\(\mathrm{H}^{+}\) та\(\mathrm{OH}^{-}\) іони, можуть мати властивості кислот та основ. Але є багато прикладів, де це неправда! Нам потрібно вийти за межі Арренія, щоб зрозуміти деякі кислоти та основи.
Чому це важливо
Тепер, коли ми озброєні концепціями ефекту загального іонів та принципу Ле Шательє, ми можемо детальніше розповісти про хімію, яка спричиняє можливу катастрофу, обговорювану в попередньому Чому це важливо: підкислення океану та його вплив на долю карбонату кальцію. Вся справа в рівновазі і про те\(\mathrm{CO}_2\), як її зміщують в океанах. Перша реакція, яку ми розглядаємо, - це те, що відбувається, коли океани стикаються більше\(\mathrm{CO}_2\) з атмосфери: а саме,\(\mathrm{CO}_2\) розчиняється\(\mathrm{H}_2 \mathrm{O}\) в утворюючи вугільну кислоту:
\(\mathrm{CO}_2+\mathrm{H}_2 \mathrm{O} \leftrightarrow \mathrm{H}_2 \mathrm{CO}_3\)
Отже, більше\(\mathrm{CO}_2\) розчинення в океані означає, що в океані є більше вуглекислоти, яка потім виробляє дисоційовані іони наступним чином:
\(\mathrm{H}_2 \mathrm{CO}_3 \leftrightarrow \mathrm{HCO}_3^{-}+\mathrm{H}^{+}\)
Але з іншого боку, ми маємо тверду речовину,\(\mathrm{CaCO}_3\) яка є карбонатом кальцію, яка знаходиться в гарній рівновазі з наступною реакцією дисоціації:
\(\mathrm{CaCO}_3 \leftrightarrow \mathrm{Ca}^{2+}+\mathrm{CO}_3^{2-}\)
Константа рівноваги для розчинення\(\mathrm{CaCO}_3\) є\(\mathrm{k}_{s p}=5 \times 10^{-9}\). Це означає, що не багато його буде дисоціювати в «нормальних» (тобто останніх\(>50\) мільйонів років) умовах океану. Причина, по якій ця рівновага скидається, полягає в тому, що тепер є додаткові\(\mathrm{H}^{+}\) іони, які надходять від\(\mathrm{CO}_2\) реакції вище. Ці\(\mathrm{H}^{+}\) іони споживають (реагують з)\(\mathrm{CO}_3^{2-}\)\(\mathrm{HCO}^{3-}\), утворюючи що знижує концентрацію\(\mathrm{CO}_3^{2-}\). Ах, але ми щойно дізналися про це за допомогою ефекту загального іонів: якщо ми додамо або заберемо якусь молекулу, яка є частиною збалансованої рівноваги, то ми будемо керувати цією рівновагою, щоб протистояти тому, що ми зробили. При цьому витрачається більше,\(\mathrm{CO}_3^{2-}\) ніж раніше, що в свою чергу призводить до більшого розчинення\(\mathrm{CaCO}_3\). Ось чому оболонки розчиняються, і саме тому я хочу, щоб ви відчули цю хімію безпосередньо у своїй сумці для гуді. Те, що ви бачите, це ті експерименти - це прискорена версія того, що відбувається в океанах.
Кислотність вимірюється «»\(\mathrm{pH}\), що є логарифмічною шкалою. З часів промислової\(\mathrm{pH}\) революції океани зменшилися на\(\approx 0.1\) до\(8.07\), що еквівалентно\(\approx 30 \%\) збільшенню кислотності океанів. Я показав цю тенденцію в минулій лекції «Чому це важливо». Оцінки полягають у тому, що при наших нинішніх темпах\(\mathrm{CO}_2\) викидів кислотність океанів досягне колосально більш кислого стану до 2100\(\mathrm{pH}=7.7\) року. Це означало б збільшення кислотності в порівнянні з доіндустріальними рівнями, і це також значною мірою зробить це з точки зору знищення більшості океанського життя.\(>5\)
Океан поглинув приблизно 525 мільярдів тонн\(\mathrm{CO}_2\) з атмосфери за останні 200 років, темпами\(\approx 22\) мільйона тонн на день. Зміна, яку це викликає, є найшвидшою відомою хімічною зміною океану за останні 50 мільйонів років і, ймовірно, набагато довше. Близько 250 мільйонів років тому, наприкінці того, що відомо як «пермська епоха», записи показують, що в океанах відбулася раптова зміна, і геологи називають те, що сталося, як «Велике вмирання». Це тому, що більше\(90 \%\) всіх морських мешканців зникло з викопного запису. Більшість вчених, які вивчають подібного роду речі, пов'язують масове вимирання з величезним сплеском вулканічної активності, який заносить в атмосферу величезні хмари кислого пилу, які потім потрапляли в океани і підвищили їх кислотність.
Причина розчинення карбонату кальцію настільки важливе, полягає в тому, що це важливо не тільки для птероподов, які я показував раніше, але і для багатьох інших «базових» елементів харчового ланцюга океану, таких як фітопланктон, раковина риби (мідії, устриці, омари, раки тощо), і, звичайно, корали, щоб назвати лише кілька приклади. Структури карбонату кальцію у цих морських істот дуже чутливі до незначних змін кислотності, і без них здоров'я океанів піде з ладу. Я закінчу це Чому це має значення цитата, що провокує думки Кена Калдейри, який є вченим з клімату в Стенфорді. Намагаючись допомогти людям зрозуміти, що ми робимо, він сказав: «Ну, якби римляни промислово розвивалися, це було б через дві тисячі років. Моря все ще піднімалися б і все ще були б повністю підкислені, і, можливо, вони отримали б століття або близько того вище GDP, ніж вони мали б інакше». Справа в тому, що згубні зміни, які ми здійснюємо в океанах, не лише вплинуть на наших дітей та дітей наших дітей; це вплине на десятки і, швидше за все, сотні поколінь прийдешніх.
Чому це працює
Я говорив про підкислення океану в цій лекції, оскільки ми вводимо кислоти та основи, і те, що відбувається в океанах, є хорошим прикладом впливу хімії, що відбувається в планетарному масштабі. Але що робити, якщо ви хочете насправді працювати над цією проблемою, як робота? Ну, це не так просто, як ви могли подумати, або, можливо, сподівалися, але є деякі речі, які ви можете зробити.
З одного боку, існує багато-багато академічних або державних програм, які вивчають хімію океану, і багато з них мають посади для роботи. Це варіюється від випадкового проекту підкислення океану в Університеті Di' Болонья, Італія, до Національного океанічного та атмосферного управління кооперативного наукового центру наук про систему Землі та технологій дистанційного зондування (так, на щастя, вони йдуть NOAA-CESSRST), до інших державних установ, таких як EPA або будь-яке агентство, що працює в галузі збереження та політики, до Департаменту екології штату Вашингтон, Університету Стоуні-Брук, який в даний час шукає «Асоціація моніторингу закислення океану». У цій галузі є багато викладацьких посад, і я вірю, що в майбутньому їх буде більше. Тож якщо вас цікавить як ця тема, так і кар'єра в академічних колах, то шлях досліджень у наукових центрах є хорошим. Є ряд різних спеціалізацій, які призведуть до вивчення (і, сподіваюся, допоможуть заощадити!) океани, від морського біолога до інженера-еколога до «хімічного океанографа», який схожий на океанографа, але спеціалізується на хімічному складі океанів, а не на їх екології, біологічному житті та геології.
Приклади проблем
1. Плавикова кислота вступає в реакцію з карбонатом кальцію за наступним рівнянням:
\(2 \mathrm{HF}(a q)+\mathrm{CaCO}_3 \rightarrow \mathrm{H}_2 \mathrm{O}(l)+\mathrm{CO}_2(g)+\mathrm{CaF}_2\)
Якщо\(100 \mathrm{~mL}\) в\(10 \mathrm{mM}\) розчин\(\mathrm{HF}\) додається\(10 \mathrm{mM}\) розчин\(100 \mathrm{~mL}\) з\(\mathrm{CaCO}_3\), скільки\(\mathrm{CaF}_2\) випаде в осад? Припустимо, реакція йде до завершення.
- Відповідь
-
У цій задачі перша підказка полягає в тому, що реакція «йде до завершення»: це вказує на те, що нам не потрібно турбуватися про рівновагу. Коли\(10 m M\) розчин\(\mathrm{HF}\) додається в\(10 m M\) розчин\(\mathrm{CaCO}_3\), кінцевий розчин має різну концентрацію.
Оригінальні рішення кожен містить\(1 \mathrm{mmol}\) матеріал, так як\(0.1 L * 10 \mathrm{mmol} / L=1 \mathrm{mmol}\). Таким чином, кінцевий розчин має\(1 \mathrm{mmol} \mathrm{Hf}\) і\(1 \mathrm{mmol} \mathrm{CaCO}_3\) в\(0.2 \mathrm{~L}\) воді, тому концентрація кінцевого розчину знаходиться\(5 \mathrm{mM}\) в обох реагентах.
Далі нам потрібно подумати про те, скільки\(\mathrm{CaF}_2\) ми можемо сформувати: якщо ми почнемо з\(1 \mathrm{mmol}\) of\(\mathrm{HF}\) і 1 ммоль\(\mathrm{CaCO}_3\), можна перевірити, що граничний реагент є\(\mathrm{CaCO}_3\), так як нам потрібно в два рази більше, ніж\(\mathrm{CaCO}_3\) для формування\(\mathrm{CaF}_2\).\(\mathrm{HF}\) Ми закінчимо з\(0.5 \mathrm{mmol} \mathrm{CaF}_2\), і залишимо позаду\(0.5 \mathrm{mmol} \mathrm{CaCO}_3\).
Далі нам потрібно визначити, скільки розчиниться. Ми можемо використовувати стіл ICE та загальний іонний ефект. Ми починаємо\(0.5 \mathrm{mmol}\) з іонів кальцію в\(0.2 \mathrm{~L}=0.25 \mathrm{mM}\):
\ [\ почати {масив} {c|c|c}
&\ mathrm {CAF} _2 &\ mathrm {Ca} ^ {2+} & 2 F^ {-}\
\\ hline\ mathrm {I} & 2.5\ mathrm {mM} & 0\ mathrm {mM}
\\ hline\ mathrm {C} & + математика {x} & +2\ mathrm {x}\
\ рядок\ mathrm {E} & & 2.5+\ mathrm {x} & 2\ mathrm {x}
\ кінець {масив}\ номер\]\ почати {вирівняний}
5.3\ раз 10^ {-9} & =( .0025+x) (2 x) ^2\
x &= 0,000649
\ кінець {вирівняний}Тому\(0.649 \mathrm{mM}\) буде розчинний, залишивши\(2.5 \mathrm{mM}-0.649 \mathrm{mM}=1.85 \mathrm{mM} C a F_2\) випаде осад.
\[1.85 \mathrm{mmol} / L * 0.2 L=0.37 \mathrm{mmol} \nonumber\]
\[0.37 \mathrm{mmol} * 78.07 \mathrm{~g} / \mathrm{mol}=28.9 \mathrm{mgCaF} \mathrm{C}_2 \nonumber\]
Тому\(28.9 \mathrm{mg}\) з\(\mathrm{CaF}_2\) випаде в осад.
Лекція 30: Бронстед-Лоурі кислоти/Основи та нейтралізація
Резюме
У цій лекції ми почали з розгляду того, що станеться, якщо поєднати кислоту та основу безпосередньо: наприклад,\(\mathrm{NaOH}(\mathrm{aq})+\mathrm{HCl}(\mathrm{aq}) \rightarrow \mathrm{H} 2 \mathrm{O}(\mathrm{l})+\mathrm{NaCl}(\mathrm{s})\). Кожен з цих продуктів, вода і сіль, знаходять собі рівновагу. Так стрілка йде обома шляхами\(\mathrm{H}++\mathrm{OH}-\leftrightarrow \mathrm{H}_2 \mathrm{O}(\mathrm{l})\) і вода дає звичайні нейтральні концентрації іонів\(\mathrm{H}+\) і\(\mathrm{OH}-\). Сіль також матиме свою рівноважну реакцію на утворення іонів\(\mathrm{Na}+\) і\(\mathrm{Cl}-\) в розчині. Іноді\(\mathrm{Cl}-\) іони\(\mathrm{Na}+\) і називаються «глядачами», коли знаходяться в розчині, оскільки вони не беруть участі у виготовленні розчину ні кислого, ні основного. Реакція кислоти з основою, щоб зробити воду і сіль, називається реакцією нейтралізації.
Бронстед і Лоурі визначали кислоти та основи ширше: Бронстед-Лоурі кислота - це все, що вивільняє\(\mathrm{H}^{+}\) іони. Основа Бронстеда-Лоурі - це все, що приймає\(\mathrm{H}+\) іони. «Кон'югатна пара» - це хороший спосіб відстежувати перенесення протонів, що відбувається в хімії кислоти/основи. Якщо ми розглянемо загальну реакцію\(\mathrm{HA}+\mathrm{H}_2 \mathrm{O}\), де ми позначимо A для «кислоти» і цілеспрямовано\(\mathrm{H}\) пишемо окремо, оскільки ми знаємо, як кислота, вона буде\(\mathrm{H}\) віддавати це як\(\mathrm{H}^{+}\) іон, молекула залишила іншу кон'юговану пару після відмови\(\mathrm{H}+\) іона в розчин, \(\mathrm{A}-\), Називається її сполученою парою. Аналогічно, якщо він реагував з\(\mathrm{H}_2 \mathrm{O}\), то\(\mathrm{H}_2 \mathrm{O}\) отриманим\(\mathrm{H}+\) стати\(\mathrm{H}_3 \mathrm{O}^{+}\), і ці дві молекули є сполученими парами. За словами Бронстеда-Лоурі, реакція кислотної основи - це, по суті, просто реакція передачі протонів.
Загальним способом написання кислотного змішування з основою було б:\(\mathrm{HA}+\mathrm{B} \rightarrow \mathrm{BH}^{+}+\mathrm{A}^{-}\) де тут дуже зрозуміло, що кислота передає протон до основи.
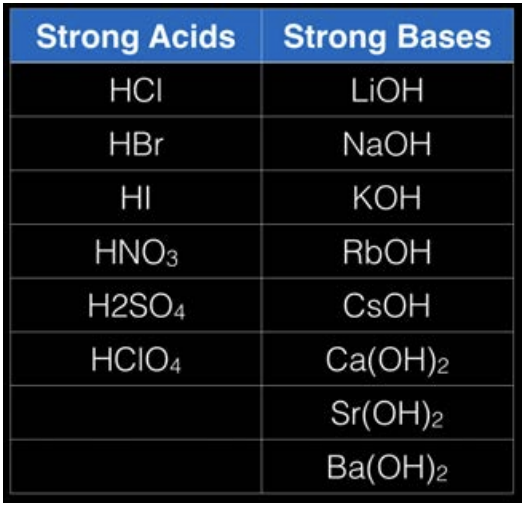
Як ми знаємо, чому і коли кислота або основа є «сильною» проти «слабкою?» У цій таблиці перераховані поширені міцні кислоти і основи. Кислоти, крім цих шести, по суті, всі слабкі кислоти. Єдиними поширеними міцними основами є гідроксиди лужних металів та важчі лужні землі (і\(\mathrm{Ba}\); будь-які інші основи\(\mathrm{Ca}, \mathrm{Sr}\), ймовірно, будуть слабкими. Ми можемо кількісно оцінити, чому ці молекули вважаються «сильними», розглядаючи їх константи дисоціації кислоти. Бо\(\mathrm{HCl}\), константа дисоціації кислоти, або іншими словами постійна рівноваги для кислоти,\(\mathrm{K}_a=\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\left[\mathrm{Cl}^{-}\right] /[\mathrm{HCl}]\)\(\approx 106\) - це величезна кількість, а значить ефективно повна дисоціація. Сильна кислота, як\(\mathrm{HCl}\) насправді сильна, тому що вона повністю дисоціює. І навпаки теж: якщо кислота повністю дисоціює, то це сильна кислота. Те ж саме стосується міцних підстав.
Наприклад, припустимо, що у вас є\(1.0 \mathrm{M}\) рішення\(\mathrm{CH}_3 \mathrm{COOH}\). Це означає, що\(\mathrm{CH}_3 \mathrm{COOH}\) в літрі води є 1 моль. Так як\(K_a=10^{-5}\), це означає, що\(\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\) для цього\(1 \mathrm{M}\) рішення є навколо\(0.003\), що в свою чергу означає,\(1 \mathrm{M} \mathrm{CH}_3 \mathrm{COOH}\) що про\(2.5\).\(\mathrm{pH}\) Зверніть увагу, що якщо є\(0.003\) родимки\(\left[\mathrm{H}_3 \mathrm{O}^{+}\right]\), що може від 1 моль\(\mathrm{CH}_3 \mathrm{COOH}\), то це означає, що тільки\(0.3 \%\) з нього розчиняється. Це не дуже багато розчинення в порівнянні з ближнім\(100 \%\) для сильних кислот!
Ось ще один приклад: чи буде сіль, утворена в результаті наступної реакції,\(\mathrm{pH}\) більше, ніж, менше або дорівнює\(7? \mathrm{CH}_3 \mathrm{COOH}(\mathrm{aq})+\mathrm{NaOH}(\mathrm{s}) \leftrightarrow \mathrm{Na}^{+}+\mathrm{CH}_3 \mathrm{COO}^{-}(\mathrm{aq})+\mathrm{H}_2 \mathrm{O}(\mathrm{l})\) Щоб відповісти на це, нам навіть не потрібно робити жодної математики. Це тому, що якщо слабка кислота змішується з сильною основою (як це відбувається тут), ми автоматично знаємо, що вона буде базовою.
Загалом, коли наступне змішані, результати такі:
- Слабка кислота, змішана зі слабкою основою: бо\(K_a>K_b ; \mathrm{pH}=7\) якщо\(\mathrm{pH}<7\)\(K_a=K_b ; \mathrm{pH}>7\) для\(K_a<K_b\)
- Сильна кислота, змішана з струнною основою:\(\mathrm{pH}=7\)
- Сильна кислота змішується зі слабкою основою:\(\mathrm{pH}<7\)
- Міцна основа, змішана зі слабкою кислотою:\(\mathrm{pH}>7\)
Чому це важливо
Це може відчувати себе трохи на гарячій стороні\(470^{\circ} \mathrm{C}\), і ви будете оточені сірчаною кислотою більшу частину часу. Ось як було б, якби ви жили на Венері. Ось гарна фотографія з російського космічного зонда в 1970-х роках, який приземлився на поверхню, показуючи, якою буде прогулянка там. Ці температури і кислі атмосфери можуть здатися божевільними, але багато матеріалів вимагають подібних умов для обробки. Багато аспектів нашої промислової революції ефективно спиралися на відтворення умов Венери! Фактично, сьогодні виробляється майже 250 мільйонів тонн сірчаної кислоти на рік, що робить її однією з найбільших хімічних речовин, що виробляються у всьому світі. Вивільнені\(\mathrm{H}+\) іони, які надходять з\(\mathrm{H} 2 \mathrm{SO} 4\), використовуються в широкому діапазоні галузей промисловості, від миючих засобів до свинцево-кислотних автомобільних акумуляторів до барвників до обробки металів, саме у виробництві добрив, де домінує його використання: приблизно\(50 \%\) з усіх сірчана кислота використовується для внесення добрив!
В одному з наших попередніх Why This Matters ми обговорювали процес Хабер-Боша, який використовує каталізатор, високі температури (наприклад\(\approx 400^{\circ} \mathrm{C}\)) і високий тиск (наприклад,\(\approx 180\) атм.) для фіксації\(\mathrm{N}_2\) молекул і перетворення їх в аміак\(\mathrm{NH}_3\). Але справа в тому, що тільки один з трьох найважливіших інгредієнтів рослинам потрібно рости: два інших фосфор і калій. Фосфор, зокрема, зазвичай виготовляється з величезною кількістю сірчаної кислоти. Чому це так? Ви вже знаєте відповідь, це хімія.
виявлені в осадових родовищах, що означає, що вони утворюються шляхом осадження багатих фосфатами матеріалів у морських середовищах. Ось фотографія формування фосфатних порід, що видобувається в штаті Юта. Але якщо взяти фосфатну породу і подрібнити її в порошок, він все одно не буде дуже розчинний у воді (тепер ми маємо деякі знання про те, що це означає!). Це означає, що якщо ви внесете мінерал безпосередньо в добриво, він не буде корисний рослинам. Це так само, як\(\mathrm{N}_2\) у випадку з повітрям: хоча їх багато\(\mathrm{N}_2\), рослини не мають можливості поглинути його. Швидше, з ними потрібно працювати,\(\mathrm{NH}_3\) щоб приймати азот. Те ж саме стосується фосфору: трикальцийфосфат\(\mathrm{Ca}_3\left(\mathrm{PO}_4\right)_2\), з якого в основному складається фосфатна порода, не здатний давати фосфор рослинам, оскільки недостатньо розчиняється у воді. \(\mathrm{K}_{s p}\)Для цієї іонної солі є колосально низьким\(2.07 \times 10^{-33}\)! До речі, це досить гарна річ, що це не дуже розчиняється, оскільки це ключовий інгредієнт кісток і зубів.
Ось куди надходить сірчана кислота: це досить простий спосіб звільнити фосфорну кислоту\(\mathrm{H}_3 \mathrm{PO}_4\) з фосфатної породи. Зокрема,\(\mathrm{H}_2 \mathrm{SO}_4\) з фосфатної породи. Зокрема, він\(\mathrm{H}_2 \mathrm{SO}_4\) віддає свій водень в обмін на кальцій з утворенням сульфату кальцію, наступним чином:
\(\mathrm{Ca}_3\left(\mathrm{PO}_4\right)_2+3 \mathrm{H}_2 \mathrm{SO}_4 \rightarrow 2 \mathrm{H}_3 \mathrm{PO}_4+3 \mathrm{CaSO}_4\)
Після того, як фосфорна кислота виробляється таким чином, її можна перетворити на різні види добрив, які зараз є водорозчинними, щоб рослини могли її поглинати. Зазвичай їх називають «фосфатами» або солями фосфорної кислоти, які в контексті добрив включають фосфати амонію, фосфати кальцію та фосфати натрію. Підсумок: ми годуємо світ завдяки нашим знанням кислотної/основи хімії!
Чому це працює
Кислоти і основи використовуються так багато в промисловості і в житті: неважко знайти роботу, в якій беруть участь кислоти і основи. Ви можете перевірити DuPont, наприклад, який продає рослини фосфатних добрив, які роблять саме те, що ми обговорювали вище (наприклад, див. http://cleantechnologies.dupont.com/ промисловості/фосфатні добрива/). http://cleantechnologies.dupont.com/...atefertilizer/. BASF була однією з перших компаній, яка виробляла та продавала сірчану кислоту у великих масштабах, і вони все ще роблять і мають багато робочих місць, пов'язаних з кислотною хімією. Існує Sigma Aldrich, яка є масовою компанією з 10 000 співробітників і майже\(\$ 3 \mathrm{~B}\) річним доходом: їх категорія «кислоти і основи» показує сотні продуктів (до речі, інша компанія, Merck, купила їх нещодавно\(\$ 17 \mathrm{~B})\). Або як щодо лабораторій Cabot, яка не робить кислоти та основи явно, але використовує їх для виготовлення кожного з прохолодних хімічних продуктів, які вони роблять, будь то еластомери або аерогелі або «передові вуглеці».
Ви можете взяти будь-яку з багатьох різних кислот, шукати його назву, і, ймовірно, знайти ринок для нього, а потім всі компанії, які або роблять його або використовують його, багато з яких будуть мати робочі місця, пов'язані з ним. Візьміть мурашину кислоту: вона отримує більший інтерес з різних галузей промисловості, тому що з нею легше обробляти, ніж інші кислоти (див., наприклад, цю статтю про це в C & EN (https://cen.acs.org/ articles/93/i48/Chemical-Makers-Eyes-Formic-Acid.html), і використовується в значній мірі в текстилі промисловість. BASF та Eastman Chemical великі на мурашину кислоту, але багато інших компаній цікавляться. Говорячи про текстиль, це ще одна галузь, яка використовує величезну кількість кислот, включаючи мурашину, а також лимонну, оцтову, соляну та азотну кислоту. Текстиль також сильно покладатися на основи, такі як гідроксид натрію та харчова сода для фарбування, очищення та вогнезахисного одягу, щоб назвати кілька застосувань. Все просто сказати, що кислоти та основи справді є основою промисловості, і знання, як їх зробити або як їх використовувати, призводить до величезних можливостей працевлаштування.
Приклади проблем
1. Визначте кон'югатні пари кислота/основа в наступних реакціях:
а)\(\mathrm{H}_2 \mathrm{PO}_4^{-}+\mathrm{H}_2 \mathrm{O} \leftrightarrow \mathrm{HPO}_4^{2-}+\mathrm{H}_3 \mathrm{O}^{+}\)
- Відповідь
-
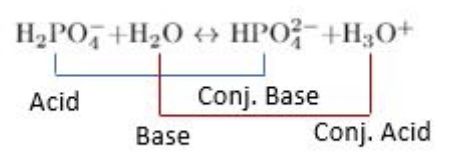
б)\(\mathrm{H}_2 \mathrm{O}+\mathrm{NH}_3 \leftrightarrow \mathrm{OH}^{-}+\mathrm{NH}_4^{+}\)
- Відповідь
-
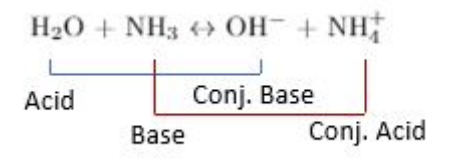
2. Розрахуйте\(K_a\)\(0.2 \mathrm{M}\) водний розчин пропіонової кислоти\(\left(\mathrm{CH}_3 \mathrm{CH}_2 \mathrm{CO}_2 \mathrm{H}\right)\) з рН\(4.88\). Дисоціація може виражатися у вигляді
\(\mathrm{CH}_3 \mathrm{CH}_2 \mathrm{CO}_2 \mathrm{H}+\mathrm{H}_2 \mathrm{O} \leftrightarrow \mathrm{H}_3 \mathrm{O}^{+}+\mathrm{CH}_3 \mathrm{CH}_2 \mathrm{CO}_2^{-}\)
- Відповідь
-
Цю проблему можна вирішити за допомогою столу ICE:
\ [\ begin {масив} {c|c|c}
&\ математика {CH} _3\ математика {CH} _2\ математика {CO} _2\ математика {H} &\ mathrm {H} _3\ mathrm {O} ^ {+} &\ математика {CH} _3\ математика {CH} _2\ математика m {CO} _2^ {-}\\\ рядок
\ математики {I} & 0.2 & 0 & 0\\\ hline
\ mathrm {C} & -\ mathrm {x} & +\ mathrm {x} & +\ mathrm {x}\\ hline
\ mathrm {E} & 0.2-\ mathrm {x} &\ mathrm {x} &\ mathrm {x}
\ кінець {масив}\ nonumber\]\ почати {зібраний}
-p H =\ журнал\ ліворуч [H_3 O^ {+}\ праворуч] =-4.88\
\ ліворуч [\ mathrm {H} _3\ mathrm {O} ^ {+}\ праворуч] =10^ {-4.88} =1,32\\ раз 10^ {-5} = x\\
k_a=\ frac {\ ліворуч [\\ mathrm {H} _3\ mathrm {O} ^ {+}\ праворуч]\ ліворуч [\ mathrm {CH} _3\ mathrm {CH} _2\ mathrm {CO} _2^ {-}\ праворуч]} {\ ліворуч [\ математика {CH} _3\ математика {CH} _2\ математика {CO} _2\ математика {H}\ право]} =\ frac {x^2} {0.2-x} =\ frac {\ ліворуч (1.32\ раз 10^ {-5}\ праворуч) ^2} {0.2-1.32\ раз 10^ {-5}} = 8.69\ раз 10^ {-10}
\ кінець {зібрано}
Подальше читання
Лекція 21: Закон Брегга та рентгенівська дифракція
• Більше закону Брегга:
• Як зробити XRD експеримент:
https://serc.carleton.edu/research_education/geochemsheets/ techniques/XRD.html
• Історія науки: Розалінда Франклін, рентгенівська дифракція та структура ДНК:
https: //дой-орг.станфорд.idm.oclc.org/10.1119/1.5020051
Лекція 22: Від рентгенівської дифракції до кристалічної структури
• Стан лауе (поза рамками 3.091):
http://www.physics.udel.edu/~yji/PHYS624/ Chapter3.pdf
• Приємні візуалізації:
http://web.pdx.edu/~pmoeck/phy381/Topic5a-XRD.pdf
Лекція 23: Точкові дефекти
• Дефекти Шотткі та Френкеля, а також деякі речі поза межами сфери застосування:
http://ww2.chemistry.gatech. edu/class/6182/wilkinson/nonstoi.pdf
• Як дефекти надають різним дорогоцінним каменям свій характерний вигляд:
https://www.tf.uni-kiel.de/ matwis/amat/iss/kap_6/advanced/t6_1_1.html
Лекція 24: Дефекти лінії та криві напруження-деформації
• Резюме дефектів:
https://chemed.chem.purdue.edu/genchem/topicreview/bp/materials/ defects3.html
• Анімація переміщення крайового вивиху:
https://www.tf.uni-kiel.de/matwis/amat/def_en/ kap_5/illustr/a5_1_1.html
• Відео про криві напруження-деформації:
Лекція 25: Аморфні матеріали: склоподібні тверді речовини
• Кристалічні проти аморфних твердих речовин:
• Запис для зображення найтоншого скла:
https://news.cornell.edu/stories/2013/09/shattering-records-thinnest-glass-guinness-book
Лекція 26: Властивості інженерного скла
• Всередині заводу Corning:
https://www.youtube.com/watch?v=gZPeyErbqz4
• 3D друк скла:
https://www.youtube.com/watch?v=IvcpbtpWpGY
Лекція 27: Швидкість реакції
• Резюме швидкостей реакції:
• Детальніше про каталітичні нейтралізатори:
Лекція 28: Рівновага і розчинність
• Практика розчинності продукту:
https://www.chem.purdue.edu/gchelp/howtosolveit/Equilibrium/ Solubility_Products.htm
• Спосіб отримання більшої кількості розчинних лікарських засобів:
Лекція 29: Загальні іони та кислоти/Основи
• Розроблений загальний приклад іонного ефекту:
• Відео по рН:
Лекція 30: Бронстед-Лоурі кислоти/Основи та нейтралізація
• Концепція Bronsted кислот і підстав:
• Кислоти і основи в кулінарії:
https://www.livestrong.com/article/431096-acids-bases-in-cooking/