5.1: ХІМ АТЛАС_1
- Page ID
- 27775
Що це таке?
Мета цього документа - служити керівництвом і ресурсом, який дає вам короткий огляд кожної лекції. Для кожної лекції є короткий виклад основних тем, які охоплюються, «Чому це важливо момент» та новий розділ «Чому це працює», а також кілька прикладів проблем. Ці роздаткові матеріали будуть надані «Unit», який є змістом, який входить до кожного іспиту. На початку кожного блоку також є концептуальна карта, щоб показати, як різні матеріали пов'язані між собою.
Так чому ми це зробили? Ми сподіваємося, що корисно отримати хороший знімок будь-якої прочитаної лекції. Незалежно від того, чи не змогли ви потрапити на лекцію чи не могли перестати думати про лекцію, це спосіб швидко зрозуміти зміст. Це також дає мені можливість надати додаткові деталі, на які я, можливо, не встигаю в прикладі Чому це має значення, а також дозволяє мені спробувати розділ Чому це працює, який я, звичайно, не встигну обговорити багато в лекції. Сподіваюся, ви знайдете його корисним, і, як і що-небудь інше в цьому класі, будь-який і всі відгуки є найбільш вітаються!
Один момент про ці конспекти лекцій. Зверніть увагу, що конспекти лекцій не призначені для заміни конспектів лекцій. Якби ви читали лише ці резюме і не ходили на лекції, так, ви б отримали гарне розуміння лекції з дуже високого рівня зору, але ні, ви не отримаєте достатньо з цього, щоб це було вашим єдиним ресурсом для вивчення матеріалу!
Як це з'єднується: блок 1, лекції 1-9
У цьому класі у нас є 36 лекцій, 20 декламацій, 9 мішків для гуді та 12 наборів проблем, всі вони тісно інтегровані, і кожен з них розроблений, щоб сприяти вашому загальному досвіду навчання 3.091. Ці різні ресурси об'єднуються в Святкування навчання протягом семестру, в тому числі 9 вікторини, 3 проміжні терміни, і підсумковий іспит. Для кожного блоку, визначеного як вміст, який переходить у проміжний термін, ми створили концептуальну карту, щоб з'ясувати зв'язки між різними компонентами класу, щоб ви могли чітко бачити контекст кожного з них.
Нижче наведено зображення іспит 1 Концептуальна карта. Це демонструє, як кожен з аспектів курсу поєднується: у вас є багато ресурсів! Проблеми практики, декламації, Goodie сумки, і лекції не оцінені ресурси, які допоможуть вам підготуватися до вікторини та іспитів. Всі матеріали, перераховані на цій концептуальній карті, є чесною грою для іспиту 1.
Лекція 1: Вступ та хімія таблиці Менделєєва
Резюме
«Ніколи не довіряйте атому, вони все складають», - це класичний жарт хімії, який також буває таким правдивим, але якщо ми хочемо знати, які елементи складають наші цікаві матеріали, тоді нам потрібно знати, як ці елементи взаємодіють один з одним, як вони структуровані та як матеріал оброблявся до домогтися такої структури. Щоб по-справжньому відповісти на ці питання, дослідники в останні кілька століть використовували науковий метод. Це включає задавання питань, збір та вивчення доказів, виявлення пояснень та повторне тестування.
Одним з найбільш хвилюючих питань в історії хімії було питання атома —Демокріт і Левкіпп гіпотезували неподільні будівельні блоки Всесвіту (хоча тепер ми знаємо, що атоми можуть бути розбиті на ще менші «субатомні частинки»). Роберт Бойл у своєму прагненні ідентифікувати різні атоми вивчав металеві руди (природні породи, що містять металеві домішки) і зумів відокремити велику кількість елементів, включаючи багато металів. У міру зростання списку виявлених атомів вчені також почали вивчати їх категоризацію. Наприклад, Антуан Лавуазьє назвав чотири категорії на основі властивостей для 33 елементів, які він визначив: гази, неметали, метали та землі. Джон Далтон визначив 36 різних елементів і розробив графічний символ для представлення кожного з них.
У цій лекції ми представили концепцію балансування хімічної реакції, яка передбачає додавання коефіцієнтів до реагентів та/або продуктів реакції для забезпечення рівних чисел кожного типу атома на лівій та правій стороні стрілки. Це необхідно через закон збереження маси, який говорить, що на атомному рівні нічого не створюється і не руйнується, тому маса реагентів дорівнює масі продуктів. Швидше, атоми можуть бути перебудовані, утворюючи різні молекули. Першою хімічною реакцією, яку ми збалансували, була реакція горіння, яка представляє собою реакцію, при якій вуглецевий матеріал згорає в присутності кисню. Ми знайшли граничний реагент для цієї реакції, який є реагуючим видом (атомом або молекулою), який використовується першим. Вихід реакції - це кількість утворився продукту.
Дальтон заявив, що атоми даного елемента мають особливу вагу і інші відмінні характеристики. Він запропонував закон кратних пропорцій, який говорить про те, що коли два елементи реагують на утворення ряду сполук, співвідношення мас 2-го елемента на грам до 1-го можуть бути виражені у вигляді співвідношень цілих чисел.
Чому це важливо
У цій першій лекції ми заговорили про відкриття елементів. Ну, я не хочу нічого віддавати, але в кінці кінців не буде все, що багато хто з них. Насправді, на сьогоднішній день ми маємо 118 в офіційному реєстрі, але якщо ми розглянемо, які з них ми можемо використовувати, щоб зробити речі для людей, це число нижче, більше, як 80 або 90. Як ви думаєте, скільки елементів є у вашому мобільному телефоні? Це залежить від телефону, але в моєму є 64 різних елемента!
Це більше двох третин усіх тих, які ми могли б навіть використати, і це неймовірно думати. Через цей величезний дизайнерський потенціал світ, в якому ми живемо, повністю змінився.
Як вчений з матеріалів, мені подобається, що у нас є ця традиція (кричати датському вченому Крістіану Дж. Томсену) називати вік, в якому ми живемо, матеріалом, який мав найбільше значення в цьому віці. Але, як науковець з матеріалів, мені також подобається, що ми більше ніколи не зможемо цього зробити. Причина в тому, що ми дійсно живемо в нову еру, в якій ми можемо реалізувати мрію Річарда Фейнмана, який у своїй знаменитій промові «Є багато місця внизу» висунув бачення атомного дизайну та нанотехнологій на 30 років попереду свого часу. Сьогодні ми регулярно контролюємо як вибір елементів, так і їх структуру, коли вони збираються разом, щоб зробити матеріали робити те, що ми ніколи не думали можливим навіть лише 10 років тому! Іншими словами, ми контролюємо їх хімію в атомному масштабі.

Зображення кам'яних стріл, бронзового горщика, промислового віку, пластикових пляшок, кремнієвого чіпа © джерела невідомі. Цей вміст виключається з нашої ліцензії Creative Commons. Для отримання інформації див. https://ocw.mit.edu/fairuse. Зображення атомного дизайну знаходиться у відкритому доступі.
Це доходить до того, чому це так круто (і, ви здогадалися, чому це важливо). Розумієте, багато наших сучасних глобальних викликів — будь то енергетика, охорона здоров'я чи навколишнє середовище — мають вузьке місце, яке виникає через матеріал, який становить центральну частину технології (в деяких пристроях це називається «активним шаром»). Це означає, що «просто» вибираючи або виготовляючи інший матеріал, можна повністю змінити властивості, вартість та технологічність технології. Це на відміну від попередньої революції навколо кремнію, де ми пішли від вартості $1 за транзистор у 1965 році до $0.00000001 за транзистор у 2015 році. Поговоріть про криву навчання! Це було пов'язано в першу чергу з досягненнями в обробці одного і того ж елемента, кремнію, щоб дістатися до менших і менших компонентів. Більше мільярда транзисторів тепер добре вписуються на одному чіпі. На відміну від цього драматичного віку кремнію, багато наступних технологічних революцій будуть покладатися на зміну самого матеріалу: в деяких випадках повністю. Зараз ми живемо в епоху дизайну матеріалів, яка настала якраз вчасно, оскільки вона поєднується з дуже нагальними викликами в глобальному масштабі, які будуть покладатися на нові матеріали, які будуть вирішені. І ось чому відкриття цих елементів так важливо. Вони є нашим майданчиком і основою, з якої ми зробимо наступний набір технологій, щоб змінити світ на краще.
Чому це працює
У цьому розділі ми обговоримо, як матеріал кожної лекції з'єднується з реальними робочими місцями. Я пробую це в цьому році вперше, і оскільки я, швидше за все, не встигну витратити на це в лекції, цей документ є єдиним місцем, де ви його знайдете. У «Чому це важливо» я пристрасно вірю, що кожна лекція може і повинна бути пов'язана з якимось масштабним викликом, інноваціями чи натхненням. У розділі Чому це працює, моя мета полягає в тому, щоб зв'язати кожну лекцію з можливою сферою зайнятості. Подібно до Why This Matters, це не повинно бути вичерпним, а досить ілюстративним, щоб дати вам інший спосіб, в якому матеріал, який ви вивчаєте, має цінність поза класом і з'єднується з чимось, в даному випадку роботою.
Ми провели половину цієї першої лекції, розповідаючи про структуру класу, не лише адміністративно (що оцінено, що ні тощо), але й педагогічно (різні компоненти, як вони об'єднуються, щоб забезпечити навчальний досвід тощо). Думати про те, як краще навчати, як учні вчаться, і як нові технології повинні або не повинні бути частиною цього, є надзвичайно багатою сферою зайнятості. Якщо ви зацікавлені в тому, щоб дізнатися більше, ознайомтеся з викладацькою та навчальною лабораторією MIT або деякими прохолодними ініціативами в галузі освіти, такими як eDx, NEET або програми «SuperEurop».
Ще одним напрямком зайнятості, пов'язаним з цією лекцією, є відкриття нових елементів. Тут ми розглянули, як перші хіміки намагалися ідентифікувати елементи. Це зводилося до розбиття, спалювання, кипіння, реагування тощо Виявляється, це все ще річ, тільки в сучасний час все це реагування відбувається з набагато більшими одиницями техніки і набагато більшими командами людей. Наступний елемент, який ще належить виявити (на момент написання статті, це означало б 119-й відомий елемент), швидше за все, не матиме дуже тривалого терміну служби, і його буде дуже важко зробити у великих кількостях. Але розсуваючи межі між тим, що ми знайшли природним шляхом, і тим, що ми можемо зробити синтетично, оскільки це стосується фундаментальних будівельних блоків Всесвіту. Ну, це досить захоплююча річ. І враховуючи прогнози деяких, що існує «острів стабільності» для більш важких елементів, які ще не зроблені, цілком можливо, що таких відкриттів чекає абсолютно нова ера хімії.
Останній приклад, який я наведу для працевлаштування, стосується ідеї металевих руд, про яку я згадував раніше в цій лекції. Пам'ятайте, що саме тут Далтон та багато інших відкривали для себе ці нові елементи. В основному, ви берете скелю і обережно розбиваєте її і альт, ви отримуєте Fe з неї (добре, це трохи складніше, ніж це, але це ідея). Виявляється, досить часто атом металу замкнений досить щільно у вигляді «оксиду» (так, це означає зв'язаний з киснем, але ми дійдемо до цього через кілька лекцій). Справа в тому, що видобуток металів, таких як алюміній, з гірських порід, вимагає величезної кількості енергії, а це означає, що для цього потрібно багато спалювання викопного палива. Що робити, якби ви могли придумати новий, набагато «зеленіший» спосіб отримання металів або мінералів в чистому вигляді з гірських порід, з яких вони походять? Це було б дуже великою справою. Видобуток металів та корисних копалин включає в себе масові команди інженерів, які охоплюють широкий спектр робочих місць від з'ясування, де видобувати, до характеристики вихідних матеріалів, до оптимізації хімії видобутку, до роботи над новими способами зробити це більш ефективно.
Приклади проблем
1. У цій лекції ви стали свідками моєї пристрасті до піротехніки.
а) Запишіть і збалансуйте хімічну реакцію для подібного процесу, згоряння пропану (\(\mathrm{C}_3 \mathrm{H}_8\)).
- Відповідь
-
\(\mathrm{C}_3 \mathrm{H}_8+5 \mathrm{O}_2 \rightarrow 3 \mathrm{CO}_2+4 \mathrm{H}_2 \mathrm{O}\)
б) Якщо у вас є\(500 \mathrm{g}\) пропан, скільки родимок у вас? Скільки молекул?
- Відповідь
-
Спочатку знайдіть молярну масу пропану.
\[3 * 12 \mathrm{~g} / \mathrm{mol}+8 * 1 \mathrm{~g} / \mathrm{mol}=44 \mathrm{~g} / \mathrm{mol} \nonumber\]
Використовуйте наведені грами та молярну масу для перетворення в родимки:
\[500 / 44=11.36 \mathrm{~mol} \nonumber\]
Лекція 2: Підрахунок атомів і організація елементів
Резюме
У цій главі ми ввели поняття крота. Це постійне число, яке також називають числом Авогадро, рівне\(6.0221409 \times 10^{23}\). Атомні одиниці маси (AMU), присвоєні елементу, рівні масі в грамах моля атомів цього елемента. Так само, як число Авогадро - це просто число,\(\mathrm{AMU}\) це просто маса, і\(1 \mathrm{AMU}\) дорівнює\(1.67377 \times 10^{-24}\) грамам. Так само, як і моль, AMU - це ще одна спеціальна одиниця, яку хіміки використовують для з'єднання дуже малого світу атомів з порівняно великим світом речей, з якими ми працюємо. Цей зв'язок між макро- і атомним світами означає, що, просто виміряючи масу речовини, ми можемо знати, скільки атомів цього матеріалу ми маємо.
У класі ми використовували приклад горіння свічки, інакше відомого як добре збалансована реакція\(\mathrm{C}_{25} \mathrm{H}_{52}+38 \mathrm{O}_2 \rightarrow 25 \mathrm{CO}_2+26 \mathrm{H}_2 \mathrm{O}\). Ми використали цей приклад, щоб підкреслити, як поняття моль дає нам зв'язок між атомним та макроскопічним світами, між грамами та атомами. Ми також використовували цей приклад, щоб знову підкреслити поняття обмеження реагенту та виходу.
Далі ми зосередилися на організації таблиці Менделєєва. На відміну від останнього розділу, тут організація означає більше, ніж придумати схему іменування або просту категоризацію елементів, як це вже зробили Далтон, Лавуазьє та багато інших. У цій лекції ми маємо на увазі під організацією дійсно розпізнавання образів. Вчені почали бачити закономірності, що виникають серед елементів, і чим більше елементів було виявлено, тим більше зусиль було докладено до розуміння цих закономірностей.
Дмитро Менделєєв розробив попередник сьогоднішньої таблиці Менделєєва. Його великим проривом було те, що він влаштовував відомі тоді (63) елементи не просто своєю масою, але і повторюваним (періодичним!) закономірності він спостерігав у своїх властивостях. Це призвело його до того, що він залишив прогалини в таблиці Менделєєва, які згодом будуть заповнені нововиявленими елементами. Через періодичність властивостей він навіть міг передбачити властивості багатьох ще невідкритих елементів. Рядки вашої періодичної таблиці називаються періодами, а стовпці називаються групами. Основними елементами групи є ті, що знаходяться в періодах два і три. Існує загальна тенденція від металевих до неметалевих елементів уздовж періодів. Елементи переходу знаходяться в групах 3-12 і періоди 4 і 5.
Чому це важливо
Населення людей на цій планеті спостерігало різке, експоненціальне зростання. Давайте збільшимо, де зростання дійсно почав штовхнути на високу передачу. Бачите цей підйом, приблизно на початку 1900-х років? Зверніть увагу на масову зміну нахилу. Ось тоді ми і розібралися, як зробити азот таким чином, яким можуть користуватися рослини.
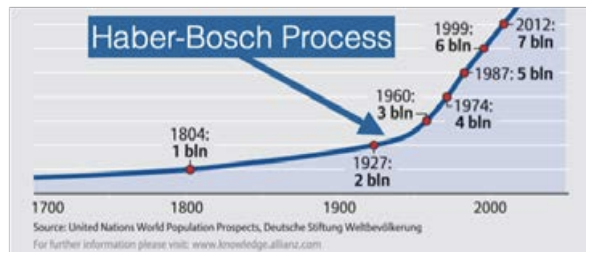
Люди проти часового сюжету © Бюро довідки населення. Всі права захищені. Цей вміст виключається з ліцензії Creative Commons. Для отримання інформації див. https://ocw.mit.edu/fairuse.
Іншими словами, з відкриттям, яке зараз відоме як процес Хабер-Бош (названий на честь німецьких хіміків Фріца Хабера та Карла Боша), світ зміг внести добрива в достатку, необхідному для годування мільярдів. Ключ зводиться до того, що називається «фіксуючим» азотом. Рослинам потрібен азот, щоб рости, але більшість рослин не можуть використовувати жодне з тих\(78 \% \mathrm{~N}_2\) рясних, що знаходиться в повітрі. Натомість їм це потрібно у формі, яка обслуговує окремі\(\mathrm{N}\) атоми, як аміак\(\left(\mathrm{NH}_3\right)\). ТАК як ми можемо перейти від\(\mathrm{N}_2\) до\(\mathrm{NH}_3\)? Легко, з наступною хімічною реакцією:
\(\mathrm{N}_2+\mathrm{H}_2 \rightarrow \mathrm{NH}_3\)
Ах, вибачте, давайте збалансуємо, що:
\(\mathrm{N}_2+3 \mathrm{H}_2 \rightarrow 2 \mathrm{NH}_3\)
Це краще. Насправді Haber та Bosch зробили розробку каталізатора та процесу, який дозволив провести цю реакцію набагато ефективніше, ніж раніше. Але каталіз стає трохи попереду себе. А поки давайте зосередимося на збалансованій реакції і порахуємо деякі атоми.
У 2019 році щорічно виробляється 500 мільйонів тонн азоту на добриво за технологією Haber-Bosch. Половина білка у всіх людей на цій планеті походить від азоту, який був зафіксований цим процесом! Ось моє запитання: як довго ми можемо продовжувати фіксувати азот таким чином? А оскільки реакція говорить нам, що нам потрібні обидва\(\mathrm{N}_2\) і\(\mathrm{H}_2\), який з них був би обмежуючим реагентом?
З усієї нашої дискусії до цих пір в цій лекції ми знаємо, що ми можемо використовувати періодичну таблицю, щоб визначити, що 1 моль\(\mathrm{NH}_3\) становить 17 грам. Просто для простоти, припустимо, що в майбутньому ми продовжуємо робити таку ж суму, яку ми робимо сьогодні, а саме 500 мільйонів тонн\(\mathrm{NH}_3\) на рік. Є приблизно мільйон грамів на тонну, тому 500 мільйонів тонн на рік\(500 \times 106 \times 106\) грамів на рік. Розділивши на 17 грам на моль, це означає, що нам потрібно зробити приблизно\(30 \times 10^{12}\) родимки\(\mathrm{NH}_3\) /рік. Враховуючи збалансовану реакцію вище, це означає, що нам знадобиться як вхід у\(15 \times 10^{12}\) реакційні родимки\(N_2\) на рік. Тепер маса атмосфери становить близько\(5.15 * 10^{21}\) грамів, з яких\(78 \%\) є\(\mathrm{N}_2\), так що робить близько\(4 \times 10^{21}\) грамів\(\mathrm{N}_2\) в повітрі. А так як атомна маса для атома азоту дорівнює 7, то це 14 для\(\mathrm{N}_2\) чого означає, що на моль припадає 14 грам\(\mathrm{N}_2\). Так кількість молів, наявних в атмосфері, становить\(\mathrm{N}_2 / 14\) грами\(4 \times 10^{21}\) грам\(/\)\(=3.5 \times 10^{20}\) моль родимок\(\mathrm{N}_2\) в атмосфері. Ну, це гарна новина! Беручи\(\mathrm{N}_2\) загальні\(3.5 \times 10^{20}\) родимки та розділивши їх на\(15 \times 10^{12}\) кроти,\(\mathrm{N}_2\) необхідні на рік, ми виявляємо, що ми могли б продовжувати процес фіксації азоту з атмосфери Хабер-Бош більше 20 мільйонів років або близько того, перш ніж використовувати все це.
Це просто круто. Подумайте про це: ми просто перейшли від атома до макроскопічного світу, і все це тому, що у нас є таке поняття крота. Але ми так і не відповідали на питання, а саме який з них є обмежуючим реагентом в реакції,\(\mathrm{N}_2\) або на\(\mathrm{H}_2\)? Тепер ми знаємо, як довго\(\mathrm{N}_2\) триватиме нас, якщо ми будемо використовувати все це в цій реакції, так що залишилося зробити те ж саме для\(\mathrm{H}_2\). Говорячи про які, куди ми взагалі дістанемося\(\mathrm{H}_2\)? Звичайно, не з повітря. Я дозволю вам усім працювати над цим, але ось підказка: океани містять багато води, як більше\(10^{18}\) тонни. Можливо, вам навіть не потрібно робити будь-які розрахунки, щоб розібратися в цьому!
Чому це працює
Як підрахунок або організація атомів призводить до роботи? Ну, з одного боку ми говоримо про порядок, точність і вимірювання. Адже успіх Менделєєва покладався на поєднання ретельного вимірювання властивостей з точним упорядкуванням. Цей навик потрібен для безлічі різних робіт. Одне місце з місією вимірювання - Національний інститут стандартів і технологій (NIST). Перевірте рядок тегів у своїй лабораторії вимірювання матеріалів: «MML служить національною довідковою лабораторією для вимірювань у хімічних, біологічних та матеріалознавчих науках. Діяльність варіюється від фундаментальних та прикладних досліджень до розробки та розповсюдження сертифікованих довідкових матеріалів та даних для забезпечення якості результатів вимірювань». І це лише одне з їх численних підрозділів.
Ще одна робота, яка спадає на думку, пов'язана з добривом, обговорюваним у нашому Чому це важливо. Три основні складові комерційних добрив, що використовуються у всьому світі, - це азот, фосфор та калій. Як ми знаємо, азот вимагає фіксації. Калій необхідно отримувати іншими способами. Наприклад, він добре поєднується з хлором як хлорид калію (\(\mathrm{KCl}\)), але ми вважаємо за краще не мати хлору в ґрунті, оскільки це може призвести до токсичності культур та високої кислотності та солоності в ґрунті. Однак отримання калію в інших формах коштує дорого і вимагає, як неважко здогадатися, хімії. Щоб ускладнити ситуацію, як природні джерела калію, так і конкретні потреби в ґрунті сильно залежать від географії. Для фермерів тропічних регіонів Бразилії та деяких країн Африки композиції ґрунту та гірських порід потребують добрив, які краще відповідають хімічним потребам рослин, ніж доступні в даний час. Як розчин додають більше добрив для досягнення такої ж врожайності, як аналоги на півночі, але багато основних інгредієнтів, особливо калій, виробляються в більш північних регіонах і тому набагато дорожчі в Південній півкулі. Необхідність місцевих, стійких рішень для підгодівлі для підвищення врожайності є нагальною! Але це починає звучати більше як друге видання Why This Matters і менш схоже на Чому це працює. Моя думка полягає в тому, що розробка добрив - це проблема хімії, і світ відчайдушно потребує нових рішень. Що стосується робочих місць, це може означати, що стає чимось називається «аналітичний хімік», що означає, що ви застосовуєте принципи хімії, щоб з'ясувати, з чого складається матеріал, які точні склади, як контролювати його, змінювати його тощо Це також може означати роботу в компанії або дослідницькій лабораторії, яка розробляє передові ідеї (як недавня робота з використання електрохімії для отримання калію).
Додаткова практика
1. Сонячні елементи іноді містять титанове (\(\mathrm{Ti}\)) покриття, яке зупиняє клітку від короткого замикання. Процес Кролла для виготовлення титанового металу з оксиду титану:
\(\mathrm{TiCl}_4+\mathrm{Mg} \rightarrow \mathrm{MgCl}_2+\mathrm{Ti}\)
а) Збалансувати реакцію.
- Відповідь
-
\[\mathrm{TiCl} _4+2 \mathrm{Mg}->2 \mathrm{MgCl}_2+\mathrm{Ti} \nonumber\]
б) Якщо у вас є\(50 \mathrm{~g}\) і те\(\mathrm{Mg}\),\(\mathrm{TiCl} 4\) і інше, що є граничним реагентом в реакції?
- Відповідь
-
Молярна маса Mg:\(24.3 \mathrm{~g} / \mathrm{mol}\)
Молярна маса\(\mathrm{TiCl}_4: 189.9 \mathrm{~g} / \mathrm{mol}\)Знайдіть родимки кожного реагенту\(50 \mathrm{~g}\) шляхом ділення на окремі молярні маси:
\[50 \mathrm{~g} / 24.3=2 \mathrm{~mol} \mathrm{Mg} \quad \quad 50 \mathrm{~g} / 189.9=0.3 \mathrm{~mol} \mathrm{TiCl}_4 \nonumber\]
Скористайтеся співвідношенням молів від збалансованої реакції,\(\left(1 \mathrm{~mol} \mathrm{TiCl}_4 / 2 \mathrm{~mol} \mathrm{Mg}\right)\) щоб побачити, скільки\(\mathrm{TiCl}_4\) можна витратити з наявною кількістю:\(\mathrm{Mg}\)
\[(2 \mathrm{~mol} \mathrm{Mg} \text { available }) /\left(2 \mathrm{~mol} \mathrm{Mg} / 1 \mathrm{~mol} \mathrm{TiCl}_4\right)=1 \mathrm{~mol} \mathrm{TiCl}_4 \nonumber\]
\(1 \mathrm{~mol} \mathrm{TiCl}_4\)буде вичерпано, якби ми мали нескінченний запас його з кількістю Mg, який ми маємо. \(\mathrm{TiCl}_4\)Ця кількість більше, ніж сума, яку ми насправді маємо в наявності, а це означає, що\(\mathrm{TiCl}_4\) закінчиться до того, як\(\mathrm{Mg} . \mathrm{TiCl}_4\) це, отже, обмежуючий реагент.
в) Який вихід реакції в грамах?
- Відповідь
-
Для розрахунку\(\mathrm{Ti}\) виходу реакції використовуємо співвідношення\(\mathrm{Ti}\) до\(\mathrm{TiCl}_4\) (оскільки ці два мають молярне співвідношення 1:1), а потім перетворюємо з молей в грами\(\mathrm{Ti}\):
\(0.3\)молі\(\mathrm{TiCl}_4\) використовуються (це обмежуючий реагент, тому він буде використовуватися в повному обсязі) і через молярне співвідношення 1:1 ми знаємо, що\(0.3\) молі\(\mathrm{Ti}\) будуть вироблятися. Помножте це число на молярну масу\(\mathrm{Ti}\):
\[0.3 * 47.9 \mathrm{~g} / \mathrm{mol}=14.37 \mathrm{g ~Ti} \nonumber\]
г) Побудувати вихід\(\mathrm{Ti}\) (g) як функцію збільшення\(\mathrm{Mg}\) доступного для реакції.
- Відповідь
-
Графік\(\mathrm{Ti}\) грам (на\(\mathrm{y}\) осі) проти\(\mathrm{Mg}\) грамів (на\(\mathrm{x}\) осі) починається з 0 і збільшується лінійно, поки\(\mathrm{Ti}\) грами не досягнуть\(14.37 \mathrm{~g}\), в цей момент ми закінчимося\(\mathrm{TiCl}_4\) і реакція припиниться.
Лекція 3: Відкриття електрона і будова атома
Резюме
Ця лекція розпочалася з обговорення новаторських експериментів, які наблизили наукове співтовариство до розуміння будови атома. До них входили експерименти Джей Джей Томсона з електронно-променевою трубкою (ЕПТ), які дозволили йому знайти відношення заряду до маси електронів, які, як він зрозумів, були негативно зарядженими частинками, виявленими у всіх атомах. Роберт Міллікан зміг встановити масу і заряд електрона за допомогою свого експерименту з падінням масла. Зрештою, атом не був найфундаментальнішою частинкою, скоріше він був зроблений з менших частинок, таких як електрони, і, як ми дізнаємося далі, ті менші речі, що складають атоми, мають структуру для них. Електронна структура.
Спираючись на радіаційні дослідження Марі і П'єра Кюрі, Ернест Резерфорд зміг визначити три типи частинок, виявлених в випромінюванні: альфа-частинки, які були великими і позитивно зарядженими, бета-частинки, які були малими і негативно зарядженими, і гамма-промені , який взагалі не відхиляв і не взаємодіяв з фотографічною пластиною в експерименті Резерфорда. Резерфорд тоді провів експеримент із золотою фольгою, який показав, що атоми мають позитивний заряд, який локалізується в ядрі атома, а не розсіюється серед негативного заряду, як запропонував Томсон. Цей позитивно заряджений центр атома називається ядром. Позитивно заряджені частинки в ядрі називаються протонами. Для будь-якого нейтрального атома кількість присутніх протонів має дорівнювати кількості присутніх електронів. Це число називається атомним номером елемента, який позначається буквою\(\mathrm{Z}\). За винятком випадку нейтрального атома водню, що складається лише з одного протона в ядрі та одного електрона, всі атоми також містять нейтрони у своїх ядрах, які, як можна випливати з назви, нейтрально заряджені частинки. Для отримання масового числа даного атома кількість протонів і нейтронів в цьому конкретному ядрі складаються разом. Атоми одного і того ж елемента можуть мати різну кількість нейтронів. Це робить їх різними ізотопами одного і того ж елемента. Щоб отримати масу, задану для кожного елемента у вашій періодичній таблиці, береться середньозважене значення масових чисел природних стабільних ізотопів цього елемента. Вага призначається відповідно до відсотка достатку ізотопів в природі.
Після експериментів Резерфорда залишилося питання про те, як атом, структурований таким чином, може бути стабільним. Нільс Бор був тим, хто постулював, що кутовий момент електронів в атомах повинен бути квантований, а це означає, що він приймає дискретні значення. Це означало, що енергія електрона та відстань від ядра також були квантовані - електрон може займати лише певні орбіти.
Чому це важливо
Відкриття електрона призвело до глибокого нового розуміння атома, що, в свою чергу, призвело до абсолютно нової теорії (квантової механіки), що, в свою чергу, призвело до орбіталей, склеювання і будівельних блоків для всієї сучасної хімії, як ми побачимо найближчим часом. Але відкриття електрона також призвело до нової здатності, яка зробила революцію в світі: здатності малювати електрикою. Люмінофорний екран, який знаходився на кінці електронно-променевої трубки Томсона, був попередником телебачення, і початком технологічної революції, яка змінила майже кожен аспект нашого життя. Телевізор не був винайдений самим Томсоном, але відкриття Томсоном цієї нової фундаментальної пензля - самого електрона - було вирішальним для того, щоб концепція злетіла. Подивіться, що тримає людина зліва на цьому зображенні: це рання версія телевізора, який тепер можна розпізнати як гігантську електронно-променеву трубку! Джон Лоджі Бейрд був одним з перших, хто комерціалізував телевізори, продавши свій перший в 1925 році. Ви можете побачити внутрішню частину раннього телевізора на середній картинці: зверніть увагу, що він складався з ЕПТ плюс котушки для індукування магнітного поля - по суті тієї ж установки, яку Томсон використовував у своїх новаторських експериментах.

Людина з ЕПТ та відкритими телевізійними зображеннями © джерела невідомі. Цей вміст виключається з нашої ліцензії Creative Commons. Для отримання інформації див. https://ocw.mit.edu/fairuse.
Якби електрони сканувалися на екрані люмінофора досить швидко, зображення можна було б намалювати стільки разів в секунду, що воно виглядало як рух людського ока. Це було легко зробити, тому що зміна магнітного поля швидко і точно (щоб розташувати електрони на екрані) можна досягти за допомогою простої електронної схеми. Протягом наступного покоління електрони стали домінуючим способом обміну візуальною інформацією. Хімія самого екрану також має важливе значення. «Екран» - це насправді люмінофорне покриття, яке часто наносилося на шматок скла і було мішенню електронного пучка. Люмінофор - це широкий термін для матеріалів, які випромінюють світло у відповідь на подразник. Цей акт випромінювання світла називається люмінесценцією. Це може збивати з пантелику, оскільки термін «фосфоресцентний» означає, що матеріал повільно випромінює світло з часом після стимуляції. Хорошим прикладом фосфоресцентного матеріалу можуть бути іграшки, що світяться в темряві, де подразник світлий, а люмінофор може світитися протягом багатьох годин. З іншого боку, «флуоресцентний» матеріал також випромінює світло у відповідь на подразник, але як швидкий спалах тривалістю наносекунд. Термін люмінофор може стосуватися будь-якого з них, але покриття на екрані ЕПТ і в тих ранніх телевізорах є флуоресцентним видом. Ви можете собі уявити, чому: якби воно не випромінювало світло швидко, зображення матиме післясвітіння, яке тривало годинами, що точно не створило б для приємного перегляду фільмів.
Щоб зробити питання ще більш заплутаним, термін люмінофор (який, як ми щойно встановили, може стосуватися матеріалів, які є фосфоресцентними або флуоресцентними матеріалами), не слід плутати з елементом фосфор. Фосфор також випромінює світло, але зовсім іншого характеру, оскільки його світіння відбувається від хімічної реакції (процес, який називається «хемілюмінесценція»). Отже, підсумовуючи: екран, про який ми говоримо, використовує люмінофор, який є флуоресцентним, а не фосфоресцирующим і не містить фосфору. Чудово.
Хімічно кажучи, що це за люмінофори? Існує так багато різних матеріалів, які є люмінофорами, що потрібно було б зовсім окрему книгу, щоб пройти їх усі. Вони можуть бути невеликими молекулами, складними твердими речовинами або рідинами. Вони можуть випромінювати світло у відповідь на безліч різних подразників, від світла до тепла до електричних полів до електронів, про які ми обговорюємо тут, у наших CRT. Перші телевізійні екрани були чорно-білими, тому метою було просто використовувати люмінофори, які світилися білим кольором, коли їх вражали електронами. Порошки, виготовлені з цинку, кадмію та сірки, а також мазок срібла були ранніми інгредієнтами. Для того щоб домогтися кольорового телевізора, потрібні були сині, зелені, червоні люмінофори. Електронний промінь може бути спрямований на будь-які з них, необхідні для отримання заданого кольору, знову ж таки використовуючи магнітне поле для направлення електронів з фантастичною точністю. Виявилося, що зелений і синій люмінофори були досить просто зробити, цинк-сульфід з відтінком міді для зеленого, а срібло для синього. Але червоний був іншою історією: для червоних люмінофорів знадобилися додаткові десятиліття досліджень, щоб знайти все, що працювало. Це причина, чому кольорове телебачення не вийшло на сцену до середини 1960-х років, повних 40 років після того, як було введено чорно-біле телебачення! Проблема червоного люмінофора була остаточно вирішена шляхом використання комплексної суміші ітрію, кисню, сірки та трохи європію для хорошої міри.
Оскільки ми перерахували ітрій, я повинен згадати, що це один з чотирьох - так чотири! — елементи, які були виявлені в одній печері в тому ж місті, Іттербі, Швеція. Ітрій, тербій, ербій та ітербій названі на честь цього міста. Ми все ще чекаємо камбріум або бостоніум.
Тепер тільки ваші батьки або бабусі і дідусі будуть пам'ятати, як виглядав перегляд телевізора на ЕПТ. Це тому, що телевізори сьогодні працюють за іншим принципом, а саме світлодіодами (світлодіодами). Але врешті-решт, це все-таки живопис електронами! Світлодіод випромінює світло, використовуючи каскад електронів від високої енергії до низької енергії в твердому матеріалі. Ми дізнаємося все про цей матеріал (його називають напівпровідником) і чому електрони можуть зробити світло таким чином трохи пізніше в семестрі. Світло, яке виходить із світлодіода у вашому телевізорі (або телефоні чи планшеті), все ще часто проходить через люмінофор, оскільки люмінофор можна використовувати для точної настройки кольору світла, який ми бачимо. У цьому випадку люмінофор стимулюється світлом замість електронів, але результат той же: світло і колір виробляються за допомогою електронів і хімії.
Чому це працює
Як ми можемо влаштуватися на роботу, засновану на відкритті електрона? Це ніби як запитати, як ми можемо отримати роботу, пов'язану зі знанням атомів - іншими словами, електрони та атоми складають все, щоб все могло кваліфікуватися, принаймні, якщо воно має якесь посилання на матерію в описі зайнятості. Але як щодо того, якщо ми повернемося, зокрема, до того першого пучка електронів, який Томпсон зробив, щоб виявити саме їх існування... які робочі місця можуть включати пучки електронів. Ми вже обговорювали живопис електронами в темі дисплеїв в Why This Matters, але виявляється, що з пучком електронів можна зробити набагато більше, ніж просто робити знімки. Однак, щоб зробити це, нам знадобиться більше енергії. Багато влади.
Якщо ви збільшите потужність цього електронного пучка достатньо, і ви тримаєте його у вакуумі (як це зробив Томпсон), щоб переконатися, що вони нічого не розсіюються, тоді ви можете використовувати електронний промінь для створення дуже локалізованого тепла, достатнього для розплавлення будь-якого матеріалу. Якщо це зроблено, щоб точно з'єднати два матеріали разом, ми називаємо це зварюванням. Електрони мають багато переваг при зварюванні, оскільки їх можна сфокусувати на дуже малих ділянках за допомогою магнітних полів, і потужність може бути набрана на все, що вимагає робота (і майже немає меж тому, наскільки потужним ви можете зробити пучок електронів). На вищому кінці, для промислового зварювання, електронні пучки можуть отримати до 10 000 000 Вт, на\(\mathrm{mm}^3\) які можуть нагрівати метал зі швидкістю 1 000 000 000 Кельвінів в секунду!
Електронно-променеве зварювання - велика галузь, і з нею пов'язано багато робочих місць. Ви могли б зварювати металеві деталі разом у GE для свого авіаційного бізнесу, і я згадую цю компанію спеціально тому, що це був Джеймс Рассел, який винайшов електронно-променеве зварювання, коли він був у GE, ще в 1950-х роках (як весела сторона примітки, він також винайшов перший компакт-диск). Якщо ви робите пошук електронно-променевого зварювання, ви знайдете величезну кількість лістингів для компаній, які надають його як послугу іншим компаніям. Наприклад, Bodycote заявляє, що вони є «провідним світовим постачальником термічної обробки та спеціалізованих послуг з термічної обробки», і з 5700 працівниками в 26 країнах вони мають багато робочих місць. Але є багато дрібніших операцій, які наймають людей, які люблять масово знімати електрони високої енергії на металеві деталі, як сімейний Roark в Браунсбурзі, штат Індіана, який може похвалитися однією з найбільших електронно-променевих зварювальних камер в США, або Precision Technologies, Inc., яка має прохолодне звучання 5- осьовий електронно-променевий зварювальник, який піднімається до 150 кВ, «здатний зварювати деталі розміром від декількох грамів до тих, що важать кілька тонн», або як щодо Fraunhofer FEP, який розробляє індивідуальні технології електронно-променевих та держав: «Використовуючи електрони ми покращуємо ваші матеріали та вироби!» Прохолодний.
Додаткова практика
1. Ваша подруга Чудо-жінка каже вам, що її браслети виготовлені з металу, Feminum (це законно, це було в «\(70 \mathrm{~s}\)телешоу»), знайдено лише на її рідному острові. Фемінум (символ Fm) має атомний номер 120 і атомну масу\(285.47\). Елемент має 2 ізотопи,\({ }^{285} \mathrm{Fm}\) і\({ }^X \mathrm{Fm}\). Природне достаток\({ }^{285} \mathrm{Fm}\) на острові є\(77 \%\).
а Що таке інший ізотоп, і яке його природне достаток?
б Скільки протонів і нейтронів має кожен ізотоп?
- Відповідь
-
\(77 \%\)велика кількість одного ізотопу передбачає 23 відсотків достатку іншого, оскільки ми знаємо, що ізотопів всього два. Атомна маса - це середньозважена з двох ізотопів. Розв'яжіть середньозважене рівняння для отримання відсутнього числа маси:
\[(0.77)(285)+(0.23)(x)=285.47 \quad \quad x=287.04, \text { rounds to } 287 \nonumber\]
2. Число над\(\mathrm{Li}\) символом на таблиці Менделєєва (праворуч) - це кількість протонів в ядрі літію. Яке число нижче символу? Як ви його розрахуєте?
- Відповідь
-
Число під атомним символом - атомна маса. Це не специфічно для атома - це середньозважене значення стабільних (нерадіоактивних) ізотопів елемента, з вагами, зазначеними відповідно до достатку ізотопів у природі.
Наприклад, атомна маса літію є\(6.94\), а два його стабільних ізотопи -\(7 (92.4\%\) достаток) і\(6(7.6 \%\) достаток)
3. Припускаючи, що всі протони (червоний) і нейтрони (синій) видимі, використовуйте належні позначення, щоб виписати атом, який відповідає кожному з наступних ядер:
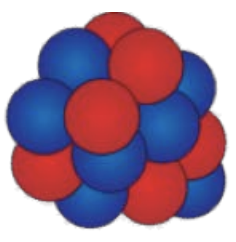
Зображення надано Фондом CK-12, Ліцензія: CC BY-NC.
- Відповідь
-
а) маса: 13, атомна: 6, атомний символ:\(\mathrm{C}\)
б) маса: 7, атомний: 3, атомний символ:\(\mathrm{Li}\)
Лекція 4: Модель Бора та електронні переходи
Резюме
Модель Бора - це основа, яка використовується для опису квантованого характеру атомів. Припускаючи, що електрони обертаються навколо атомних ядроподібних планет навколо Сонця Бора показали, що електрони, пов'язані з атомними ядрами, можуть існувати лише на дискретних енергетичних рівнях. Прирівнюючи силу привабливості взаємодії Кулона між негативно зарядженим електроном і позитивним ядром\(F_{C o u l o m b}=-Z e^2 / r^2\), і силу відштовхування внаслідок обертання\(F=m v^2 / r\), і підставляючи квантований кутовий імпульс\(L=m v r=n h / 2\), ми знаходимо формули для квантованого радіуса і квантованого енергія. Енергія електрона на n-му енергетичному рівні атома, який має\(\mathrm{Z}\) протони, дорівнює
\[E=-13.6 Z^2 / n^2 \quad[e V] \nonumber\]
Ціле число\(\mathrm{n}\), яке може мати будь-яке додатне значення\(\geq 1\), називається квантовим числом, оскільки воно робить його таким, що енергія може приймати лише певні, дискретні значення, на відміну від континууму можливостей. Держава\(n=1\) - це основний стан, а більш високі енергетичні рівні називаються збудженими станами. Коли електрон переходить зі стану з меншим квантовим числом до одиниці з більшим квантовим числом, енергія електрона стає менш негативною: він отримує енергію. Ми знаємо, що енергія повинна бути збережена, тому енергія, отримана при такому переході, повинна надходити звідкись. Насправді фотон з рівно\(\Delta \mathrm{E}\) між двома енергетичними станами в атомі може поглинатися, збуджуючи електрон. Аналогічно, якщо перехід відбувається в зворотному напрямку, надлишок\(\Delta \mathrm{E}\) може випромінюватися у вигляді фотона.
Види фотонів, здатних поглинатися або випромінюватися атомом або молекулою моделі Бора, можуть бути еквівалентно характеризуються їх енергією, частотою або довжиною хвилі. Ейнштейн навчив нас, що світло також можна квантувати в його роботі над фотоефектом: енергія фотона може приймати дискретні значення:
\[E=h f=h c / \lambda \nonumber\]
Де\(\mathrm{f}\) частота,\(\lambda\) це довжина хвилі,\(\mathrm{h}\) постійна\(\mathrm{c}\) Планка, швидкість світла, а друга рівність вірно тому, що\(\mathrm{c}=\mathrm{f} \lambda\). Довжина хвилі світла, яка може взаємодіяти з певним енергетичним переходом, можна знайти, прирівнявши два вирази вище. Маючи це на увазі, ми бачимо, що світло може використовуватися для зондування того, що електронні переходи відбуваються в атомі або молекулі, і, отже, які рівні енергії присутні в матеріалі. Модель Бора відповідає спектральним лініям зірок, що спостерігалися раніше астрономами; зокрема, дискретні довжини хвиль, випромінювані газом водню, які спостерігалися спектрометром, нарешті, мали пояснення.
Є кілька обмежень у моделі Бора. Тепер ми знаємо, що електрони насправді не обертаються навколо ядра (хоча їх кутовий момент квантований, як передбачалося). Далі модель Бора може використовуватися тільки для опису електронних переходів з одним електроном, наприклад\(\mathrm{H}_{\mathrm{He}} \mathrm{He}^{+}\), або\(\mathrm{Li}^{2+}\). Однак ключові висновки: якщо відомі енергетичні стани в атомі або молекулі, довжини хвиль світла, які можуть випромінюватися або поглинатися матеріалом, також визначаються. Так само, якщо спостерігаються дискретні довжини хвиль, що випромінюються або поглинаються атомом або молекулою, відомі також рівні енергії, доступні електрону.
Чому це важливо
Як відбувається поглинання фотонів електронами, які переходять з одного енергетичного рівня на інший? Одне застосування, до якого підключений цей принцип, - це холодильник (!) Спочатку це може здатися не очевидним, але давайте розберемося, чому. Погляньте на середню енергію, яку використовує холодильник у США протягом 55-річного періоду. Цікаво відзначити, що середні розміри холодильника стабільно зростали протягом 35 років, а потім плато в 1980-х роках.
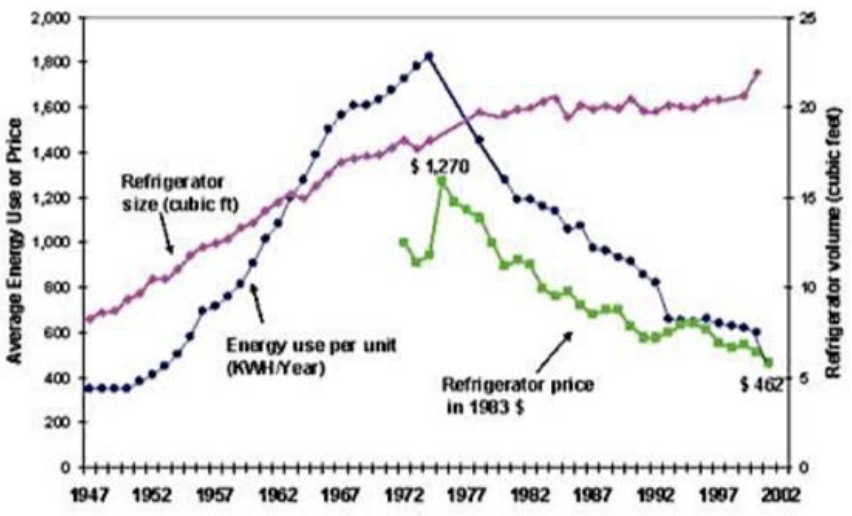
Середнє споживання енергії проти часу © джерело невідомо.
Виявляється, це було не тому, що люди не хотіли більше холодильника, а тому, що вони не могли вмістити нічого більшого через кухонні двері. Більш того, зверніть увагу, що споживання енергії на одиницю збільшилося разом з розміром протягом 30 років, поки раптом воно не почало швидко зменшуватися в 1970-х роках, хоча розмір продовжував зростати. Це тому, що за цей час також був дефіцит нафти, і люди почали турбуватися про використання енергії. Деякі з цих людей мали важливі титули, такі як президент Сполучених Штатів (Ніксон, Форд та Картер), і через них сталося багато законодавства, спрямованого на енергозбереження. Наприклад, президент Форд підписав перший закон на цю тему в 1975 році - Закон про енергетичну політику та збереження, який призвів до встановлення стандартів економії палива для автомобілів та стандартів ефективності для приладів. Після цього було підписано більше законів, які створили стимули для зниження споживання енергії (до мети зробити США енергетично незалежною державою 1985), при цьому Картер представив план конгресу, заявивши, що «збереження є найшвидшим, найдешевшим, найбільш практичним джерелом енергії», що вимагає федерального агентств з розробки планів енергозбереження та створення Міністерства енергетики (DOE).
У цьому Чому це важливо, я хочу підкреслити важливість державної політики. Саме вступ уряду призвело до технологічних інновацій, які призвели до більшої ефективності та зниження витрат. У 1992 році була введена програма Energy Star, яка призвела до ще більшого зниження енергоспоживання приладів і критично підвищила обізнаність споживачів. Мало того, що самі холодильники стали дешевшими через це нововведення, але і енергія, яку вони використовували, продовжувала зменшуватися. У 2019 році в США ми економимо близько 20 мільярдів доларів щорічно на споживанні енергії лише для наших холодильників порівняно з 1970-х років. на жаль, з 2017 року адміністрація Трампа намагається ліквідувати програму Energy Star, яку багато хто вважає однією з найуспішніших добровільних енергоефективності програм у світі. Це заощадило американцям 430 мільярдів доларів витрат на енергію на сотнях приладів, не кажучи вже про зниження викидів CO2, що призвело до.
Тепер ми все ще не підключилися до нашого уроку хімії, і хоча я міг би зробити це лише для економії енергії, є ще один приклад із рішенням щодо політики, пов'язаного з холодильником, що дуже чітко повертає Бора до столу. Це Монреальський протокол, який був підписаний у 1987 році і став першим договором, ратифікованим усіма країнами світу. Вона представляла собою універсальну угоду про захист стратосферного озонового шару шляхом поетапного припинення виробництва та споживання озоноруйнівних хімічних речовин, таких як хлорфторуглероди (ХФУ). Вжиття цієї дії призвело до відновлення земного озонового шару, який захищає життя від шкідливого УФ-випромінювання. Мільйони життів були врятовані в результаті. Але що це про CFC, що змушує їх руйнувати озон? І чому озон так важливий для блокування УФ-випромінювання? Відповідь, звичайно, виходить з хімії.
Озон - це молекула, що складається з трьох атомів кисню\(O_3\), а загальна молекула ХФУ складається з атома вуглецю, трьох атомів хлору та атома фтору\(\mathrm{CCl}_3 \mathrm{~F}\). Іноді молекула CFC руйнується і віддає один зі своїх\(\mathrm{Cl}\) атомів, ось так:
\[\mathrm{CCl}_3 \mathrm{~F}(\mathrm{~g}) \rightarrow \mathrm{CCl}_2 \mathrm{~F}(\mathrm{~g})+\mathrm{Cl}(\mathrm{g}) \nonumber\]
Зверніть увагу, що індекси «(g)» включені, щоб показати, що все це відбувається в газовій фазі. Після того, як атом хлору звільниться, він може реагувати з озоном, як це:
\[\mathrm{O}_3(g)+\mathrm{Cl}(g) \rightarrow \mathrm{ClO}(g)+\mathrm{O}_2(g) \nonumber\]
І тому кожна молекула CFC може руйнувати одну молекулу озону. Але на цьому це не зупиняється. Відбувається третя реакція, так як в стратосфері також є атоми кисню. Коли атом кисню взаємодіє з\(\mathrm{ClO}\) молекулою, він реагує з нею, щоб зробити\(O_2\), ось так:
\[\mathrm{ClO}(g)+\mathrm{O}(g) \rightarrow \mathrm{Cl}(g)+\mathrm{O}_2(g) \nonumber\]
І в цьому полягає справжня проблема: атом Cl тепер знову вільний і готовий атакувати іншу молекулу озону. Через цей каталітичний цикл одна єдина молекула ХФУ може призвести до руйнування 100 000 молекул озону!
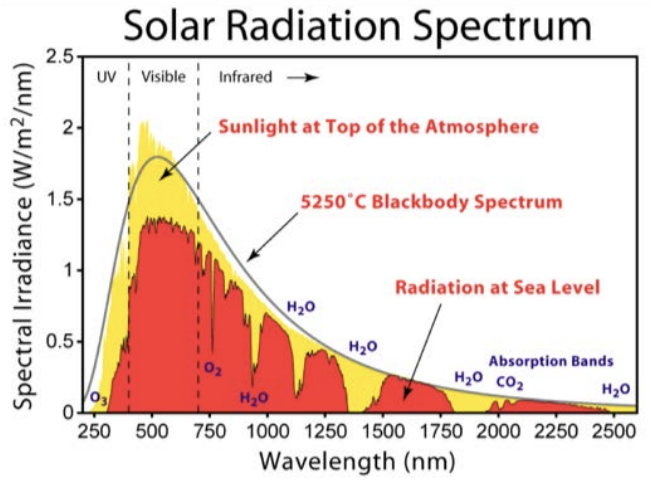
Спектр сонячного випромінювання Роберта Роде в рамках проекту «Мистецтво глобального потепління». Ліцензія: CC BY-SA. Джерело: Вікісховище.
Це підводить нас до другого питання зверху: чому втрата озону призводить до більшого УФ-випромінювання? Ось тут і вступають електронні переходи. Ознайомтеся з сюжетом на цій цифрі сонячного спектра. Вісь x - це довжина хвилі світла, що надходить від сонця, що охоплює лише УФ, видимий та інфрачервоний (так що це просто тріска повного спектру ЕМ, який ми показали кілька сторінок назад). Вісь Y - це інтенсивність світла на заданій довжині хвилі, у Ваттах на площу. Ватт - це міра потужності, яка є енергією за час, або Джоулів/с Простими словами, це сюжет, що показує силу сонячного світла як функцію його кольору.
Перше, на що слід вказати на сюжеті, - це суцільна чорна крива, яка відповідає теоретичному прогнозу випромінювання чорного тіла, що випромінюється об'єктом при температурі сонця. Ця температура сильно варіюється в залежності від того, де на сонці вона вимірюється, але біля поверхні,\(\mathrm{T}=5250^{\circ} \mathrm{C}\) є пристойним наближенням. Зауважте, що це приємний безперервний спектр, і він має форму, характерну для випромінювання чорного тіла (пам'ятайте, саме таке випромінювання ми згадували раніше - такий, який Планк представив концепцію квантування, щоб пояснити).
Далі є жовті затінені частини, які відповідають фактичній вимірюваній потужності сонця, перш ніж вона взаємодіє з нашою атмосферою. Він досить добре випливає за випромінюванням чорного тіла, що підтверджує прогноз. А потім, є червона затінена область. Це потужність від сонця, виміряна на землі, тому єдина відмінність між червоним і жовтим полягає в тому, що червоний - це вимірювання фотонів від сонця, які пройшли через атмосферу. Це випливає з жовтого досить добре в цілому, за винятком того, що зараз є прогалини в спектрі: дискретні довжини хвиль, де немає світла, що спостерігається на землі взагалі! Сюжет показує причину, чому: поруч з деякими з більших проміжків є молекула. \(\mathrm{H}_2 \mathrm{O}\)перераховується в декількох плямах. Один розрив приписується,\(\mathrm{O}_2\) а інший до\(\mathrm{CO}_2\), і один з цих прогалин обумовлений нашою приємною, доброзичливою, що більше не руйнується молекулою озону,\(\mathrm{O}_3\). Це розрив на всьому шляху в лівій частині сюжету, і саме там, де ультрафіолетове світло сяяло б на нас. Ми бачимо, що він дійсно світить на нас поза атмосферою (жовтий), але не на поверхні землі (червоний).
Ця крихітна тріска відсутності ультрафіолетового світла через\(O_3\) молекулу абсолютно необхідна для життя на землі, як ми її знаємо, і все це завдяки електронам, що перекачуються енергією з одного стану в інший. У цьому випадку це відбувається в молекулі, а не в атомі, але застосовується той самий принцип, який ми дізналися в цій лекції для електронних переходів за моделлю Бора. Існують дискретні енергетичні стани, де електрони дозволено перебувати в\(\mathrm{O}_3\) молекулі, і переходи між цими енергетичними рівнями можуть відбуватися, коли електрон або поглинає, або випромінює фотон. Так само, як і модель Бора для атома водню, дискретна природа електронних переходів в молекулах означає, що поглинання світла відбувається тільки в окремих точках спектра. Для озону просто трапляється різниця в енергії між двома електронними станами, які мають енергію УФ-фотона, саме тому ця конкретна молекула добре поглинається в УФ.
Чому це працює
Я думав про згадку робочих місць в спектральній астрономії, оскільки модель Бора пояснювала спостереження спектральних ліній з водню та інших світлових елементів у космосі. Той самий тип аналізу, використовуючи в основному лише (набагато) вигадливішу версію спектроскопа, який ви отримали у вашій сумці Goodie, використовується сьогодні, щоб зрозуміти речі, які складають далекі зірки, туманності, галактики, квазари, всілякі інші міжгалактичні питання, включаючи чи мають екзопланети земну зв'язок атмосферну композиції.
Але замість того, щоб спуститися по космічному маршруту, я хотів би зрозуміти тут те, що я зробив у «Чому це має значення», щодо того, як вирішення проблеми руйнування озонового шару є прекрасним прикладом того, наскільки важливою може бути наукова політика для покращення світу. Які можливості працевлаштування існують за такими напрямками? «Наукова політика» - це широкий термін, який може застосовуватися до широкого спектру робочих місць та видів діяльності, від вирішення того, як фінансується наука, до того, як вона може (або не може) бути переведена на комерційні продукти, до того, як наука впливає на здоров'я людини для захисту здоров'я навколишнього середовища. Робочі місця, які виникають у цьому напрямку, часто передбачають зв'язок з політикою та Вашингтоном (якщо в США), але вони не обов'язково повинні. Один із способів взяти участь - це стипендії, де студенти можуть спілкуватися з політиками в DC протягом літа або семестру.
У цих напрямках існує ряд варіантів, таких як дипломатія AAAS (ознайомтеся з https://www.aaas.org/programs/scienc...cy-fellowships), або стипендії в Інституті науково-технічної політики, або Офісі Білого дому з питань науково-технічної політики (OSTP). І тоді, крім таких загальних, є багато спеціалізованих стипендій в науковій політиці, які йдуть на підполе, як Американський геофізичний союз наукової стипендії Конгресу, або різні морські гранти NOAA для політики, пов'язаної з океаном, або стипендія John Bahcall Public Policy Fellowship для астрономії. І багато іншого.
Окрім стипендій, там є тонни робочих місць, як у центрах наукової політики, аналітичних центрах чи інших організаціях, від Союзу зацікавлених вчених, до корпорації RAND, до ЮНЕСКО, Федерації американських вчених, до Центру науки в інтересах суспільства, до університету. такі центри, як консорціум штату Арізона для наукової політики та результатів. Це лише дуже мало прикладів — їх набагато більше. Ви можете взяти участь безпосередньо з науковими фінансуючими агентствами, такими як NSF, DOE або NIH (якщо ви станете менеджером програми в будь-якому з них, будь ласка, зателефонуйте мені). Наукова політика є неймовірно важливою частиною того, що таке наука, якою вона може стати і як її можна використовувати найбільш ефективно, розумно і на благо світу.
Додаткова практика
1. Яка енергія пов'язана з наземним станом в іоні літію?
- Відповідь
-
\[E_n=-R_y \dfrac{Z^2}{n^2}=-13.6 \dfrac{3^2}{1^2}=-122.4 \mathrm{eV} \nonumber\]
2. Якщо світлова хвиля має таку ж величину енергії, як літієвий наземний стан, яка частота та довжина хвилі цього світла?
- Відповідь
-
\ почати {зібраний}
E=h\ nu=\ dfrac {h c} {\ лямбда}\\
122.4 [\ mathrm {eV}] =\ dfrac {\ ліворуч (4.14 х 10^ {-15} [\ mathrm {-15}]\ mathrm {s}]\ праворуч)\ ліворуч (3\ раз 10^8 [\ mathrm {~ m}/\ mathrm {s}]\ право)} {(\ лямбда [\ mathrm {m}])}
\\ лямбда = 9.9\ раз 10^ {-7} [\ mathrm {~m}]
\ кінець {зібраний}
Лекція 5: Двіальність хвилевих частинок та квантова механіка
Резюме
У цій главі ми продовжили наше обговорення іонізації. Ми обмежили наші приклади іонізацією атомів водню, щоб використовувати модель атома Бора. Електрон в основному стані, або найнижчий енергетичний стан атома водню має енергію\(-13.6 \mathrm{eV}\). Тому енергія іонізації цього електрона, або енергія, необхідна для звільнення його від ядерної тяги і ефективного переходу його на енергетичний рівень\(\mathrm{n}=\infty\), є\(13.6 \mathrm{eV}\). Енергію іонізації електрона в атомі з атомним номером\(\mathrm{Z}\) можна знайти за такою формулою:
\[\left.\Delta E_{\text {ionization }}=-13.6 Z^2 \quad \dfrac{1}{n_f^2}-\dfrac{1}{n_i^2}\right)(e V] \nonumber\]
Енергію іонізації можна думати з точки зору фотоефекту Ейнштейна. У своєму новаторському експерименті Ейнштейн сяяв світло (потоки фотонів) різних енергій на плити металу. Фотони повинні були досягти мінімальної порогової енергії, щоб іонізувати атоми металу. Має сенс, що метали з вищими першими енергіями іонізації зможуть краще триматися за свої електрони. Іншими словами, світло з більш високою частотою буде необхідно для іонізації металів з більш високими першими енергіями іонізації. Фотоелектронна спектроскопія (PES) - це метод характеристики, який включає іонізуючі матеріали з фотонами та вимірювання кінетичних енергій віддалених електронів. Енергію зв'язаного стану кожного видаленого електрона можна обчислити, знаходячи різницю між енергією вхідного фотона і результуючою кінетичною енергією звільненого електрона.
Модель Бора не могла пояснити квантування електронних рівнів; вони були нав'язані в моделі, але не зрозумілі. За допомогою серії експериментів на початку 20 століття була продемонстрована подвійність хвиль частинок. Це означало, що світлові хвилі поводяться як частинки, а частинки поводяться як хвилі. Найвідомішим з цих експериментів став експеримент з подвійнимсвітлом, де було показано, що електрони діють як хвилі, так і частинки. Луї де Брольє показав, що вся матерія діє як хвиля і має відповідну довжину хвилі\((\lambda)\). Цю довжину хвилі можна знайти за допомогою відношення де Броля, де\(\mathrm{p}\) імпульс об'єкта, який дорівнює його масі, що перевищує його швидкість, і\(\mathrm{h}\) є постійною Планка:
\[\lambda=\dfrac{h}{p} \nonumber\]
Ервін Шредінгер з Рівнянням Шредінгера описав зв'язок між просторовим розподілом хвилеподібної частинки та її дозволеними енергіями. У рівнянні Шредінгера квантування є природним наслідком розв'язання стоячої хвилі. Ця хвильова функція\(\psi\) не має прямого фізичного значення, принаймні, про яке ми знаємо, але її квадрат\(|\psi|^2\) відповідає ймовірності знаходження частинки в будь-якому заданому місці. Розв'язування рівняння Шредінгера для електрона в атомі дає набір хвильових функцій, які відповідають енергетичним рівням електрона та просторовим розподілам ймовірностей. Зверніть увагу на кардинальну відмінність від картини Бора: тепер електрон може бути де завгодно, є ненульовий\(|\psi|^2\), який є майже скрізь. Поняття точного положення не застосовується в квантовому світі, оскільки частинки не можуть точно задати своє положення та імпульс, відповідно до Принципу невизначеності Гейзенберга.
Чому це важливо
Давайте застосуємо рівняння довжини хвилі де Броля до електрона. Ми знаємо, що маса електрона є\(9 \times 10^{-31} \mathrm{~kg}\). Тепер помістіть електрон в електричне поле, викликане напругою\(100 \mathrm{~V}\). Ми знаємо, що це призведе до того, що електрон прискорюється і набере певний імпульс. Зокрема, енергія електрона становить: заряд* напруга\(=\mathrm{e}^* \mathrm{~V}=100\) вольт\(* 1.6 \times 10^{-19}\)\(=1.6 \times 10^{-17}\) Кулонів-джоулів. Це пояснюється тим, що одиниця вольт дорівнює одиницям\(\mathrm{J} / \mathrm{C}\). Отже, ми маємо енергію електрона, прискорену поперек\(100 \mathrm{~V}\), і з цього ми можемо отримати його швидкість\(v 6 \times 10^6 \mathrm{~m} / \mathrm{s}\). Далі ми можемо отримати його довжину хвилі:\(\lambda=h / m v=6.6 \times 10^{-34} J^* s /\left(9 \times 10^{-31} \mathrm{~kg} * 6 \times 10^6 \mathrm{~m} / \mathrm{s}\right)\), яка, коли ми усвідомлюємо одиниці\(J=[\mathrm{kg}]\left[\mathrm{m}^2\right] /\left[\mathrm{s}^2\right]\) ми бачимо, дає нам\(\lambda=1.2 \times 10^{-10} \mathrm{~m}=0.12 \mathrm{~nm}\) цей електрон.
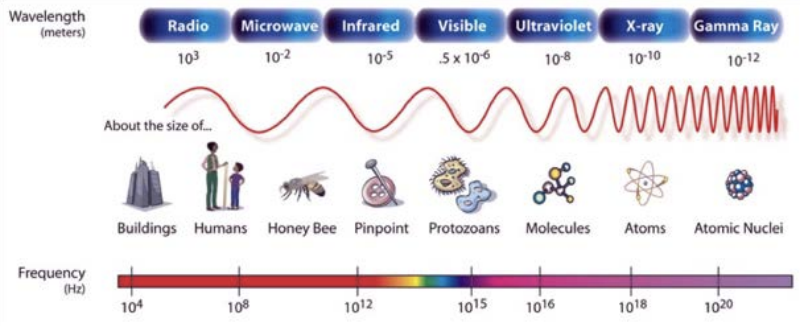
Ця цифра знаходиться у відкритому доступі (створена NASA).
Пам'ятайте електромагнітний спектр з останньої глави? Це світло, що охоплює порядки довжини хвилі, тільки тріска якої лежить у видимому діапазоні (400-750 нм). Але для того, щоб використовувати це світло, щоб побачити речі, ми повинні використовувати довжину хвилі світла, яка дорівнює або менша за розміром до того, що ми намагаємося побачити. В іншому випадку світло просто не забере його (ви можете перевірити фізику дифракції для отримання додаткової інформації про це, але поки ви можете повірити моє слово на це). Кореляція між межею того, що ми можемо бачити, і довжиною хвилі світла, яку ми використовуємо, щоб побачити це, тому мені подобається ця інша картина електромагнітного спектра. На нього накладаються приклади об'єктів розміром заданої довжини хвилі. Якщо ми хочемо використовувати тип світла, щоб побачити, скажімо, людину, то нам потрібно залишитися на довжині хвиль 1 м або нижче, оскільки люди мають розмір близько 1 м. Це не означає, що ми можемо бачити в мікрохвильовій області, але це лише обмеження наших очей не того, що можливо з типом світла. З кращими очима, ніж наші, ми могли б використовувати мікрохвильові печі, щоб бачити людей, але ми, наприклад, не зможемо використовувати радіохвилі, оскільки вони мають довшу довжину хвилі, ніж те, що ми намагаємося побачити.
Тепер перейдемо до атомної шкали: на рентгенівській частині спектра нам потрібно використовувати рентгенівські або гамма-промені, щоб побачити об'єкти такого масштабу. Але виявляється, що наші очі не тільки можуть не бачити в цій частині спектру, але навіть пристрої та детектори, які ми створили, не можуть бачити все так добре. Ми можемо робити рентгенівські промені і робити це постійно, але лише для того, щоб побачити зображення з роздільною здатністю мм на відміну від нм. Для останнього нам потрібно побачити рентгенівський знімок, що відбивається від об'єкта розміром нм, і бути в змозі виміряти його з точністю, чого ми не в змозі зробити. Тим не менш, ми використовуємо рентгенівські промені для отримання інформації в атомному масштабі, але це зовсім інша річ разом, і це пов'язано з інтервалом між атомами в твердих тілах. Ми дізнаємося все про це пізніше в семестрі. Але тут ми все ще намагаємося насправді «побачити» об'єкт і об'єкт є атомом. Ми не можемо використовувати рентгенівські промені, навіть якщо вони знаходяться на потрібній довжині хвилі - і забути про гамма-промені, тому що їх ще важче виявити. Але що ще ми могли б використовувати?
Ось чому ми зробили розрахунок довжини хвилі електронів, щоб розпочати цей розділ Why This Matters - використовуючи той факт, що електрон - це хвиля, і надаючи їй правильну швидкість, ми можемо зробити електрон точно такою довжиною хвилі, яку потрібно бачити в атомному масштабі. Електрони можуть бути нашим «ліхтариком»! Також виявляється, що їх набагато простіше захопити та використовувати для побудови зображень, ніж рентгенівські промені. Це відкриття розпочало ціле поле електронної мікроскопії і змінило те, як ми бачимо матерію. Саме Дон Ейглер та Ерхард Швейцер показали у 1989 році, що, побачивши окремі\(\mathrm{Xe}\) атоми, вони можуть організувати 35 з них, щоб написати логотип своєї компанії. Це, безумовно, дорогий спосіб написати логотип, але справа в тому, що досягнення реалізувало мрію Річарда Фейнмана про те, щоб мати можливість поставити атом куди завгодно.
Говорячи про Фейнмана, він був неймовірним вченим і майстерним учителем. Якщо ви хочете побачити дивовижну лекцію, повністю присвячену експерименту з подвійною щілиною, знайдіть і подивіться промову Фейнмана 1959 року «Є багато місця внизу», і ви не пошкодуєте про це. Тут він виклав мрію поставити атоми куди завгодно, і це було справді перше бачення поля, яке ми зараз називаємо нанотехнологіями. Причина, по якій знадобилося 30 років, щоб здійснити мрію Фейнмана, полягає в тому, що ми працювали в темряві, буквально. Якщо ви не можете бачити атоми і молекули, важко контролювати їх або принаймні знати, що те, що ви зробили, призвело до управління атомним масштабом, який ви хотіли. Цей тип управління призвів до революції нанотехнологій, і він був повністю дозволений здатністю вчених бачити матеріали в нм масштабі, що, як ви тепер знаєте, стало можливим завдяки хвильовій природі електрона.
Чому це працює
Це правда, що ми ставимо людину на людину, не вдаючись до квантової механіки, що свідчить про те, наскільки потужним і корисним є класичний погляд на світ. Але для того, щоб по-справжньому зрозуміти світ, від атома до океанів і гір до всесвіту до самого життя, квантова природа всього цього повинна бути зрозуміла і в деяких випадках квантові ефекти повністю домінують. Електрони і їх взаємодія зі світлом потрапляють в цю категорію: без квантового опису немає надії пояснити взаємодії, що відбуваються. Отже, давайте поговоримо про робочі місця, пов'язані з лазерами.
Стимульоване випромінювання (вперше розглянуте в роботі Ейнштейна в 1917 році) передбачає взаємодію між фотоном і атомом, який має електрони в збудженому стані. Якщо фотон має тільки потрібну довжину хвилі при попаданні на збуджений атом, то атом випромінює другий фотон, ідентичний першому. LASER - це «Посилення світла стимульованим випромінюванням випромінювання», і це цілком і лише описано квантовою механікою, оскільки вона спирається на знання дискретних енергій рівнів електронів в атомі. І до речі, кожен раз, коли ви перебуваєте в мережі, ви використовуєте лазер, оскільки саме так інформація проходить через волоконно-оптичні кабелі.
Є так багато оголошень про роботу для «лазерний інженер», що це не було б можливо навіть почати список (один сайт, який я щойно перевірив, має 7000+ лістинг!). Причина в тому, що лазери використовуються сьогодні в кожній сфері життя. Є робочі місця з лазерами в медицині, як в хірургії ока, в промисловості, де лазери вирізати і зварювати, для відстеження систем для всіх видів додатків, для дослідження в нових видах спектроскопії, так багато іншого. Отже, якщо ви хочете роботу, яка використовує подвійність хвиль частинок для створення когерентного світла, то це дивовижний перший крок, але наступним кроком буде отримати більш конкретний.
Візьмемо LIDAR як приклад: це означає виявлення світла та діапазон, який є методом дистанційного зондування, який використовує лазерні імпульси для вимірювання відстаней. LIDAR повністю революціонізував здатність роботів, таких як самохідні автомобілі, наприклад, бачити. Це всередині цих громіздких коробок на вершині самохідного автомобіля, який безперервно крутиться, даючи 360 градусів видимості, а також надзвичайно точну інформацію про глибину (до\(+/-2 \mathrm{~cm}\)). Це все ще\(\$ 75 \mathrm{~K}\) дорого (поп для автомобільних систем!) , але через те, наскільки можливим є LIDAR, і наскільки зростатиме попит на цю технологію, існує багато можливостей для робочих місць. Вони варіюються від робочих місць у великих компаніях гравців, таких як Velodyne, яка вже продає системи на багатьох ринках, до менших компаній, які намагаються впровадити технології, такі як Luminar, яка обіцяє систему\(\$ 500\) LIDAR розміром з газовану банку. Існує цілий діапазон між ними, включаючи самі автомобільні компанії, такі як Waymo, які вирішили побудувати власні системи LIDAR. І це був лише один крихітний приклад величезної кількості лазерних можливостей працевлаштування.
Приклад проблем
1. Ви спостерігаєте, як електрони водню переходять від\(\mathrm{n}=3\) до\(\mathrm{n}=1\).
а) Що таке зміна енергії в цьому переході? Це поглинання або емісія?
- Відповідь
-
Електрон падає в більш низький енергетичний стан з вищого енергетичного стану, тому він повинен бути емісією.
\[\Delta E=-13.6 Z^2\left(\frac{1}{3^2}-\frac{1}{1^2}\right)=-12.09 \mathrm{eV} \nonumber\]
Ми можемо двічі перевірити свою інтуїцію: оскільки знайдена нами енергетична цінність негативна, перехід повинен відповідати викиду.
б) Якого кольору світла ви спостерігаєте?
- Відповідь
-
\[\lambda=\frac{h c}{10.2[e V]}=1.22 \times 10^{-7} \mathrm{~m}=102.6 \mathrm{~nm} \nonumber\]
Цей перехід знаходиться в УФ.
в) Скільки можливих переходів може впасти електрон від\(=3\) до\(n=1\) повного? Який перехід відповідає за помаранчевий колір?
- Відповідь
-
Можливі два шляхи: прямо від\(n=3\) до\(n=1\) або\(n=3\)\(n=2+n=2\) до\(n=1\).
Далі обчислимо довжину хвилі трьох можливих випромінювань фотонів. Ми вже знаємо, що від\(\mathrm{n}=3\) до\(\mathrm{n}=1\), довжина хвилі випромінюваного фотона була\(102.6 \mathrm{~nm}\).
Від\(\mathrm{n}=2\) до\(\mathrm{n}=1\):
\ begin {вирівняний}
&\ Дельта Е = -13.6 Z ^ 2\ лівий (\ frac {1} {2 ^ 2}} -\ frac {1} {1 ^ 2}\ праворуч) =-10.2\ mathrm {eV}\\
\\\ lambda=\ frac {h c} {10.2\ mathrm {eV}} =1,22\ раз 10^ {-7}\ max thrm {~m} =122\ матрм {~нм}
\ кінець {вирівняний}Цей перехід є і в УФ.
Від\(\mathrm{n}=3\) до\(\mathrm{n}=2\):
\ begin {вирівняний}
&\ Дельта Е = -13.6 Z ^ 2\ ліворуч (\ frac {1} {3^2} -\ frac {1} {2 ^ 2}\ праворуч) =-1,89\ mathrm {eV}\\
\\\ lambda=\ frac {h c} {1.89\ mathrm {eV}} =6,57\ раз 10^ {-7}\ max thrm {~m} =657\ матрм {~нм}
\ кінець {вирівняний}Цей перехід відповідає помаранчевому світлу.
2. Червоний лазер, зелений лазер і синій лазер блищать на різних шматочках одного виду металу, і детектори налаштовані для вимірювання присутності випромінюваних електронів. Для червоного лазера електрони не виявляються. Для зеленого лазера і синього лазера електрони спостерігаються відлітають з металу. Яке з наведених нижче тверджень має бути правдою?
i) Кількість електронів, що випромінюються з металу за допомогою синього лазера, найбільше
ii) Кінетична енергія електронів, що випромінюються з металу за допомогою синього лазера, є найвищою
iii) Червоний лазер призведе до електронного випромінювання, якщо інтенсивність лазера була збільшена
- Відповідь
-
ii) вірно, тому що синє світло має більш високу енергію, ніж зелене і червоне світло, а енергія випромінюваних електронів пропорційна енергії фотонів, що потрапляють на поверхню металу
i) і iii) невірні, оскільки кількість електронів пов'язане з кількістю фотонів = інтенсивність світла, а інтенсивність світла не впливає на енергію випромінюваних електронів.
Лекція 6: Атомні орбітальні та квантові числа
Резюме
Одне з головних обмежень моделі Бора полягає в тому, що вона може описувати атом лише одним електроном. Щоб знайти властивості множинних електронів в атомі, необхідно вирішити рівняння Шредінгера,\((K+V) \psi=E \psi\) де кінетична енергія,\(\mathrm{K}\)\(\mathrm{V}\) є потенційною енергією\((-1 / r\) для електрона в атомі),\(\mathrm{E}\) є сумарною величиною енергії, і\(\psi\) є хвильова функція, або орбітальна електрона. Розв'язок рівняння Шредінгера для електрона в атомі водню має три окремі складові:\(\psi=R(r) P(\theta) F(\psi)\). Повна форма форми рішення має три великі наслідки:
1. Електрони насправді не обертаються навколо атомів, принаймні в тому сенсі, що планети обертаються навколо Сонця. Розв'язок рівняння Шредінгера дає хвильову функцію, яка при квадраті дає вираз\(|\psi|^2=1\) для розподілу ймовірності розташування електрона по відношенню до ядра. Крім того, хоча кожен електрон має певний радіус, який, швидше за все, буде знайдений, є також ймовірність того, що він знаходиться набагато ближче до ядра або набагато далі від нього. Наприклад, у той час як Бора моделюють електрони з\(n=1\) живою точністю\(0.529 \AA\) від ядра, хвильова функція для реального електрона в атомі водню має професійну ймовірність, що досягла максимуму\(0.529 \AA\) і розмазується по обидва боки цього значення. Зі збільшенням принципового квантового числа кількість вузлів - заборонених областей - збільшується, даючи чіткі смуги навколо атома, де ймовірно, буде електрон.
2. Чотири квантових числа необхідні для повного опису конкретного рішення. Принцип квантового числа, в першу чергу\(n\) відповідає за енергетичний рівень електрона. Так само, як і в моделі Бора,\(n\) може приймати будь-яке ціле значення від 1 до нескінченності. Коли\(n\) стає більшим, загальна енергія стає менш негативною (більшою). Електрон еквівалентно називають перебуванням на\(n^{t h}\) енергетичному рівні та\(n^{t h}\) оболонці; решта квантових чисел описують підоболонки. Квантове число моменту моменту\(l\), в першу чергу відповідає за форму орбіти. Значення, які\(l\) можуть приймати, залежать від того, в якій оболонці знаходиться електрон: діапазон йде від 0 до\((n-1)\). Магнітне квантове число\(m_l\), відповідає за орієнтацію орбіти в просторі. Його значення залежать від обох\(n\) і\(l\), а діапазон\(m_l\) переходить від\((-l)\) до\((l)\). Нарешті, спінове квантове число,\(m_s\) може мати одне з двох значень:\(+1 / 2\) або\(-1 / 2\), яке еквівалентно називається вгору або вниз.
3. Електрони, які вирішують рівняння Шредінгера, відрізняються від електронів Бора. Хоча в моделі Бора є лише один електрон на оболонку, рівняння Шредінгера дає вироджені розв'язки: зі\(\mathrm{n}\) збільшенням з'являється все більше і більше орбітальних рівнів. Далі модель Бора дає фіксований дозволений радіус для життя електрона, в той час як рівняння Шредінгера дає розподіл ймовірності того, що електрон знаходиться на заданій відстані від центру (і деяких заборонених зон!). Нарешті, хоча модель Бора могла описувати лише поведінку одноелектронних атомів, рівняння Шредінгера набагато ширше: воно може описувати електронну структуру атома з будь-якою кількістю електронів.
Ми також обговорили, як значення для\(l\) квантового числа отримують літерні імена\(\mathrm{s}, \mathrm{p}, \mathrm{d}\), і\(\mathrm{f}\) відповідні відповідно.\(l=0,1,2,3\) Якщо ми говоримо, що електрон знаходиться на\(2 s\) орбіті, то ми знаємо, що він відповідає квантовим\(n=2, l=0, m_l=0\) числам, і спін може бути вгору або вниз. Були розглянуті інші приклади множин квантових чисел та відповідних орбіталів, і ці водневі орбіталі були показані як будівельні блоки хімії. Це тому, що для опису атома та його властивостей ми заповнюємо ці орбіталі від найнижчої енергії до кількості електронів\(\mathrm{Z}\) в атомі. Це заняття слідує загальній тенденції, яка є темою наступної лекції, але в цій ми висвітлили дуже важливе правило: Принцип виключення Паулі. Це правило стверджує, що жодні два електрони не можуть мати однаковий набір квантових чисел, а це означає, що два електрони і тільки два електрони можуть займати будь-яку задану орбіталь.
Чому це важливо
Квантова дивавість - одна з найважливіших причин, чому нанотехнології останнім часом приділяють стільки уваги. Зараз за останні два десятиліття було досить багато преси про нанотехнології, але одна з моїх улюблених статей давно з'явилася в телеграфі Великобританії: «Як супер-корови та нанотехнології зроблять морозиво здоровим». Я завжди пам'ятаю цей шматок через те, як вони визначають нанотехнології: вони описують компанію як «експерименти з нанотехнологіями, або наукою про невидимо крихітні речі». Гадаю, мені подобається ця цитата через те, наскільки вона смішна, оскільки, перш за все, існує багато різних сфер науки та техніки, пов'язаних з крихітними речами, які ми не можемо побачити (нанотехнології - одна з них, але як щодо ядерної фізики з її кварками та глюонами, або сонячного вітру з його гарячими частинками плазми? які досягають нашої землі лише для того, щоб відхилитися магнітним полем нашої планети, або темною речовиною?). По-друге, мені подобається ця цитата, тому що вона просвітлює - хоча і неправильно - на одному затримці в розвитку нанотехнологій, який не міг спостерігати за тим, що відбувається. Це змінилося, коли ми могли використовувати електрони як спосіб освітлення матерії, як обговорювалося в останньому розділі «Чому це має значення».
Головне в тому, що нанотехнології мають великі перспективи. Не стільки з причин, які дали йому славу на початку 2000-х років (здорове морозиво було найменше, ми повинні були мати космічний ліфт зараз!) , а скоріше через хімію, яка «під капотом» нанотехнологій. Що взагалі означає nanotech, і чому ми маємо для нього ціле ім'я? Давайте відповімо на це прикладом, безпосередньо пов'язаним з сьогоднішньою лекцією.
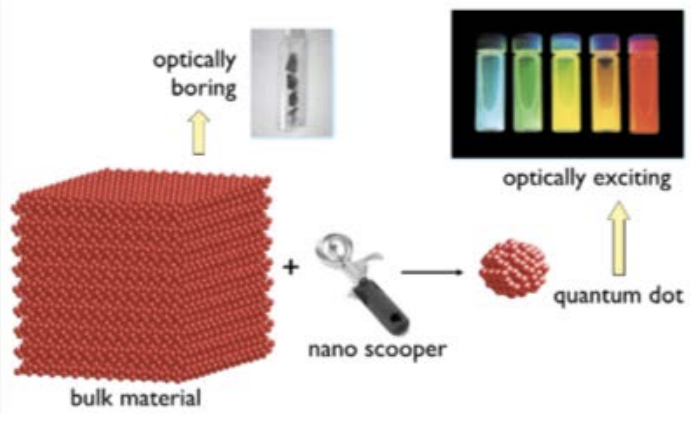
Зображення об'ємних напівпровідників, совок для морозива, квантова точка © джерела невідомі.
Ми говорили про орбіталі електронів в атомах і про те, як орбіталь є хмарою ймовірностей для електрона. Ну що, якщо ми візьмемо цю хмару і стиснемо її? Або іншими словами, обмежте його так, щоб він не міг займати той самий обсяг, як це зазвичай. Для цього є назва: квантове ув'язнення. І коли ми обмежуємо квантові речі, як у цьому випадку електрон в атомі, з'являються нові властивості. Візьмемо для прикладу колір. Для шматка сипучого матеріалу, де «навалом» тут просто означає, що він не нанорозмірний, я міг би мати щось, що оптично нудно. Це просто шматок сірого матеріалу. Але потім я виймаю свій нано-морозиво-совок і роблю маленький шматочок матеріалу. Раптом, не змінюючи нічого, крім розміру, я можу налаштувати колір майже все, що я хочу!
Те, що зміна розмірів цього матеріалу дозволяє налаштовувати дане властивість, досить неймовірно. Уявіть, якби я взяв одну з цих смужок металу з вашої першої сумки Goodie і розбив її на дві частини: ви б не очікували, що колір металу зміниться. Але якби ви могли зламати лише крихітний шматочок його, як той, у якому всього 10-20 атомів, то цей шматок змінить колір. Наскільки це дивно? Це тому, що ця електронна хмара закінчується з нерухомості, коли кількість речовини досить мала. Коли він нанорозмірний, обмежена хмара ймовірності змінює енергію електрона, що, в свою чергу, змінює колір матеріалу. Ми говорили про те, що електрони змінюють свої енергетичні рівні в атомах як спосіб поглинання або випромінювання фотона, відповідного цьому енергетичному зсуву. Ну ось у нас є новий спосіб змінити початковий і кінцевий рівні самі, просто змінивши розмір матеріалу. Ось приклад того, чому нано - це така велика справа.
Уміння контролювати властивості матеріалу - одна з основ нашої сучасної епохи. Як ми вже дізналися, розуміння періодичної таблиці елементів і всіх відмінностей між поведінкою цих елементів дало вченим і інженерам знання про основні інгредієнти, які використовуються для побудови нашого світу. Перехід нано - це ніби як додавання зовсім іншого виміру до періодичної таблиці: це як кожен елемент тепер може робити нові речі, приймати нові властивості та використовуватися в нових додатках.
Чому це працює
Квантові обчислення останнім часом привернули багато уваги, і не дарма. За останнє десятиліття ми досягли точки, коли квантові біти, або кубіти, можуть бути зроблені і контрольовані експериментально. Комп'ютери, якими ми користуємося сьогодні, маніпулюють інформацією у вигляді окремих бітів, які є відомими 1 і нулями останніх 50+ років. Але в квантовому комп'ютері квантові механічні явища, про які ми дізналися в цьому розділі, використовуються для маніпулювання інформацією.
Це кубіти, які тримають ключ, оскільки вони є зберігачами квантових станів, які мають квантові числа так само, як електронні стани в атомі. Коли два кубіти взаємодіють один з одним, ми отримуємо набагато більше, ніж просто 1 і 0, замість цього ми отримуємо всі можливі суперпозиції. Це як можливість використовувати хмару ймовірностей як обчислювальну хмару, де всі можливі відповіді обчислюються одночасно.
Квантові обчислення стають набагато більшими та набагато цікавішими, багато компаній прогнозують комерційні квантові комп'ютери до 2025 року. Ідея «Чому це використовує» для цієї лекції, полягає в тому, щоб взяти ті квантові стани, які ми щойно обговорили, і запустити з ними., аж до лабораторії штучного інтелекту Google, або до команди IBM Q, або до D-Wave, або до людей Intel, які працюють над своїми мікросхемами Qubit, або до будь-якої з 63 компаній, які зараз перераховані у Вікіпедії в розділі «Компанії по всьому світу, що займаються розробкою квантових обчислень». Список, який стрімко зростає. І це навіть не включає дослідження на цю тему в лабораторії тут, в MIT:)
Приклад проблем
1. Запишіть квантові числа для кожного електрона в нейтральному атомі вуглецю.
- Відповідь
-
Примітка: знаки спина вибираються довільно, тому було б так само правильно перевернути їх усіх. Для
\ (\ begin {масив} {c|c|c}
\ mathrm {n} &\ mathrm {l} &\ mathrm {m} &
\ mathrm {m} _s\\\ hline\ hline
1 & 0 & 0\\
1 & 0 & 0 & 0 & 0 & 0 & 0 & 0
підсилювач; 0 & -1/2\\
2 & 1 & -1 & 1/2\
2 & 1 & 0 & 1/2
\ кінець {масив}\)\(2 \mathrm{p}\)електрони, вони повинні мати однаковий спін завдяки правилу Гунда.
Лекція 7: Заповнення Періодичної таблиці та нашої першої зв'язку (вона іонна)
Резюме
Принцип Ауфбау - це інструмент, який використовується для запам'ятовування (типового) порядку, в якому підоболонки заповнюються багатоелектронним атомом. Електронні взаємодії ускладнюють, які підоболонки заповнені першими: екранування і орбітальне проникнення впливають на те, яке поєднання енергії електронів\(n\) і форми (квантових чисел і\(l\), відповідно), є наступним найбільш стабільним станом. Принцип Ауфбау часто представлений візуально. Хоча принцип Ауфбау, як правило, дає порядок, що електрони заповнюють підоболонки, він не розповідає повної історії. Раніше ми дізналися, що кожна орбіталь може утримувати два електрони: один спін вгору і один - вниз. Ми також дізналися, що кожне значення\(l\), записане тут як\(\mathrm{s}, \mathrm{p}, \mathrm{d}\)\(\mathrm{f}\), і, може мати різну кількість підоболонок на основі дозволених значень\(m_l\). Електронну конфігурацію будь-якого атома можна написати, використовуючи ці рекомендації: наприклад, калій є\(1 s^2 2 s^2 2 p^6 3 s^2 3 p^6 4 s^1\). Часто електронну конфігурацію скорочують, щоб включити тільки найближчий повністю зайнятий атом благородного газу і валентні електрони: в цьому випадку калій є [Ar]\(n= 4 s^1\).
Коли атом має лише частково заповнену оболонку, грає правило Гунда: всі орбіталі в частково заповненій підоболонці повинні бути зайняті поодинці, перш ніж будь-які будуть зайняті подвійно. Для\(\mathrm{C}\), який має 6 електронів і електронну конфігурацію\(1 s^2 2 s^2 2 p^2\), правило Хунда говорить нам, що електрони розподіляються, як показано на діаграмі нижче.
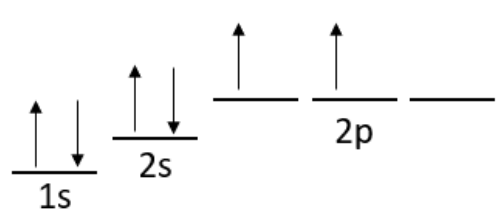
Якщо елементи розташовані за рахунок збільшення кількості електронів (і протонів), починають виникати періодичні тенденції, а електронне наповнення пояснює організацію Періодичної таблиці з блоками, які відповідають заповнюється підоболонці. The\(\mathrm{s}\) - і\(\mathrm{p}\) -blocks є «основною групою» елементів, тоді як ті, що знаходяться в\(\mathrm{d}\) -блоці, є «елементами переходу», а «f-block» є «внутрішніми елементами переходу». Більше основне квантове число\(n\) відповідає більшим орбіталям і, отже, більшим атомам: з цього ми можемо передбачити, що атомний радіус повинен збільшитися на період у періодичній таблиці. З іншого боку, маючи більше протонів, тягне електрони до атома, тому атомний радіус стає меншим, йдучи зліва направо через ряд. Якщо атом втрачає електрон, його радіус зменшується: цей вид атома називається «катіоном». Аналогічно, якщо атом отримує електрон, «аніон» більший.
Нарешті, ми дізналися, що іонні зв'язки - це електростатичне тяжіння між двома протилежно зарядженими іонами: вони утворюються шляхом перенесення одного або декількох електронів між іонами. Сила іонного зв'язку може бути наближена кулонівською взаємодією:\(E=k Q Q / r\). Якщо відстань між двома іонічно зв'язаними атомами більше, зв'язок, як правило, буде слабкішим! Просто подивившись на розмір іонів, що складають зв'язок, ми можемо зробити висновок багато інформації про відповідне іонне тверде тіло.
Чому це важливо
Ми тільки що зробили наш перший зв'язок\(3.091\), і це сильний! Погляньте на цю таблицю енергій решітки (в\(\mathrm{kJ} / \mathrm{mol}\)) для купи іонних твердих тіл. Діапазон міцності іонного зв'язку охоплює порядок в цій діаграмі, але навіть найслабша тверда речовина в списку (йодид калію\(\mathrm{KI}\), в\(649 \mathrm{~kJ} / \mathrm{mol}\)) все ще дійсно сильна з температурою плавлення\(681^{\circ} \mathrm{C}\).
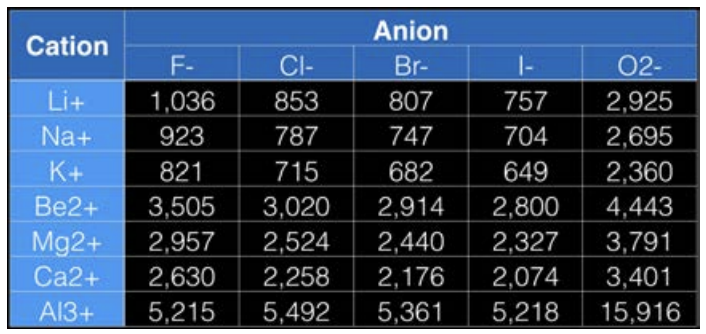
Найсильнішим іонним твердим тілом, перерахованим в цій таблиці, є оксид алюмінію, утворений шляхом об'єднання\(2 \mathrm{Al}\) атомів на кожні 3\(\mathrm{O}\) атоми (це врівноважує заряд з\(\mathrm{Al}\)\(3^+\) буттям і\(\mathrm{O}\)\(2^-\) буттям). Оксид алюмінію плавиться колосально\(2,072{}^{\circ} \mathrm{C}\), і його широко використовують для його твердості та міцності. Наприклад,\(\mathrm{Al}_2\mathrm{O}_3\) використовується як абразив, в тому числі як набагато менш дорогий замінник алмазу, так і в багатьох видах наждачного паперу або ріжучих інструментів. Завдяки своїй міцності, він використовується як добавка в багатьох додатках, включаючи зубну пасту! Для цього моменту, чому це має значення, я хотів би зосередитись на незаповненій потребі, а не на встановленому рішенні. Це проблема, коли більш твердий матеріал з правильними властивостями і в правильній структурі може змінити мільйони життів.
Гемодіаліз - це процес очищення крові людини, у якої нирки не працюють належним чином. Типовому пацієнту доведеться ходити по 3 рази на тиждень, сидіти в стільці, яке виглядає приблизно так близько 4 годин за сеанс, що становить 600 годин свого часу і вартість\(\$ 80,000\) проходження гемодіалізу, і це число неухильно зростає протягом останніх 30 років. Очікується, що зі збільшенням частоти серцево-судинних захворювань, таких як діабет та гіпертонія, населення осіб, які потребують діалізу, також зростатиме. Ця машина зліва від крісла на малюнку - це апарат для гемодіалізу. Під час процесу кров видаляється з організму через точку доступу в вені пацієнта, і пропускається через апарат, який виводить токсини і надлишки рідини, після чого відфільтрована кров повертається в організм через іншу точку доступу назад в обіг. Ось чому це має значення.
Якби цю машину можна було скоротити до набагато менших розмірів і зробити портативною, то пацієнти зможуть зробити це вдома або під час подорожі або де б вони не знаходилися, що серйозно покращило б їх якість життя. Але поточні фільтри не працюють достатньо добре, щоб зробити пристрій маленьким і портативним, тому люди, які потребують лікування гемодіалізом, застрягли. Тобто, якщо не може бути винайдений новий фільтр, який задовольняє трьом ключовим критеріям: 1) матеріал повинен бути біосумісним, 2) він повинен дозволяти селективну фільтрацію, щоб він міг видалити деякі речі, але не інші, і 3) він повинен забезпечувати ефективну та швидку фільтрацію. Такого фільтра в даний час не існує. Поточні фільтри - це пористі мембрани на основі целюлози з сильно змінним розміром пор, що означає, що молекулярну селективність важко контролювати. Пори в поточних фільтрах також багато перекриваються, роблячи звивисті шляхи, які уповільнюють рух рідини, збільшуючи кількість часу, необхідного для протікання крові. Поточні фільтри легко засмічуються, вони делікатні та жорсткі для чищення, тому в кращому випадку вони лише одноразові, а в гіршому випадку вони забиваються настільки швидко, що навіть досягти одноразового використання важко.

Зображення глиноземного фільтра Assaud, L. та ін. Beilstein Журнал нанотехнологій 5 (2014): 162-72. Ліцензія: CC BY.
Тут ми можемо розглянути міцні іонні зв'язки, про які ми дізналися в цій лекції. Ось фотографія нового фільтра, зробленого з\(\mathrm{Al}_2 \mathrm{O}_3\). Зверніть увагу на шкалу, що пори серйозно малі, всього 10 с нанометрів в діаметрі. Вони також вирівняні в тому ж напрямку (тому жоден з цього звивистого потоку, що сповільнює речі), що означає, що потік через них буде швидким та ефективним. І врахуйте, що пори все приблизно однакового розміру, що дає фільтру можливість різко відкидати цільові токсини. І звичайно, оскільки це сильна іонна тверда речовина, цей фільтр можна чистити дуже агресивно майже будь-якими хімічними речовинами для чищення або термічною обробкою, яку ви дбаєте, щоб кинути на нього. Ще потрібно зробити багато роботи, наприклад, зниження вартості виготовлення таких фільтрів, і вони все ще занадто крихкі, але в цілому іонні тверді речовини мають величезний потенціал як фільтри наступного покоління!
Чому це працює
Цей приклад нового типу ультрапружного фільтра є лише одним із багатьох, де потрібні нові високоміцні матеріали. І справа не тільки в самому матеріалі, але і в способі його обробки. І через те, наскільки сильно стійкі нові матеріали потрібні, багато великих хімічних компаній, таких як Dow, Saint-Gobain, BASF, Sinopec, LG Chem, Arkema або Mitsubishi Chemical, щоб назвати лише деякі з гігантів (всі вони мають щорічні продажі в мільярди.\(\$ 10\)
І всі ці компанії мають великі команди, які працюють над виготовленням високоміцних матеріалів. Іноді це високоміцна сталь, іноді це пластик, і, звичайно, інший час, іонні матеріали. Всі ці компанії мають вакансії, але відмінним способом вивчити інтерес до кар'єри є стажування, і всі ці компанії також мають стажування для студентів. Ви можете перейти безпосередньо на веб-сайт компанії, або ви також можете перевірити ресурси, які ми маємо тут, в MIT. Їх дуже багато.
Наприклад, погляньте на веб-сторінку capd.mit.edu, де, якщо ви натиснете на «Вакансії та стажування», ви отримаєте всіляку підтримку та ресурси. Безумовно, варто перевірити!
Приклад проблем
1. Оцініть наступні атоми за розміром, енергією іонізації та електронегативністю:
\(\mathrm{Ge}\)\(\mathrm{Rb}\)\(\mathrm{Sn}\)\(\mathrm{I}\)
- Відповідь
-
Зі збільшенням періоду вниз по таблиці Менделєєва електрони все більше захищаються від ядра, тому атомний розмір збільшується. Крім того, у міру збільшення кількості групи по таблиці Менделєєва з'являється все більше і більше протонів і, отже, збільшується тяжіння від ядра, тому розмір атома зменшується.
(найменший)\(\mathrm{Ge}\)\(\mathrm{I}\)\(\mathrm{Sn}\)\(\mathrm{Rb}\) (найбільший)
2. Нижче наведено PES спектр для зовнішніх електронів таємничого елемента. Позначте осі і напрямок збільшення енергії іонізації.
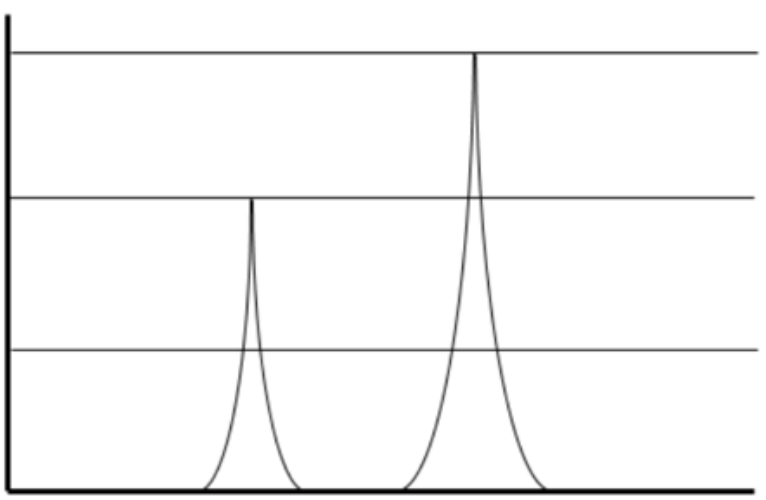
а) Якщо конфігурація внутрішніх електронів таємничого елемента збігається з неоном, визначте елемент.
- Відповідь
-
Фосфор: його електронна конфігурація\([\mathrm{Ne}] 2 \mathrm{~s}^2 3 \mathrm{p}^3\)
б) Окремо, поки ви брали PES спектри для вуглецю у вакуумі, ущільнення на вакуумній машині зламалося і впустило невідомий газ. Ви спостерігаєте наступне на забрудненому спектрі:
i Всього існує 6 піків (включаючи вуглецеві піки)
II. П'ять вершин однакової висоти
iii. Один пік в три рази вище інших
Що таке забруднюючий елемент? Поясніть свої міркування.
- Відповідь
-
Електронна конфігурація карбону є\(1 \mathrm{~s}^2 2 \mathrm{~s}^2 2 \mathrm{p}^2\). Оскільки в кожній оболонці по 2 електрона, ці три піки повинні бути однакової висоти. Тому додаткові піки повинні належати\(1 \mathrm{~s}^2 2 \mathrm{~s}^2\)\(2 \mathrm{p}^6\), оскільки одна з вершин втричі вища за решту. Забруднюючий газ є\(\mathrm{Ne}\).
Лекція 8: Іони, іонізація та валентність
Резюме
Цією лекцією ми продовжили обговорення енергії іонізації. Ми побачили, що, подібно до\(\mathrm{Li}\) і\(\mathrm{Be}\) в останній лекції, енергія іонізації елементів вздовж періодів (зліва направо на таблиці Менделєєва) в\(\mathrm{p}\) і\(\mathrm{d}\) блоці збільшується за рахунок більшої кількості протонів, що призводить до збільшення ядерної тяги. Має сенс, що для їх звільнення необхідно більше енергії. З іншого боку, спускаючись по групах (зверху вниз по таблиці Менделєєва), енергія іонізації зменшується, оскільки збільшене екранування та відстань від ядра є більш значними, ніж збільшена ядерна тяга за рахунок доданих протонів.
Причина збільшення енергій іонізації електронів ближче до ядра полягає в тому, що ці електрони більш щільно пов'язані. Наприклад, перша енергія іонізації Лі становить 5,4\(\mathrm{eV}\), тоді як друга енергія іонізації - 122\(\mathrm{eV}\). Цей другий електрон відчуває менше екранування, ніж перший. Цю інформацію про енергію іонізації можна переглянути на графіку фотоелектронної спектроскопії (PES). Це сюжет, що показує енергію іонізації порівняно з відносною інтенсивністю для даного елемента. PES передбачає світіння достатньої енергії на атомі, щоб іонізувати всі його електрони, вимірюючи їх кінетичну енергію, при цьому різниця дорівнює тому, скільки енергії був пов'язаний електрон. PES - це проста, потужна техніка для безпосереднього вимірювання окупації електронів.
Іншою періодичною тенденцією обговорювалася була спорідненість електронів, або зміна енергії, яка супроводжує додатковий електрон. Галогени (17 група в таблиці Менделєєва) мають найвищу електронну спорідненість, оскільки додатковий електрон призведе до повного октету і повного заповнення підоболонки. Спорідненість до електронів збільшується по періодах періодичної таблиці аж до появи галогенів.
Ця лекція також виклала ідею валентних електронів. Це електрони, які займають орбіталі за межами найвищого заповненого ядра благородного газу. Наприклад, вуглець і кремній мають 4 валентних електронів. Найвище наповнене ядро благородного газу вуглецю є [\(\mathrm{He}\)], тоді як кремній - [\(\mathrm{Ne}\)]. Валентні електрони - це те, що керує хімічними зв'язками. Валентні електрони на атомах зображуються за допомогою діаграм точок Льюїса, які є хімічними символами елементів з оточуючими їх точками, що представляють валентні електрони. Lewis Dot Structures корисні для візуалізації правила октету, яке стверджує, що атоми (ігноруючи перехідні метали на даний момент) знаходяться в найнижчому і найбільш стабільному енергетичному стані з 8 електронами в їх валентності.
У цій лекції ми почали застосовувати Lewis Dot Structures до іонних зв'язків. Катіони зображуються зі знаками плюсів у верхньому правому куті, а аніони з негативними знаками, як показано нижче.
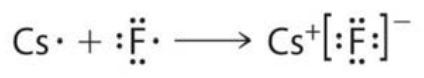
Чому це важливо
У цій лекції ми зосередилися на атомах, які втрачають або отримують електрони, які також називаються іонами. Зараз ми обговоримо, як ця тема пов'язана з рішеннями відновлюваної енергетики.
Погляньте на цей сюжет попиту на електроенергію (синім кольором) проти постачання електроенергії з вітроелектростанції (червоним кольором), зафіксований протягом двох з половиною місяців 2013 року в Данії. Зверніть увагу, що на стороні попиту є деяка мінливість, але є також багато регулярності. 5-денний робочий тиждень залучає більше енергії, ніж вихідні, а кількість енергії, необхідної, насправді не сильно змінюється від тижня до тижня. Тепер контрастуйте, що з постачанням електроенергії від вітрогенератора. Навіть якщо ви поставите турбіни у відомому вітряному районі, все одно існує величезна кількість мінливості. Вітроенергетика не така вже й дорога у виробництві, але найбільша проблема - це не вартість, це стабільність постачання. Якщо ви думаєте про те, як побудувати достатньо цього типу ненадійної пропозиції, щоб задовольнити постійний попит, вам потрібно буде перебудувати потужність щонайменше в 10 разів (і навіть цього не вистачить на кілька днів)! Це, звичайно, не буде економічно доцільним, тому реальне рішення, якщо ми хочемо розширити, скільки енергії ми отримуємо від переривчастих відновлюваних джерел енергії, таких як вітер та сонячна енергія, - це можливість зберігати енергію, коли вона потрібна. Якщо у нас надійне зберігання, то пропозиція може бути досить ненадійною, і ми все одно зможемо задовольнити постійний попит, доки в середньому пропозиція може задовольнити його.
Один з найпростіших способів накопичення енергії - підштовхнути щось на пагорб, а потім дати йому відкотитися вниз. Натисніть м'яч на пагорб, а потім утримуйте його там, і коли ви хочете, щоб накопичена потенційна енергія повернулася як кінетична енергія, просто відпустіть її. Ми перекачуємо воду на пагорби, звані «насосною гідросистемою», яка в даний час є однією з єдиних життєздатних технологій, яка може масштабуватися до розмірів (тобто потужності) реальних електричних мереж. Величезна кількість води перекачується на пагорб, коли є надлишок енергії, а потім відкочується вниз, щоб повернути турбіну, щоб виробляти електроенергію, коли є надлишковий попит. Хоча це відносно дешеве рішення для зберігання, існують всілякі проблеми з масштабуванням далі, ніж сьогодні, перш за все через низьку енергію, яку ми отримуємо від гравітаційної енергії, а отже, скільки землі потрібно. Існує чудова публікація, яка пояснює, чому буде важко збільшити накачувану гідроенергію як технологію накопичення енергії в domathemath, який взагалі є крутим сайтом, якщо ви цього не бачили: https://dothemath.ucsd.edu/2011/11/p...p-the-storage/.
Так що ще ми можемо накачати пагорб, щоб накопичити енергію? Ось тут наші іони потрапляють в картину! Іони є ключовим інгредієнтом акумуляторів. Подумайте про батарею як про електронну гірку, а коли акумулятор заряджається, іони накачуються. Зокрема, катіони\(\mathrm{Li}+\), наприклад, підштовхуються до енергетичного пагорба, і нижчий енергетичний стан (внизу пагорба) буде тим, в якому він може отримати цей електрон назад і знову стати нейтральним. Коли ланцюг замкнутий, катіон падає вниз енергетичного пагорба, щоб зустрітися з електроном, який йде навколо ланцюга, роблячи роботу по дорозі. У цьому випадку замість механічної роботи, як вода, електрон робить електромонтажні роботи безпосередньо. Це одна з великих переваг електрохімічного зберігання (хороший спосіб сказати акумулятор), а саме те, що ми зберігаємо безпосередньо ту енергію, яку нам найбільше потрібно, електричну енергію. Збережена механічна або теплова енергія пізніше часто повинна бути перетворена в електричну з великими втратами ефективності.
Але наскільки хороші батареї сьогодні, насправді? Чи можуть вони коли-небудь бути використані для зберігання величезної кількості енергії, необхідної в «масштабах сітки»? Для довідки, США використовують 3 TW в середньому, або\(3 \times 10^{12}\) Вт\(= 3 \times 10^{12}\) Джоуль/секунду енергії, так що ви отримаєте уявлення про те, що означає бути в масштабі сітки. Давайте переконаємось, що ми прямо на енергії проти потужності: Ватт - це Джоуль/Секунда, яка є енергією за час, що є потужністю. Це важливий показник, оскільки нам потрібно мати доступ до енергії в заданому темпі. Загальна кількість енергії - це потужність, помножена на час, тому для США, якщо наша середня потужність, як нація\(3 \mathrm{TW}\), то наше щоденне використання енергії становить\(72 \mathrm{TW}\) -hours (TwH) і наше щорічне використання енергії є\(26,280 \mathrm{TWh}\). Просто щоб дати вам зрозуміти, наскільки велика ця цифра, типовий акумулятор AAA зберігає близько однієї Wh енергії. Це означає, що якби ми хотіли зберігати енергетичні потреби США, все, що нам потрібно було б зробити, це побудувати сховище, що містить батареї\(26,280,000,000,000,000\) AAA! Якщо вам цікаво, це приблизно в мільйон разів перевищує кількість батарей AAA, що продаються в США щороку.
І в цьому криється проблема з батареями, а саме їх низька щільність енергії. Але, як я сподіваюся, ви бачите в цьому класі, такі проблеми часто є можливостями для хімії, щоб прийти і зробити різницю, що змінює гру.
Цей показник показує енергію на вагу проти енергії на об'єм для декількох різних матеріалів для зберігання. Зверніть увагу, що батареї знаходяться в лівому нижньому куті, що не так добре. Ви можете зрозуміти, чому бензин настільки унікальний: він має дуже високу щільність енергії як за вагою, так і за обсягом, а крім того, він безпечний і простий у транспортуванні і надзвичайно дешевий. Конкуренція жорстка.
Один літр бензину зберігає 33 мегаджоулі (\(\mathrm{MJ}\)) енергії, або близько 9,\(\mathrm{kWh}\) якщо ви віддаєте перевагу цим агрегатам. Цей літр коштує близько долара. Тепер візьміть одного професора MIT, який може вивести близько 60\(\mathrm{W}\) або 60\(\mathrm{J/s}\) в хороший день. Це означає, що професор може генерувати таку ж кількість енергії, як і в літрі бензину\(33 \mathrm{MJ}\), приблизно за 153 години. Враховуючи середню зарплату професора MIT\(\$ 10 / \mathrm{hr}\), це коштувало б\(\$ 1530\) отримати енергію від професора. У порівнянні з приблизно\(\$ 1\) отримати таку ж кількість накопиченої енергії з бензину. Акумулятори повинні почати виглядати набагато більше, як бензин і набагато менше, як професор MIT, якщо вони збираються бути конкурентоспроможними технологіями накопичення енергії в масштабі сітки.
Хороша новина полягає в тому, що за останні 10-20 років вже був величезний прогрес. Перевірте цей сюжет щільності енергії проти року для акумуляторів. Зверніть увагу на дуже повільний прогрес протягом приблизно 150 років, з подвоєнням щільності енергії відбувається приблизно кожні 60 років. Тоді нахил прогресу змінюється, і причина проста: хімія. Зокрема, швидкі поліпшення відбуваються тому, що ми досягли епохи, коли ми можемо зробити енергетичні пагорби для іонів з набагато більше типів матеріалів, ніж будь-коли раніше. Я додав до сюжету кількість матеріалів катоди зроблені з: історично тільки близько 10 різних катодних матеріалів були використані протягом цих повільних перших 150 років, але тепер ми можемо і зробити катоди з більш ніж 80 різних матеріалів, і кількість зростає з тижнем. Ця можливість вибуху матеріалів обумовлена більш глибоким розумінням іонів та новою здатністю проектувати матеріали з більш ефективними енергетичними ландшафтами для їх проходження. Так що так, є багато роботи, щоб зробити батареї конкурентоспроможними в накопичувачі енергії в мережевому масштабі, але час абсолютно дозрів, щоб це зробити.
Чому це працює
Знання іонів може отримати вам всілякі завдання. Але оскільки я зосередився на полі батареї в Чому це важливо, давайте зосередимося на цій же темі тут. Світовий ринок акумуляторів вже величезний, і його прогнозоване зростання приголомшливе. Ось діаграма зі звіту Deutsche Bank за 2016 рік, що показує прогнозоване короткострокове зростання виробництва акумуляторів деякими провідними компаніями, які виробляють акумулятори. Всі ці компанії наймають тисячі і тисячі вчених і інженерів, техно-економістів (передбачити технологічні тенденції непросто!) , експерти з упаковки та механічного дизайну та багато іншого, щоб працювати над різними аспектами одного: іона. І є набагато більше робочих місць, ніж це. Великі акумуляторні компанії, такі як ті, що перераховані на графіку, вкладають значні кошти в наймання людей для роботи на акумуляторах, але так само невеликі компанії. Так само багато дослідницьких колективів в університетах, які розкручують компанії на основі нових концепцій.
Мало того, що існує багато різних хімічних речовин акумуляторів, які існують протягом деякого часу і значно вдосконалюються, від літій-іонних до нікель-метал-гідриду до свинцево-кислотних, але є також так багато захоплюючих абсолютно нових напрямків для акумуляторів. Всі ці майбутні технології акумуляторів включають робочі місця, і хоча важко перерахувати їх все через те, наскільки росло поле, ось кілька цікавих напрямків, які компанії переслідують:
- Аноди на основі кремнію (заміна використовуваного в даний час графіту), що збільшить щільність енергії в 3 рази
- Використання металевих нанодротів в електроліті для запобігання поломки, завдяки чому батарея прослужить на 10 або 100\(\mathrm{x}\) довше
- Виготовлення електроліту твердим замість поточної рідини, що зробило б акумулятор більш стабільним і дозволило б набагато швидше зарядити час •
- Кидання графена в акумулятор, оскільки, як би там не було, яку проблему графен не може вирішити? (Добре, але з усією серйозністю було показано, що графен дозволяє набагато швидше заряджати/розряд)
- Виготовлення акумуляторів з пінопластових металів
- Виготовлення акумуляторів, що складаються (тонкий папір, але це не зламається), а також розтягується
- Алюмінієві повітряні батареї, які продемонстрували дальність дії 1100 миль в електромобілі
- Живлення зарядки акумуляторів різними засобами, від wi-fi сигналів (не індуктивних бездротових, що є чимось іншим), до ультразвуку, до амінокислот, до сечі. Батареї виготовлені з натрію, цинку, сірки, магнію та багатьох інших матеріалів!
- Виготовлення батарей, які ніколи не можуть спалахнути
Приклад проблем
1. Виберіть більший атом з наступних пар:
а)\(\mathrm{Rb}, \quad \mathrm{Rb}^+\)
- Відповідь
-
\(\mathrm{Rb}\)більше, тому що має додаткову оболонку (\(\left(\mathrm{Rb}^{+}\right.\)втрачає свій\(5 \mathrm{~s}^1\) електрон)
б)\(\mathrm{Rb}^+, \quad \mathrm{Kr}\)
- Відповідь
-
\(\mathrm{Kr}\)більше, тому що в ньому на один протон менше\(\mathrm{Rb}^{+}\), ніж, тому ядро менше тягне електрони
2) Намалюйте точкові структури Льюїса\(\mathrm{FeCl}_3\) і\(\mathrm{MgF}_2\).
- Відповідь
-
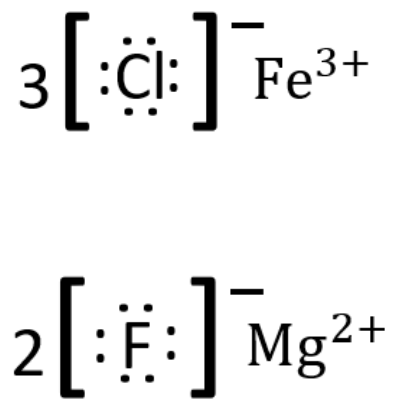
Лекція 9: Структури Льюїса, ковалентні зв'язки та резонанс
Резюме
Ковалентні зв'язки створюються шляхом спільного використання електронів, а не через електростатичне притягання між катіонами та аніонами, як іонні зв'язки. Спільні електрони в ковалентних зв'язках досягають більш низького і стабільного енергетичного стану, взаємодіючи з двома ядрами замість одного. Lewis Dot Structures представляють два електрони в ковалентному зв'язку з лініями, як показано праворуч.\(\mathrm{H}_2\)
- З'єднують атоми, центральні часто менш електронегативні
- Визначити загальну кількість валентних електронів
- Помістіть сполучну пару електронів між сусідніми атомами
- Починаючи з кінцевих атомів, додайте електрони до кожного з них, щоб утворити октет (2 для\(\mathrm{H}\))
- Якщо електрони залишилися, помістіть на центральний атом
- Якщо центральний атом не досяг октету, використовуйте поодинокі пари з кінцевих атомів, щоб сформувати кілька зв'язків з центральним атомом для досягнення октету
Можна мати більше однієї структури Льюїса, яка не оцінює правило октету. Для цих інстанцій ми розраховуємо формальний нарахування. Сума формального заряду повинна дорівнювати загальному заряду на молекулу або іон. Щоб розрахувати офіційну плату, виконайте наступні дії:
- Незв'язні електрони закріплюються за атомом, на якому вони розташовані.
- Сполучні електрони поділяються порівну між зв'язаними атомами.
- Потім формальний заряд можна обчислити для кожного атома наступним чином:
\[\text { formal charge }=\text { valence } e^{-}-\left(\text {nonbonding } e^{-\prime} s+\frac{\text { bonding } e^{-\prime} s}{2}\right) \nonumber\]
Окрім стабільності, формальний заряд говорить нам про електронегативність структури - атоми з негативним формальним зарядом повинні бути більш електронегативними, а ті, що мають позитивний формальний заряд, менш електронегативними.
Також можна мати дві різні структури Льюїса з однаковим офіційним звинуваченням. Це вказує на те, що фактична молекула є поєднанням її найбільш стійких резонансних структур, як у прикладі озону в класі, де ми маємо в середньому 1,5 зв'язку по обидва боки від центру кисню.
Ми також обговорили поняття полярності - міри того, як нерівномірно розподіляються електрони між двома атомами в зв'язку. У неполярних ковалентних зв'язках електрони діляться порівну, як в\(\mathrm{H}_2\).
У полярних ковалентних зв'язках поділ нерівний. Електронегативність\((\chi)\), тенденція атома до залучення спільної пари електронів до себе, може бути використана як міра полярності в зв'язку. У повністю неполярному зв'язку два атоми матимуть однакові електронегативності, тобто\(\Delta \chi=0\). У сильному іонному зв'язку спостерігається велика різниця в електронегативності. В\(\mathrm{CsF}\), використовуючи шкалу Полінга,\(\Delta \chi=3.98-.79=3.19\).
Нарешті, ми назвали кілька способів, якими може бути порушено правило октету. Деякі елементи, як і бор, можуть мати менше 8 електронів. Інші, як і сірка, можуть мати розширений октет.
Чому це важливо
Говорячи про\(\mathrm{CO}_2\) молекулу та її формальні заряди та стабільну структуру, це основна увага цього «Чому це важливо». Давайте зробимо це наперед: після півтора століття експериментів та збору даних наукове співтовариство встановило з величезним консенсусом, що викиди вуглекислого газу є основною причиною зміни клімату. Інші теорії, такі як сонячні цикли або вулканічна активність, не корелюють із спостережуваними змінами температури, і зараз існує лише одне послідовне пояснення підвищення глобальних температур та нашого мінливого клімату: антропогенні парникові гази на чолі з вуглекислим газом.
До речі, якщо хто (скажімо, не знаю, політик?) повинні були сказати вам щось на кшталт: «Є величезні розбіжності щодо того, чи є земля кругла. Дебати про земну форму слід заохочувати - в класах, громадських форумах, залах Конгресу», - назвали б таке зауваження або забуттям, або брехнею. Це така ж брехня, яку багато людей розповідають про факти зміни клімату. Велика частина висвітлення в ЗМІ зосереджена на тому, як визначити такі «альтернативні факти», але категоризація зауваження не є предметом. Незалежно від того, як ми це називаємо, такий тип висловлювання є загрозою для самих основ науки, аргументованої аргументації, а значить, і для суспільства. Політики можуть жити в «постфактному» світі, але вчені цього не роблять, і не можуть. Немає «постфактологічної науки».
Гаразд, повернемося до нашої молекули. Чому саме ця молекула так важлива для зміни клімату та глобального потепління? \(\mathrm{CO}_2\)називається «парниковим газом» через його здатності поглинати інфрачервоне випромінювання, яке в свою чергу зігріває планету. Погляньте назад на сюжет інтенсивності сонячного випромінювання, що потрапляє на планету як функцію частоти, з «Чому це важливо» в лекції 4. Жовтий - це те, що вражає верхню атмосферу, а червоний - це те, що потрапляє на земну поверхню, тому різниця між жовтою та червоною кривими полягає в тому, де частина цієї сонячної енергії поглинається. Невеликі молекули в атмосфері, такі як озон, вода та вуглекислий газ, - це те, що поглинає надходить сонячну енергію. Ви можете бачити, де\(\mathrm{CO}_2\) поглинає, праворуч в інфрачервоній частині спектра, тоді як озон знаходиться зліва в УФ, а вода всюди. Саме сила поглинання ІЧ робить\(\mathrm{CO}_2\) такий ефективний парниковий газ.
Про\(25 \%\) сонячне випромінювання, яке потрапляє на землю (так\(25 \%\) інтегрованого червоного кольору в сюжеті) відбивається назад у Всесвіт. Але те, що відбивається, - це не те, що поглинається: натомість більша частина енергії, яка відбивається, знаходиться в більшій довжині хвилі, інфрачервоній частині спектра. Оскільки ефективно\(\mathrm{CO}_2\) поглинає в цій частині, вона діє як ковдра, утримуючи частину цієї відбитої енергії від виходу та перенаправлення її назад в атмосферу та поверхню. Ця ковдра тримає нас у затишному\(15^{\circ} \mathrm{C}\) місці\(-18^{\circ} \mathrm{C}\), а не, якою була б середня температура на землі, якби вся ця відбита сонячна енергія змогла врятуватися.
Як осторонь, термін «парниковий газ» - це трохи заплутана назва, яка, на жаль, застрягла. Ефект поглинання довгохвильового випромінювання на температуру планети не має нічого спільного з наслідками потепління в теплиці, яка використовується для вирощування рослин, остання покладаючись здебільшого на запобігання конвекції повітря від відведення тепла.
Ось зв'язок з нашими структурами Льюїса та офіційним звинуваченням. Це ефективне поглинання\(\mathrm{CO}_2\) в інфрачервоному діапазоні я згадував, що безпосередньо пов'язане з тим, як атоми в молекулі вібрують. Фотон поглинається, оскільки він переходить у вібраційну енергію, тому специфічний спосіб коливання атомів надзвичайно важливий для того, які фотони він може поглинати і наскільки ефективно це робить. Якби\(\mathrm{CO}_2\) молекула мала потрійний зв'язок і єдиний зв'язок, що є дійсною структурою Льюїса, але з більш високим формальним зарядом, то її моделі вібрацій різко змінилися б порівняно з більш стабільним корпусом подвійного зв'язку (з формальним зарядом\(=0\)), що, в свою чергу, зробило б її набагато меншою ефективний при поглинанні всієї інфрачервоної енергії!
Чому це працює
Сьогоднішня лекція була присвячена ковалентному зв'язку, зручному способу представлення його за допомогою структур Льюїса, і про те, що ми можемо дізнатися про молекули з цих структур. Важко зустріти роботу в будь-якій інженерній чи науковій галузі, яка не вимагає принаймні деякого розуміння ковалентного зв'язку, оскільки вона настільки повсюдна. Це також ускладнює нуль на конкретному ринку праці для Чому це працює. Ось чому я збираюся зосередитись на одному матеріалі - вуглеці - і робочих місцях, які ви можете знайти, пов'язаних з його ковалентними зв'язками.
У кількох лекціях ми дізнаємося про молекулярні орбіталі, і як приклад ви побачите, наскільки гнучким може бути вуглець у середовищі склеювання. Це один з найбільш гнучких елементів у всьому PT тим, що він любить одинарні, подвійні та потрійні зв'язки, а також все, що знаходиться між ними (читайте: резонансні структури та делокалізація). Давайте виберемо одну з багатьох форм вуглецю, щоб зосередитись на цьому: ароматичне кільце. Термін ароматичний має своє походження в тому, що ароматичні молекули можуть мати солодкий аромат для них, але насправді бензол - класична ароматична молекула - не має такого запаху. Натомість термін використовується в хімії полягає в тому, що електрони в кільці вуглецю знизили свою енергію шляхом делокалізації (так, резонансні структури!). Найчастіше це відбувається для кільця, що має чергуються одно- і подвійні зв'язки, які потім утворюють середнє над його резонансними структурами. Бензол є класичним прикладом цього, оскільки це найпростіше ароматичне кільце, яке можна зробити.
І ви, напевно, чули про бензол раніше, але те, що ви, можливо, не знаєте, скільки способів бензол можна модифікувати, щоб зробити або зробити щось корисне. Ознайомтеся з цією діаграмою лише дуже малої частки похідних бензолу, де кільце має деяке доповнення (и), щоб надати йому певну властивість або функціональність. Ця масова зміна хімії однієї молекули можлива значною мірою завдяки тому ковалентному зв'язку, який виробляє вуглець.
Багато матеріалів, з якими ми стикаємося щодня, виготовляються з похідних бензолу. Полістирол, наприклад, являє собою полімер, утворений шляхом з'єднання молекул стиролу між собою, і щороку виробляються мільярди кілограмів полістиролу. Отже, безумовно, робочі місця в компаніях, які включають виробництво, переробку або використання пластмас, таких як полістирол, пов'язані (я думаю, що посада старшого хіміка в BASF, хімічної компанії, наприклад). Але використання похідних бензолу виходить далеко за рамки пластмас. Наприклад, промисловість використовує бензол для виготовлення смол, нейлону та багатьох різних синтетичних волокон, а також мастильних матеріалів, каучуків, барвників, миючих засобів, ліків та пестицидів. Візьмемо ліки як інший приклад: ось молекула ацетамінофену (Tylenol) - це похідне бензолу!
Таким чином, фармацевтична промисловість також є прекрасним місцем, щоб взяти ваші знання про бензол (я думаю, Джонсон і Джонсон, Pfizer, Novartis, і так далі). Ці компанії щороку інвестують мільярди та мільярди доларів для фінансування досліджень з розробки та тестування нових лікарських засобів, багато з яких мають в своїй основі резонансну структуру Льюїса.
Приклад проблем
1. Намалюйте резонанс для кожного атома\(\mathrm{CHO}_2^{~-}\) і призначте формальні заряди.
- Відповідь
-
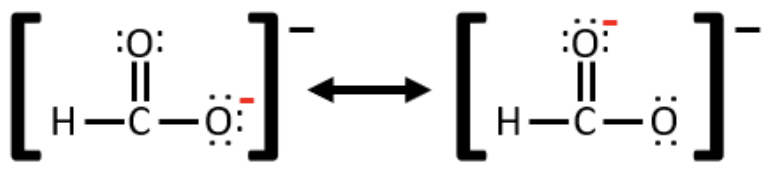
2. Правда чи помилково: Наступна картина показує дві резонансні структури молекули
- Відповідь
-
Помилкові. Дві структури не є резонансними структурами, оскільки атоми рухаються навколо.
Подальше читання
Лекція 1: Вступ та хімія таблиці Менделєєва
• Історія атомів (не перевірено):
https://courses.lumenlearning.com/trident-boundless-chemistry/chapter/history-of-atomic-structure/
• Балансування реакцій і обмежуючий реагент:
Лекція 2: Підрахунок атомів і організація елементів
• Моль і молекулярна маса:
https://opentextbc.ca/chemistry/chapter/3-1-formula-mass-and-the-mole-concept/
• Більше інформації про кар'єру в галузі харчової науки та агрохімії:
Лекція 3: Відкриття електрона і будова атома
• Огляд ізотопів:
• Рецепт сливового пудингу (не перевірений):
https://www.epicurious.com/recipes/food/views/superb-english-plum-pudding-20010
Лекція 4: Модель Бора та електронні переходи
• Детальніше про випромінювання чорного тіла, квантування та круте відео про фотоелектричний ефект:
• Резюме спектрів випромінювання та поглинання:
• Наука в контексті - Ейнштейн та інші видатні вчені втекли з нацистської Німеччини (не перевірено):
https://physicstoday.scitation.org/do/10.1063/PT.6.4.20180926a/full/
Лекція 5: Двіальність хвилевих частинок та квантова механіка
• Детальніше про подвійність хвиль частинок і квантовий атом:
• Фотоелектронна спектроскопія:
Лекція 6: Атомні орбітальні та квантові числа
• Квантові числа:
https://courses.lumenlearning.com/cheminter/chapter/quantum-numbers/
• Рівняння Шредінгера та частинки в коробці (не перевірено):
http://hyperphysics.phy-astr.gsu.edu/hbase/quantum/schr.html
• Курс краху квантової механіки:
https://www.youtube.com/watch?v=qO_W70VegbQ&list=PL8dPuuaLjXtN0ge7yDk_UA0ldZJdhwkoV & індекс = 45
• Вступ до квантової механіки Девіда Дж.Гріффітса, доступний тут або у вашій місцевій бібліотеці MIT:
Лекція 7: Заповнення Періодичної таблиці та нашої першої зв'язку (вона іонна)
• Електронні конфігурації:
• Періодичні тенденції:
https://opentextbc.ca/introductorychemistry/chapter/periodic-trends-2/
• Іонні зв'язки:
https://www.youtube.com/watch?v=zpaHPXVR8WU
Лекція 8: Іони, іонізація та валентність
Фотоелектронна спектроскопія (ПЕС):
Лекція 9: Структури Льюїса
• Малювання Dot діаграм Льюїса: Додаткова практика:
http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch01/ch1-3depth.html
• Відеоурок: