16.7: Електроліз
- Page ID
- 23305
- Опишіть електролітичні елементи та їх зв'язок з гальванічними елементами
- Виконуйте різні розрахунки, пов'язані з електролізом
У гальванічних елементах хімічна енергія перетворюється в електричну. Протилежне вірно для електролітичних елементів. У електролітичних комірках електрична енергія викликає неспонтанні реакції, що відбуваються в процесі, відомому як електроліз. Зарядка електричної батареї показує один такий процес. Електрична енергія перетворюється в хімічну енергію в акумуляторі, коли вона заряджається. Після зарядки акумулятор можна використовувати для живлення автомобіля. У електролітичних елементах задіяні ті ж принципи, що і в гальванічних елементах. Ми розглянемо три електролітичні елементи і кількісні аспекти електролізу.
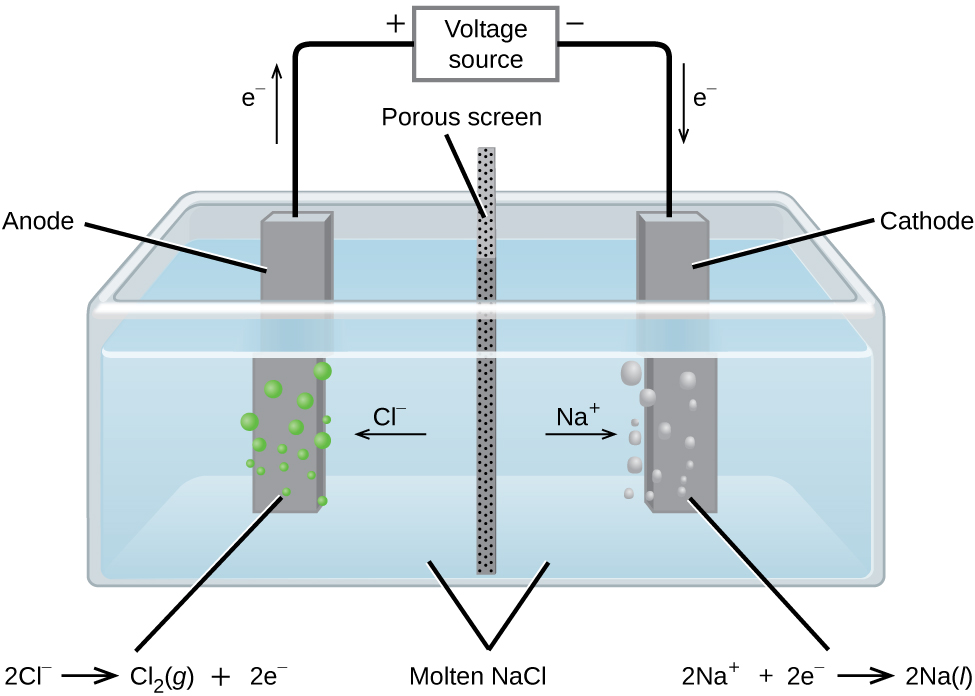
Електроліз розплавленого хлориду натрію
У розплавленому хлориді натрію іони можуть вільно мігрувати на електроди електролітичного елемента. Спрощена схема осередку, що комерційно використовується для отримання металу натрію і газоподібного хлору, показана на малюнку\(\PageIndex{1}\). Натрій є сильним відновником, а хлор використовується для очищення води, і використовується в антисептиках і у виробництві паперу. Реакції такі
\ [\ почати {вирівняти}
&\ textrm {анод:}\ ce {2Cl-} (л) ⟶\ ce {Cl2} (г) +\ ce {2e-}\ hspace {20px} E^\ circ_ {\ ce {Cl2/Cl-}} =\ mathrm {+1.3\: V}\\
&\ textrm {катод:}\ ce {Na+} (l) +\ ce {e-} ⟶\ ce {Na} (l)\ hspace {20px} E^\ circ_ {\ ce {Na+/Na}} =\ mathrm {−2.7\: V}\\
&\ overline {\ textrm {загальний :}\ ce {2Na+} (l) +\ ce {2Cl-} (l) ⟶\ ce {2Na} (л) +\ ce {Cl2} (г)\ hspace {20px} E^\ circ_\ ce {комірка} =\ mathrm {−4.0\: V}}
\ кінець {вирівнювання}\ nonnumber\]
Блок живлення (акумулятор) повинен подавати мінімум 4 В, але, на практиці, що застосовуються напруги зазвичай вище через неефективність самого процесу.
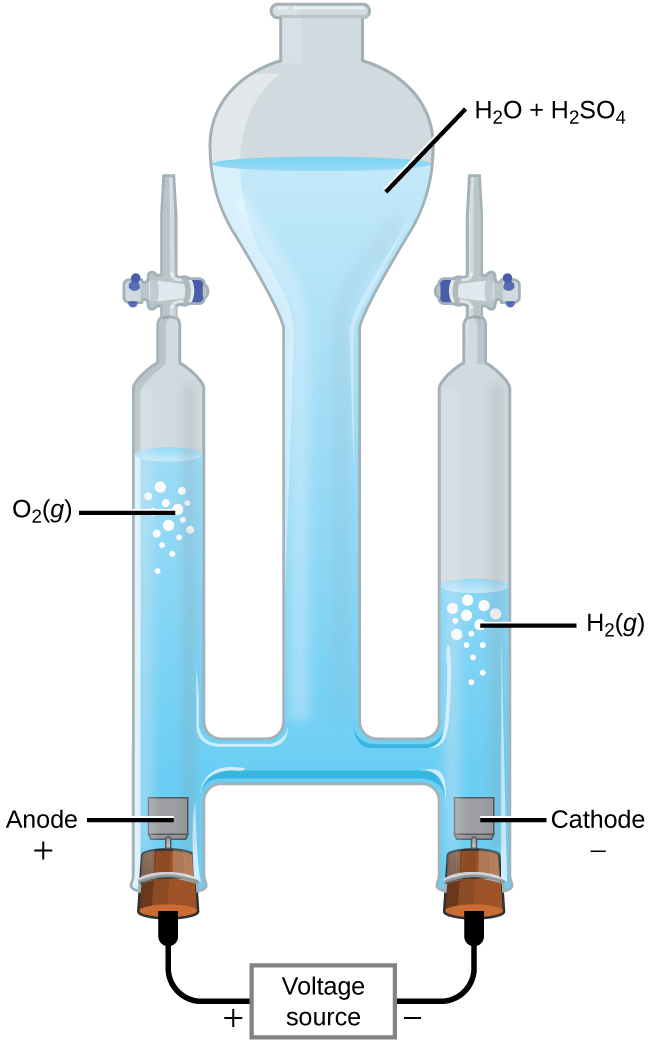
Електроліз води
Можна розщепити воду на водень і газ кисню шляхом електролізу. Кислоти зазвичай додають для збільшення концентрації іона водню в розчині (рис.\(\PageIndex{2}\)). Реакції такі
\ [\ почати {вирівняти}
&\ textrm {анод:}\ ce {2H2O} (л) ⟶\ ce {O2} (г) +\ ce {4H+} (aq) +\ ce {4e-}\ hspace {20px} E^\ circ_\ ce {анод} =\ mathrm {+1.229\: V}\\
&\ textrm {катод:}\ ce {2H+} (q) +\ ce {2e-} ⟶\ ce {H2} (г)\ hspace {20px} E^\ circ_\ ce {катод} =\ mathrm {0\: V}\\
&\ overline {\ textrm { загальний:}\ ce {2H2O} (l) ⟶\ ce {2H2} (g) +\ ce {O2} (g)\ hspace {20px} E^\ circ_\ ce {комірка} =\ mathrm {−1.229\: V}}
\ кінець {вирівнювання}\ номер\]
Зверніть увагу, що сірчана кислота не витрачається і що обсяг виробленого водню в два рази перевищує обсяг виробленого кисню газу. Мінімальна подається напруга - 1,229 В.
Електроліз водного хлориду натрію
Електроліз водного хлориду натрію є більш поширеним прикладом електролізу, оскільки більше одного виду можна окислювати та відновлювати. Розглядаючи анод в першу чергу, можливі реакції
\ [\ почати {вирівняти}
&\ textrm {(i)}\ ce {2Cl-} (q) ⟶\ ce {Cl2} (г) +\ ce {2e-}\ hspace {20px} E^\ circ_\ ce {анод} =\ mathrm {+1.35827\: V}\\
&\ textrm {(ii)}\ ce {2 H2O} (л) ⟶\ ce {O2} (г) +\ ce {4H+} (q) +\ ce {4e-}\ hspace {20px} E^\ circ_\ ce {анод} =\ mathrm {+1.229\: V}
\ кінець {вирівнювання}\ номер\]
Ці значення свідчать про те, що вода повинна окислюватися на аноді, оскільки потрібен менший потенціал - використання реакції (ii) для окислення дасть менш негативний потенціал клітини. При проведенні експерименту на аноді виходить хлор, а не кисень. Несподіваний процес настільки поширений в електрохімії, що йому дали назву overpotencial. Надлишковий потенціал - це різниця між теоретичною напругою комірки і фактичною напругою, яка необхідна для того, щоб викликати електроліз. Виявляється, що надпотенціал кисню досить високий і ефективно робить потенціал відновлення більш позитивним. В результаті в нормальних умовах газоподібний хлор - це те, що насправді утворюється на аноді.
Тепер розглянемо катод. Можуть відбутися три скорочення:
\ [\ почати {вирівняти}
&\ текст {(iii)}\ ce {2H+} (q) +\ ce {2e-} ⟶\ ce {H2} (г)\ hspace {20px} E^\ circ_\ ce {катод} =\ математика {0\: V}\\
&\ textrm {(iv)}\ ce {2H2O} (л) +\ ce {2e-} ⟶\ ce {H2} (г) +\ ce {2OH-} (q)\ hspace {20px} E^\ circ_\ ce {катод} =\ mathrm {−0.8277\ :V}\\
&\ textrm {(v)}\ ce {Na+ } (q) +\ ce {e-} ⟶\ ce {Na} (s)\ hspace {20px} E^\ circ_\ ce {катод} =\ mathrm {−2.71\: V}
\ кінець {вирівнювання}\ nonumber\]
Реакція (v) виключена, оскільки вона має такий негативний потенціал зниження. У стандартних умовах стану реакція (iii) буде кращою, ніж реакція (iv). Однак рН розчину хлориду натрію дорівнює 7, тому концентрація іонів водню становить всього 1 × 10 −7 М. При таких низьких концентраціях реакція (iii) малоймовірна і відбувається реакція (iv). Загальна реакція тоді
\[\textrm{overall: }\ce{2H2O}(l)+\ce{2Cl-}(aq)⟶\ce{H2}(g)+\ce{Cl2}(g)+\ce{2OH-}(aq) \hspace{20px} E^\circ_\ce{cell}=\mathrm{−2.186\: V} \nonumber \]
У міру протікання реакції гідроксидні іони замінюють іони хлориду в розчині. Таким чином, гідроксид натрію можна отримати шляхом випаровування води після завершення електролізу. Гідроксид натрію цінний сам по собі і використовується для таких речей, як очищувач духовки, зливний сошник, а також у виробництві паперу, тканин та мила.
Гальванічне покриття
Важливе застосування для електролітичних елементів - в гальванічних покриттях. Гальванічне покриття призводить до тонкого покриття одного металу поверх провідної поверхні. Причини гальванічного покриття включають в себе зробити об'єкт більш стійким до корозії, зміцнення поверхні, отримання більш привабливої обробки або для очищення металу. Метали, які зазвичай використовуються в гальваніці, включають кадмій, хром, мідь, золото, нікель, срібло та олово. Поширені споживчі товари включають срібний або позолочений посуд, хромовані автомобільні деталі та ювелірні вироби. Ми можемо отримати уявлення про те, як це працює, досліджуючи, як виробляється посріблений посуд (рис.\(\PageIndex{3}\)).
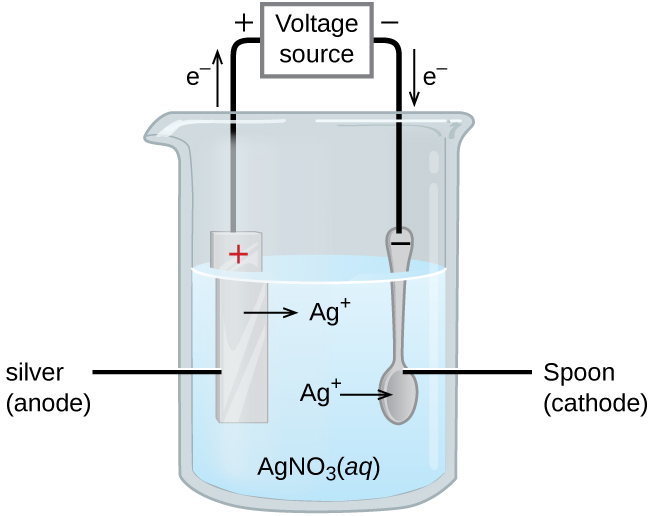
На малюнку анод складається з срібного електрода, показаного зліва. Катод розташований праворуч і являє собою ложку, яка виготовлена з недорогого металу. Обидва електроди занурені в розчин нітрату срібла. У міру збільшення потенціалу протікає струм. Срібний метал втрачається на аноді, коли він йде в розчин.
\[\textrm{anode: }\ce{Ag}(s)⟶\ce{Ag+}(aq)+\ce{e-} \nonumber \]
Маса катода збільшується в міру осадження іонів срібла з розчину на ложку.
\[\textrm{cathode: }\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s) \nonumber \]
Чистий результат - перенесення металу срібла з анода на катод. Якість предмета зазвичай визначається товщиною наплавленого срібла і швидкістю осадження.
Кількісні аспекти електролізу
Кількість струму, яке дозволено протікати в електролітичному елементі, пов'язане з кількістю молів електронів. Кількість молів електронів може бути пов'язане з реагентами і продуктами за допомогою стехіометрії. Нагадаємо, що одиницею СІ для струму (I) є ампер (А), що є еквівалентом 1 кулона в секунду (1 А =\(\mathrm{1\: \dfrac{C}{s}}\)). Загальний заряд (Q, в кулоні) задається
\[Q=I×t=n×F \nonumber \]
де
- t - час у секундах,
- n число молей електронів, а
- F - постійна Фарадея.
Молі електронів можуть бути використані в задачах стехіометрії. Час, необхідний для внесення певної кількості металу, також може бути запитаний, як у другому з наступних прикладів.
В одному процесі, використовуваному для гальваніки срібла, струм 10,23 А пропускали через електролітичну комірку рівно 1 годину. Скільки молей електронів пройшло крізь клітку? Яка маса срібла була відкладена на катоді з розчину нітрату срібла?
Рішення
Константа Фарадея може бути використана для перетворення заряду (Q) в молі електронів (n). Заряд - це струм (I), помножений на час
\[n=\dfrac{Q}{F}=\mathrm{\dfrac{\dfrac{10.23\: C}{s}×1\: hr×\dfrac{60\: min}{hr}×\dfrac{60\:s}{min}}{96,485\: C/mol\: e^-}=\dfrac{36,830\: C}{96,485\: C/mol\:e^-}=0.3817\: mol\: e^-} \nonumber \]
З задачі рішення містить AgNO 3, тому реакція на катоді включає 1 моль електронів на кожен моль срібла
\[\textrm{cathode: }\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s) \nonumber \]
Атомна маса срібла становить 107,9 г/моль, так
\[\mathrm{mass\: Ag=0.3817\: mol\: e^-×\dfrac{1\: mol\: Ag}{1\: mol\: e^-}×\dfrac{107.9\: g\: Ag}{1\: mol\: Ag}=41.19\: g\: Ag} \nonumber \]
Перевірте свою відповідь: З стехіометрії 1 моль електронів виробляв би 1 моль срібла. Було задіяно менше половини моля електронів і вироблено менше половини моля срібла.
Алюмінієвий метал може бути виготовлений з іонів алюмінію електролізом. Що таке полуреакція на катоді? Яку масу металу алюмінію було б відновлено, якби через розчин протягом 15,0 хвилин пройшов струм 2,50 × 10 3 А? Припустимо, що врожайність становить 100%.
- Відповідь
-
\(\ce{Al^3+}(aq)+\ce{3e-}⟶\ce{Al}(s)\); 7,77 моль Аль = 210,0 г Ал.
За одне застосування необхідно нанести 0,010-мм шар хрому на деталь загальною площею поверхні 3,3 м 2 з розчину містить іони хрому (III). Скільки часу знадобилося б, щоб осаджувати шар хрому, якщо струм становив 33,46 А? Щільність хрому (металу) становить 7,19 г/см 3.
Рішення Ця проблема приносить ряд тем, розглянутих раніше. Конспект того, що потрібно зробити, це:
- Якщо загальний заряд можна визначити, необхідний час - це лише заряд, розділений на струм
- Загальний заряд можна отримати з необхідної кількості Cr і стехіометрії
- Кількість Cr можна отримати, використовуючи щільність і необхідний обсяг Cr.
- Необхідний обсяг Cr - це товщина, помножена на площу
Рішення поетапно, і піклуючись про одиниці, необхідний обсяг Cr
\[\mathrm{volume=\left(0.010\: mm×\dfrac{1\: cm}{10\: mm}\right)×\left(3.3\:m^2×\left(\dfrac{10,000\:cm^2}{1\:m^2}\right)\right)=33\: cm^3} \nonumber \]
Кубічні сантиметри використовувалися, оскільки вони відповідають одиниці об'єму, використовуваної для щільності. Сума Cr тоді
\[\mathrm{mass=volume×density=33\cancel{cm^3}×\dfrac{7.19\: g}{\cancel{cm^3}}=237\: g\: Cr} \nonumber \]
\[\mathrm{mol\: Cr=237\: g\: Cr×\dfrac{1\: mol\: Cr}{52.00\: g\: Cr}=4.56\: mol\: Cr} \nonumber \]
Так як розчин містить іони хрому (III), на моль Cr потрібно 3 молі електронів. Загальна сума заряду тоді
\[Q=\mathrm{4.56\: mol\: Cr×\dfrac{3\:mol\: e^-}{1\: mol\: Cr}×\dfrac{96485\: C}{mol\: e^-}=1.32×10^6\:C} \nonumber \]
Час, необхідний тоді
\[t=\dfrac{Q}{I}=\mathrm{\dfrac{1.32×10^6\:C}{33.46\: C/s}=3.95×10^4\:s=11.0\: hr} \nonumber \]
Перевірте свою відповідь: У такій довгій проблемі однієї перевірки, ймовірно, недостатньо. Кожен з кроків дає розумну кількість, тому справи, ймовірно, вірні. Звертайте пильну увагу на перетворення одиниць і стехіометрії.
Яка маса цинку потрібно для оцинковки верху листа заліза 3,00 м × 5,50 м товщиною 0,100 мм цинку? Якщо цинк надходить з розчину Zn (NO 3) 2 і струм 25,5 А, скільки часу займе оцинковка верхньої частини заліза? Щільність цинку становить 7,140 г/см 3.
- Відповідь
-
На 231 г Zn потрібно 23 000 хвилин.
Резюме
Використання електрики для примусового неспонтанного процесу - це електроліз. Електролітичні клітини - це електрохімічні клітини з негативними потенціалами клітин (мається на увазі позитивна вільна енергія Гіббса), і тому є неспонтанними. Електроліз може відбуватися в електролітичних комірках шляхом введення джерела живлення, який постачає енергію, щоб змусити електрони текти в неспонтанному напрямку. Електроліз проводиться в розчині, в яких міститься достатня кількість іонів, щоб струм міг протікати. Якщо розчин містить тільки один матеріал, як електроліз розплавленого хлориду натрію, визначити, що окислюється, а що відновлюється, нескладно. У більш складних системах, таких як електроліз водного хлориду натрію, більше одного виду можуть окислюватися або відновлюватися, а стандартні відновні потенціали використовуються для визначення найбільш ймовірного окислення (напівреакція з найбільшим [найбільш позитивним] стандартним відновним потенціалом) і відновлення ( напівреакція з найменшим [найменш позитивним] стандартним відновним потенціалом). Іноді несподівані напівреакції виникають через надмірного потенціалу. Надпотенціал - це різниця між теоретичним потенціалом зниження напівреакції та фактичною необхідною напругою. Коли він присутній, застосований потенціал повинен бути збільшений, що робить можливим виникнення іншої реакції в електролітичній комірці. Загальний заряд, Q, який проходить через електролітичний елемент, може бути виражений у вигляді струму (I), помноженого на час (Q = It) або як молі електронів (n), помножені на постійну Фарадея (Q = nF). Ці відносини можуть бути використані для визначення таких речей, як кількість матеріалу, що використовується або генерується під час електролізу, як довго повинна тривати реакція або яке значення струму потрібно.
Резюме
- електролізу
- процес, використовуючи електричну енергію, щоб викликати неспонтанний процес
- електролітичний елемент
- електрохімічна комірка, в якій використовується електроліз; електрохімічна комірка з негативними потенціалами клітин
- гальванічного
- нанесення тонкого шару одного металу поверх провідної поверхні
- надлишковий потенціал
- різниця між теоретичним потенціалом та фактичним потенціалом в електролітичній комірці; «зайва» напруга, необхідна для того, щоб відбулася певна неспонтанна електрохімічна реакція
