12.1: Спонтанність
- Page ID
- 23712
Навички для розвитку
- Розрізняють спонтанні і неспонтанні процеси
- Опишіть розгін речовини і енергії, що супроводжує певні спонтанні процеси
У цьому розділі розглянемо відмінності між двома типами змін у системі: тими, що відбуваються спонтанно, та тими, що відбуваються силою. Роблячи це, ми отримаємо розуміння того, чому деякі системи природно схильні змінюватися в одному напрямку за певних умов і як відносно швидко чи повільно протікають природні зміни. Ми також отримаємо уявлення про те, як спонтанність процесу впливає на розподіл енергії та речовини всередині системи.
Спонтанні і неспонтанні процеси
Процеси мають природну тенденцію протікати в одному напрямку при заданому наборі умов. Вода природним чином буде стікати вниз, але в гору потік вимагає зовнішнього втручання, такого як використання насоса. Залізо, що піддається впливу земної атмосфери, буде роз'їдати, але іржа не перетворюється на залізо без навмисної хімічної обробки. Спонтанний процес - це той, який відбувається природним шляхом за певних умов. Неспонтанний процес, з іншого боку, не відбудеться, якщо він не буде «керований» постійним введенням енергії із зовнішнього джерела. Процес, який є спонтанним в одному напрямку при певному наборі умов є неспонтанним у зворотному напрямку. При кімнатній температурі і типовому атмосферному тиску, наприклад, лід буде мимовільно танути, але вода мимовільно не замерзне.
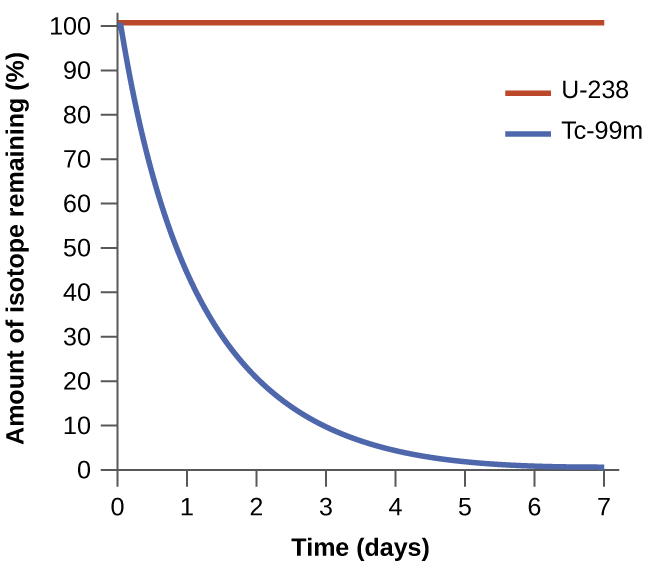
Спонтанність процесу не корелює зі швидкістю процесу. Спонтанна зміна може бути настільки швидкою, що вона по суті миттєва або настільки повільна, що її неможливо спостерігати протягом будь-якого практичного періоду часу. Щоб проілюструвати цю концепцію, розглянемо розпад радіоактивних ізотопів, тему більш ретельно розглянуту в розділі про ядерну хімію. Радіоактивний розпад - це за визначенням спонтанний процес, при якому ядра нестабільних ізотопів випромінюють випромінювання в міру перетворення в більш стабільні ядра. Всі процеси розпаду відбуваються спонтанно, але швидкості розпаду різних ізотопів різняться в широких межах. Technetium-99M є популярним радіоізотопом для медичних досліджень візуалізації, який зазнає відносно швидкого розпаду і демонструє період напіврозпаду близько шести годин. Уран-238 є найпоширенішим ізотопом урану, і його розпад відбувається набагато повільніше, проявляючи період напіврозпаду більше чотирьох мільярдів років (рис.\(\PageIndex{1}\)).
Як інший приклад розглянемо перетворення алмазу в графіт (рис.\(\PageIndex{2}\)).
\[\ce{C}_{(s,\textrm{ diamond})}⟶\ce{C}_{(s,\textrm{ graphite})} \label{Eq1}\]
Діаграма стану вуглецю вказує на те, що графіт є стабільною формою цього елемента під атмосферним тиском навколишнього середовища, тоді як алмаз є стабільним алотропом при дуже високих тисках, таких як ті, що присутні під час його геологічного формування. Термодинамічні розрахунки такого роду, описані в останньому розділі цієї глави, вказують на те, що перетворення алмазу в графіт при тиску навколишнього середовища відбувається спонтанно, проте алмази спостерігаються, як існують і зберігаються в цих умовах. Хоча процес є спонтанним в типових умовах навколишнього середовища, його швидкість надзвичайно повільна, і тому для всіх практичних цілей алмази дійсно «назавжди». Такі ситуації підкреслюють важливу відмінність між термодинамічним та кінетичним аспектами процесу. У цьому конкретному випадку алмази, як кажуть, термодинамічно нестабільні, але кінетично стабільні в умовах навколишнього середовища.
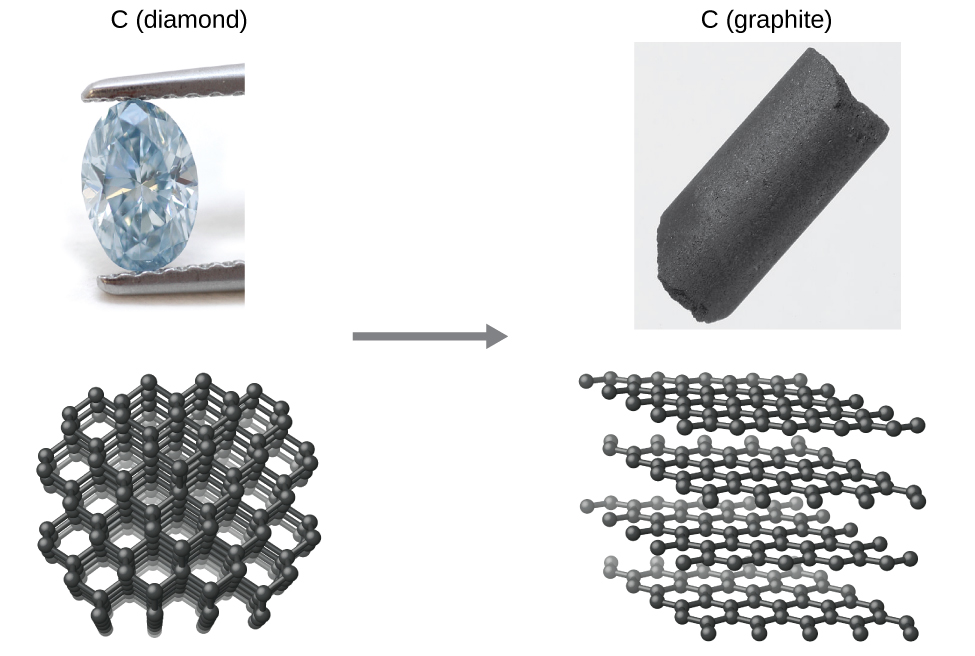
Малюнок\(\PageIndex{2}\):The conversion of carbon from the diamond allotrope to the graphite allotrope is spontaneous at ambient pressure, but its rate is immeasurably slow at low to moderate temperatures. This process is known as graphitization, and its rate can be increased to easily measurable values at temperatures in the 1000–2000 K range. (credit "diamond" photo: modification of work by "Fancy Diamonds"/Flickr; credit "graphite" photo: modificaton of work by images-of-elements.com/carbon.php)
Dispersal of Matter and Energy
As we extend our discussion of thermodynamic concepts toward the objective of predicting spontaneity, consider now an isolated system consisting of two flasks connected with a closed valve. Initially there is an ideal gas on the left and a vacuum on the right (Figure \(\PageIndex{3}\)). When the valve is opened, the gas spontaneously expands to fill both flasks. Recalling the definition of pressure-volume work from the chapter on thermochemistry, note that no work has been done because the pressure in a vacuum is zero.
\[w=−PΔV=0 \;\;\; \mathrm{(P=0\: in\: a\: vaccum)} \label{Eq2}\]
Note as well that since the system is isolated, no heat has been exchanged with the surroundings (q = 0). The first law of thermodynamics confirms that there has been no change in the system’s internal energy as a result of this process.
\[ΔU=q+w=0+0=0 \label{Eq3}\]
The spontaneity of this process is therefore not a consequence of any change in energy that accompanies the process. Instead, the driving force appears to be related to the greater, more uniform dispersal of matter that results when the gas is allowed to expand. Initially, the system was comprised of one flask containing matter and another flask containing nothing. After the spontaneous process took place, the matter was distributed both more widely (occupying twice its original volume) and more uniformly (present in equal amounts in each flask).
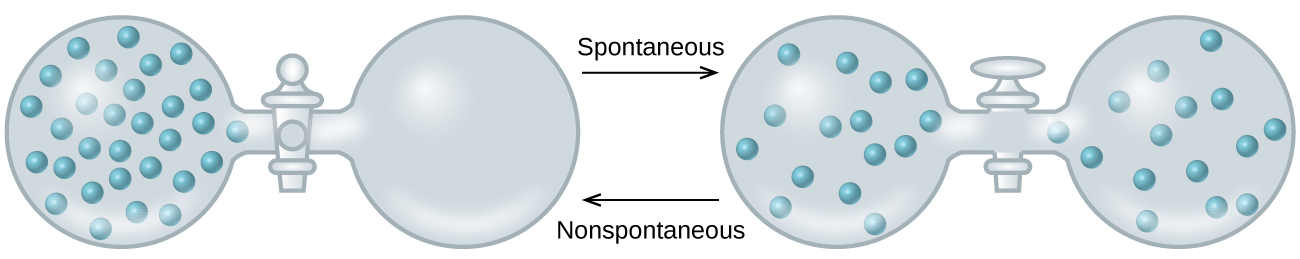
Малюнок\(\PageIndex{3}\):An isolated system consists of an ideal gas in one flask that is connected by a closed valve to a second flask containing a vacuum. Once the valve is opened, the gas spontaneously becomes evenly distributed between the flasks.
Now consider two objects at different temperatures: object X at temperature TX and object Y at temperature TY, with TX > TY (Figure \(\PageIndex{4}\)). When these objects come into contact, heat spontaneously flows from the hotter object (X) to the colder one (Y). This corresponds to a loss of thermal energy by X and a gain of thermal energy by Y.
\[q_\ce{X}<0 \hspace{20px} \ce{and} \hspace{20px} q_\ce{Y}=−q_\ce{X}>0 \label{Eq4}\]
From the perspective of this two-object system, there was no net gain or loss of thermal energy, rather the available thermal energy was redistributed among the two objects. This spontaneous process resulted in a more uniform dispersal of energy.

Малюнок: Коли\(\PageIndex{4}\) два об'єкти при різних температурах стикаються, тепло мимовільно перетікає від більш гарячого до більш холодного об'єкта.
Як ілюструють два описані процеси, важливим фактором у визначенні спонтанності процесу є ступінь, в якій він змінює розгін або розподіл речовини та/або енергії. У кожному конкретному випадку відбувався спонтанний процес, який приводив до більш рівномірного розподілу речовини або енергії.
Приклад\(\PageIndex{1}\): Перерозподіл матерії під час спонтанного процесу
Опишіть, як відбувається перерозподіл матерії, коли відбуваються такі спонтанні процеси:
- А тверді піднесені.
- А газ конденсується.
- Крапля харчового барвника, додана в склянку води, утворює розчин з рівномірним кольором.
Рішення

Малюнок\(\PageIndex{5}\) :( Кредит а: модифікація роботи Дженні Даунінг; кредит б: модифікація роботи «Нечіткий Гердес» /Flickr; кредит c: модифікація роботи Сахар Атва)
- (а) Сублімація - це перетворення твердого тіла (відносно високої щільності) в газ (набагато менша щільність). Цей процес дає набагато більший розгін речовини, так як молекули будуть займати набагато більший обсяг після переходу тверде тіло в газ.
- (b) Конденсація - це перетворення газу (відносно низької щільності) в рідину (набагато більша щільність). Цей процес дає набагато менший розгін речовини, так як молекули будуть займати набагато менший обсяг після переходу тверде тіло в газ.
- (c) Розглянутий процес - це розведення. Молекули харчового барвника спочатку займають набагато менший обсяг (крапля розчину барвника), ніж вони займають після завершення процесу (в повній склянці води). Таким чином, процес тягне за собою більший розгін матерії. Процес також може дати більш рівномірне розсіювання речовини, оскільки початковий стан системи включає дві області різної концентрації барвника (висока в краплі, нуль у воді), а кінцевий стан системи містить одну концентрацію барвника на всьому протязі.
Вправа\(\PageIndex{1}\)
Опишіть, як речовина і/або енергія перерозподіляється, коли ви спорожняєте каністру стисненого повітря в кімнату.
Відповідь:
Це також процес розведення, аналогічний прикладу (с). Це тягне за собою як більший, так і більш рівномірний розгін речовини, оскільки стисненому повітрю в каністрі дозволяється розширюватися в повітря з нижчим тиском приміщення.
Резюме
Хімічні і фізичні процеси мають природну тенденцію протікати в одному напрямку при певних умовах. Спонтанний процес відбувається без необхідності постійного введення енергії з якогось зовнішнього джерела, тоді як неспонтанний процес вимагає такого. Системи, що проходять спонтанний процес, можуть або не можуть відчувати посилення або втрату енергії, але вони відчують зміну способу розподілу матерії та/або енергії всередині системи.
Глосарій
- неспонтанний процес
- процес, який вимагає постійного введення енергії від зовнішнього джерела
- спонтанна зміна
- процес, який відбувається без безперервного надходження енергії від зовнішнього джерела
