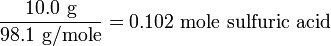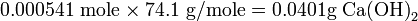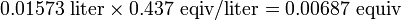2.1: Вступ
- Page ID
- 25729
-
Коли ви можете виміряти те, про що ви
говорите, і висловити це в цифрах,
ви знаєте щось про це; але коли
ви не можете виміряти це, коли ви не можете
виразити це в цифрах ваш знання є
мізерним і незадовільним; це може
бути початком знання, але ви навряд чи, в своїх думках,
просунулися
до стадії науки».Вільям Томсон, лорд Кельвін (1891)
Вступ
Поняття атомів сходить до грецьких філософів. Демокріт (470-360? b.c.) запропонував, що вся матерія складається з окремих, незнищуваних атомів, що різні види атомів мають різну структуру та поведінку, і що спостережувані властивості речовин виникають через те, як їх окремі атоми влаштовують себе та поєднуються один з одним. Його теорії по суті є примітивною версією матеріалу в главі 1. Чому ж тоді стародавні греки не використовували теорії Демокріта і продовжували розвивати атомну енергію? Чому минуло 2000 років, перш ніж почала розвиватися модемна наука?
Відповідь, значною мірою, полягає в тому, що греки не думали кількісно про атоми, і вони не були експериментаторами. Їх наука була філософським поясненням Всесвіту, а не прагматичним інструментом, за допомогою якого можна маніпулювати навколишнім світом. Дешева людська праця утримувала їх від необхідності турбуватися про розвиток наукової технології.
Грецький вчений Герон Олександрійський винайшов кілька парових механізмів, які могли б вести безпосередньо до парової машини, але використовував їх тільки як іграшки та новинки.
Атомна теорія Демокріта була стерильною, оскільки не призвела до кількісних прогнозів, які можна було перевірити. Він не зміг розвинутися поза абстрактними концепціями, оскільки не мав зворотного зв'язку від успішних та невдалих експериментів у реальному світі, щоб кинути виклик та вдосконалити його.
Наукова теорія, щоб бути корисною, повинна бути кількісною. Він повинен передбачити: «Якщо я це зроблю, то це станеться, і в тій мірі, яку я зможу обчислити заздалегідь». Таке передбачення є випробуваним. Це можна побачити правильним, підвищуючи нашу впевненість у теорії, що стоїть за нею; або що часто важливіше, це можна побачити як неправильне, змушуючи нас переглянути та вдосконалити теорію.
Наукові теорії ростуть шляхом постійного руйнування та відновлення. Теорія, яка не передбачає нічого, що можна було б перевірити, не передає жодної інформації і нічого не варта.
Важливість точного вимірювання маси в хімічних реакціях уникнула грецьких філософів. Тут також уникли середньовічні європейські алхіміки, металурги, і ятрохіміки (лікарські хіміки). Великий французький хімік Антуан Лавуазьє (1743-1794) першим зрозумів, що маса - це основна кількість, збережена під час хімічних реакцій.
Загальна маса всіх утворених виробів повинна бути точно такою ж, як і загальна маса вихідних матеріалів. Цим принципом Лавуазьє зруйнував давно прийняту флогістонську теорію тепла (див. Розділ 6), показавши, що коли речовина згорає, вона поєднується з іншим елементом, киснем, а не розкладається і виділяє загадкове універсальне речовина під назвою флогістон. Принцип збереження маси є наріжним каменем всієї хімії. Збережено більше, ніж просто загальна маса; однакова кількість кожного типу атома має бути присутнім як до, так і після хімічної реакції, незалежно від того, наскільки складним чином ці атоми можуть об'єднуватися і перебудовуватися в молекули.
Енергія також повинна бути збережена в хімічних реакціях. Для хіміка це означає, що тепло, яке поглинається або виділяється в певній хімічній реакції (теплота реакції), має бути однаковим незалежно від того, як ця реакція здійснюється - на одному етапі або в кілька. Наприклад, тепло, що виділяється при спалюванні водневого газу та графіту (форма вуглецю), повинно бути таким же, як і тепло, що виділяється, коли водень і вуглець використовуються для виготовлення синтетичного бензину, і цей бензин потім використовується як паливо для автомобільного двигуна.
Якщо тепло, що виділяється в двох варіаціях реакції, не було однаковим, то більш ефективна реакція може бути запущена в прямому напрямку, а менш ефективна може бути запущена в зворотному напрямку. Результатом буде циклічна піч без палива, яка виливала б нескінченну кількість тепла безкоштовно оператору. Схеми вічного руху всіх типів зникають, як тільки людина стає кількісною щодо тепла, енергії та роботи. Це основа термодинаміки, яка докладно висвітлена в главах 15-17.
У цьому розділі ми розглянемо наслідки для хімії двох принципів:
- Атоми не створюються і не руйнуються під час хімічних реакцій (збереження маси).
- Нагрівання реакції є адитивними. Якщо можна додати дві реакції, щоб дати третю, то теплота третьої реакції дорівнює сумі нагрівань перших двох реакцій (збереження енергії).
Обидва ці принципи спочатку можуть здатися очевидними, але вони також є досить потужними інструментами пояснення хімічної поведінки.
Атомні ваги, молекулярні ваги та молі
 Малюнок 2-1. Дві молекули газоподібного водню з'єднуються з однією молекулою кисню, утворюючи дві молекули води. Принцип Авогадро говорить нам, що рівні обсяги різних газів містять однакову кількість молекул, при заданій температурі і тиску. Звідси два об'єми газу Н 2 об'єднаються з одним об'ємом 0 2, щоб отримати два об'єми водяної пари, а два молі Н 2 об'єднаються з одним молем 0 2 для отримання двох молів водяної пари. Від Дікерсона та Гейса, хімії, матерії та Всесвіту
Малюнок 2-1. Дві молекули газоподібного водню з'єднуються з однією молекулою кисню, утворюючи дві молекули води. Принцип Авогадро говорить нам, що рівні обсяги різних газів містять однакову кількість молекул, при заданій температурі і тиску. Звідси два об'єми газу Н 2 об'єднаються з одним об'ємом 0 2, щоб отримати два об'єми водяної пари, а два молі Н 2 об'єднаються з одним молем 0 2 для отримання двох молів водяної пари. Від Дікерсона та Гейса, хімії, матерії та ВсесвітуЯк тільки хіміки зрозуміли, що маса - не обсяг, щільність або якесь інше вимірюване властивість - це фундаментальна властивість, яка зберігалася під час хімічних реакцій, вони почали намагатися встановити правильний масштаб атомних мас (атомних ваг) для всіх елементів. Як вони це зробили, описано в главі 6; результатом їх років роботи є таблиця природних атомних ваг на внутрішній задній обкладинці цієї книги. Як ми бачили в главі 1, молекулярні маси молекулярних сполук і формульні ваги немолекулярних сполук (таких як солі) знаходять шляхом додавання атомних мас всіх складових атомів.
Центральне місце у всіх хімічних розрахунках займає поняття крота. Як визначено в главі 1, моль будь-якої речовини - це кількість, яка містить стільки частинок речовини, скільки атомів рівно в 12 г вуглецю-12. Таким чином, моль речовини - це кількість в грамах, яка чисельно дорівнює його молекулярній масі, вираженої в одиницях атомної маси. Кількість частинок в молі називається числом Авогадро, а досліди Міллікана і Фарадея, описані в кінці глави 1, є одним із засобів встановлення його значення:
N = 6,022 Х 10 23 частинки моль -1
Кроти - це спосіб маніпулювання атомами або молекулами в пучках 6.022 X 10 23. Молекулярні ваги H 2, 0 2 та H 2 0 були розроблені в главі 1. Якщо ми знаємо, що дві молекули водневого газу, H 2, реагують з однією молекулою газу кисню, 0 2, щоб виробляти дві молекули води, H 2 0, то ми можемо передбачити, що 2 молі H 2, або 4,032 г, будуть реагувати з 1 моль 0 2, або 31,999 г, щоб отримати 2 родимки води, або 36.031 г (рис. 2-1). Перевірка додавання, 4.032 + 31,999 = 36.031, перевіряє збереження маси під час реакції. Хімік вимірює речовини в грамах, зважуючи їх.
І все ж більш значущим є перетворення цих величин з грамів в молі, тому що тоді людина працює з відносними молекулярними пропорціями, збільшеними рівномірним коефіцієнтом N.
Хімічні аналізи. Відсоток складу та емпіричні формули
Хімічний аналіз включає розщеплення речовини на його елементи, а потім вимірювання відносної кількості кожного присутнього елемента або в грамах на 100 г вихідної сполуки, або у відсотках за вагою. Одним із способів зробити це, якщо сполука є вуглеводнем (складається лише з вуглецю та водню), є спалювання відомої кількості речовини в кисні та вимірювання кількості C0 2 (вуглекислого газу) та H 2 0, що призводить.
Приклад 1
При спалюванні 25,00 г невідомого вуглеводню утворюється 68,58 г СО 2 і 56,15 г Н 2 0.
Скільки грамів вуглецю і водню містив оригінальний зразок?
Рішення
Атомна маса вуглецю становить 12,011 г моль -1, а молекулярна маса СО 2 - 44.010 г моль -1.
Спочатку знаходимо відсоток вуглецю в вуглекислому газу:
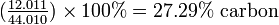
Якщо 27,29% СО 2 - вуглець, то кількість вуглецю в 68,58 г СО 2 буде

аналогічним розрахунком для водню у воді дає:


В якості чека: 18,72 г + 6,283 г = 25,00 г.
Приклад 2
Скільки грамів вуглецю і водню на 100,0 г зразка
у вуглеводні Приклад 1?
Рішення


 Малюнок 2-2. Сім різних молекул з емпіричною формулою CH. Простий елементний аналіз не міг їх розрізнити. Приблизна молекулярна маса може розрізняти C 2 H 2, C 4 H 4 і C 6 H 6, але ще більше інформації буде потрібно для ідентифікації конкретної присутньої молекули C 6 H 6.
Малюнок 2-2. Сім різних молекул з емпіричною формулою CH. Простий елементний аналіз не міг їх розрізнити. Приблизна молекулярна маса може розрізняти C 2 H 2, C 4 H 4 і C 6 H 6, але ще більше інформації буде потрібно для ідентифікації конкретної присутньої молекули C 6 H 6.Приклад 3
Який процентний склад за вагою вуглеводню в прикладі 1? Рішення


Приклад 4
Обчисліть відносну кількість атомів вуглецю та водню у вуглеводні з прикладу 3. Рішення
Найлегше працювати з 100,0 г речовини, тому процентні показники елементного складу стають грамами відповідних елементів. Спочатку ми ділимо кожну кількість вуглецю та водню на їх атомні ваги:


Це відносні числа молів вуглецю та водню, і саме тут стає корисним поняття кротів. Ці числа також повинні бути відносними числами oí атомів вуглецю і водню. На кожні 6,234 атома вуглецю в невідомому вуглеводні припадає 24,92 атома водню. Якщо ми шукаємо загальний коефіцієнт для цих двох чисел, ми бачимо, що вони знаходяться в співвідношенні 1:4. Розділивши обидва числа на нижнє число, 6.234, ми знаходимо, що для кожного атома вуглецю є
Приклад 5
Звичайною рідиною є 11,19% водню і 88,81% кисню по масі. Які відносні числа атомів водню і кисню? Рішення
Знову працюючи з 100,0 г речовини, обчислюємо кількість молей кожного елемента:
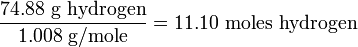

Розділивши обидва числа на менші, для пошуку загального фактора ми виявимо, що на кожен атом кисню припадає два атоми водню .
Елементного аналізу, сам по собі, недостатньо для визначення правильної молекулярної формули сполуки. Формула для метану - CH 4, яка підходила б під результати розрахунку в прикладі 4. Але аналітичні результати також були б сумісні з молекулами C 2 H 8, C 3 H 12 або C 4 H 16, якщо вони могли б існувати. Речовина в прикладі 5 може бути водою, H 2 0, але вона також може бути H 4 0 2 або деякою більшою кратністю. Якщо ви правильно визнаєте, що тільки CH 4 і H 2 0 є хімічно розумними, то ви приносите нести нову хімічну інформацію, якої немає тільки в аналітичних даних. Більшість хіміків припускають, що молекула в прикладі 6 була бензолом, C 6 H 6. Але це також може бути ацетилен, C 2 H 2 (за винятком того факту, що ацетилен є газом кімнатної температури, а невідомий вуглеводень, як кажуть, є звичайним лабораторним розчинником, який би виключити ацетилен) або будь-яка з п'яти інших менш поширених молекул вуглеводнів, показаних на малюнку 2-2 .Приклад 6
Загальний лабораторний розчинник, вуглеводень, складається з 92,26% вуглецю та 7,74% водню. Які відносні числа атомів вуглецю і водню в речовині? Рішення
Відповідь полягає в тому, що для кожного водню зустрічається один вуглець.
Хімічна формула, яка дає відносне число кожного типу атома, як цілих чисел без загального фактора, називається емпіричною формулою речовини. Це емпірична формула, яка є результатом елементарного аналізу речовини, а не молекулярної формули, яка може бути такою ж, як емпірична формула, або може бути деякою інтегральною кратною її. Емпірична формула така ж, як і молекулярна формула для метану, CH 4, а для води - H 2 O; емпіричні формули ацетилену і бензолу - обидва CH, але молекулярними формулами є C 2 H 2 і C 6 H 6 відповідно. Часто трапляється, що якесь просте фізичне вимірювання може дати грубе наближення молекулярної маси речовини. У цьому плані корисні щільності газу (глава 3), депресія точки замерзання та вимірювання осмотичного тиску (глава 18). Якщо така приблизна молекулярна маса є, то її можна використовувати разом з емпіричною формулою для вирішення істинної молекулярної формули.
Приклад 7
Глюкоза становить 40,00% вуглецю за вагою, 6,71% водню та 53,29% кисню. Яка його емпірична формула, і яка його молекулярна формула? Рішення
Працюючи з 100,0 г глюкози, ми спочатку знаходимо кількість молів кожного елемента:



Це, очевидно, молярне співвідношення одного вуглецю до двох воднів до одного кисню, тому емпірична формула - CH З наданою інформацією ми не маємо ніякого способу дізнатися, чи є це, чи деяка кратна цьому, справжньою молекулярною формулою.Приклад 8
З інших експериментів ми знаємо, що глюкоза має молекулярну масу приблизно 175 г моль -1. Використовуйте цю інформацію та результати Прикладу 7, щоб знайти молекулярну формулу та точну молекулярну масу глюкози. Рішення
Вага, що відповідає емпіричній формулі:

Приблизна молекулярна маса приблизно в шість разів перевищує цю величину, тому точна молекулярна маса є,

а молекулярна формула - C 6 H 12 0 6.Хімічні рівняння. Рівняння балансування та збереження маси
Коли пропан газ, С 3 Н 8, спалюється в кисні, продуктами є вуглекислий газ і вода. Це можна записати як хімічне рівняння:
C3H8 + O2 → CO2 + H2O (2-1)
Якби хімія не була кількісною наукою, то цей опис реакції, що ідентифікує як реагенти, так і продукти, було б адекватним. Але ми очікуємо більшого від хімічного рівняння. Скільки молекул кисню потрібно на молекулу пропану, і скільки молекул вуглекислого газу і води в результаті? Рівняння 2-1 - незбалансоване рівняння. Коли ми додамо числові коефіцієнти (розміщені зліва від формули), які говорять про те, скільки кожного виду молекул задіяно, тоді на лівій і правій стороні рівняння буде однакова кількість кожного виду атомів, оскільки атоми не створюються і не руйнуються в хімічній реакції. В результаті вийде збалансоване рівняння.
Щоб збалансувати рівняння 2-1, відзначимо спочатку, що 3 атоми вуглецю зліва призведуть до 3 молекул CO 2 як продуктів, кожна з яких потребує 2 атомів кисню або всього 6 кисню. Аналогічно, 8 атомів водню в пропані вироблять 4 молекули води, що вимагає ще 4 атомів кисню. Це всього 10 кисню праворуч повинно надходити від 5 молекул 0 2. Отже, правильні коефіцієнти для чотирьох речовин у рівнянні 2-1 становлять 1,5,3 та 4:
C3H8 + 5 O2 → 3 CO2 + 4 H2O (2-2)
Кожна сторона цього збалансованого рівняння містить 3 атоми вуглецю, 8 атомів водню та 10 атомів кисню.
Приклад 9
Тринітротолуол (тротил), C 7 H 5 N 3 O 6, бурхливо поєднується з киснем для отримання CO 2, води та N 2. Напишіть збалансоване хімічне рівняння для вибуху. Рішення
Незбалансоване рівняння
- С 7 Н 5 Н 3 0 6 + О 2 → С0 2 + Н 2 О + Н 2 О + Н 2
Так як зліва є непарні числа атомів водню і азоту, а праворуч - парні числа, то буде легше збалансувати рівняння на основі двох молекул тротилу:
- 2 С 7 Н 5 Н 3 О 6 + О 2 → СО 2 + Н 2 О + Н 2 О + Н 2
Вуглець 14, 10 водню та 6 азотів призведе до 14 вуглекислого газу, 5 води та 3 молекул азоту:
- 2 С 7 Н 5 Н 3 0 6 + О 2 → 14 СО 2 + 5 Н 2 О + 3 Н 2 Н 2
Тепер усі атоми збалансовані по лівій і правій сторонам рівняння, крім кисню. З 33 кисню праворуч 12 забезпечуються зліва 2 стартовими молекулами тротилу, а 21 повинен подаватися
 0 2. Остаточне, збалансоване рівняння
0 2. Остаточне, збалансоване рівняння- 2 С 7 Н 5 Н 3 0 6 + 10
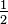 О 2 → 14 СО 2 + 5 Н 2 О + 3 Н 2 Н 2
О 2 → 14 СО 2 + 5 Н 2 О + 3 Н 2 Н 2
Приклад 9 призвів до рівняння з дробовим коефіцієнтом для кисню. Це можна прибрати, помноживши всі коефіцієнти з обох сторін на 2:
4 C7H5N3O6 + 21 O2 -> 28 CO2 + 10 H2O + 6 N2 (2-3)
але це необов'язково, так як немає причин, чому всі коефіцієнти повинні бути цілими числами. Було б навіть правильно базувати рівняння на одній молекулі тротилу:
C7H5N3O6 + 21/4 O2 → 7 CO2 + 5/2 H2O + 3/2 N2 (2-4)
Збалансоване хімічне рівняння, таке як рівняння 2-3, має кілька рівнів значення. Найпростіше, в ньому описуються вихідні матеріали і вироби. Це також говорить нам, що кількість кожного виду атома, що вступає в реакцію, таке ж, як і число, що йде. Кожен тип атома окремо зберігається під час реакції. Рівняння 2-3 також є твердженням, що на кожні 4 молекули тротилу потрібно 21 молекула кисню, а продукти - 28 молекул СО 2, 10 молекул води і 6 молекул N 2. Масштабування реакції до коефіцієнта 6.022 X 10 23 для переходу від молекул до молів, 4 молі тротилу реагують з 21 молями O 2 з утворенням 28 молів CO 2, 10 молів H 2 O і 6 молів N 2. Окремі молекулярні ваги
С 7 Ч 5 Н 3 З 6 227.13 г моль -1 О 2 31.999 г моль -1 СО 2 44.010 г моль -1 Н 2 О 18.015 г моль -1 N 2 28.013 г моль -1 Звідси рівняння 2-3 також говорить нам, що 4 Х 227,13 г = 908,52 г тротилу вимагає 21 X 31,999 г = 671,98 г кисню для повної реакції. Це також говорить нам, що продукти будуть
28 Х 44.010 г = 1232,3 г СО 2 10 Х 18.015 г = 180,15 г Н 2 О 6 х 28.013 г = 168,08 г N 2
Ми можемо перевірити, що маса дійсно збережена:
Реагенти: 908,52 г + 671,98 г = 1580,5 г Продукти: 1232,3 г + 180,15 г + 16,08 г = 1580,5 г
Те, що збалансоване хімічне рівняння не говорить нам, - це молекулярний механізм або хід подій, за допомогою яких відбувається реакція. Рівняння 2-3 не слід тлумачити як припущення про те, що 4 молекули тротила повинні стикатися одночасно з 21 молекулою кисню. Навіть зіткнення трьох тіл настільки рідкісні, ніж зіткнення двох тіл, що їх можна відхилити від розгляду в більшості хімічних реакцій. Може відбутися складна серія окремих кроків, якщо загальна чиста реакція була описана правильно рівнянням 2-3 або рівнянням 2-4.
Реагенти і продукти не повинні бути молекулами:
CaCO3 + 2 HCl → CaCl2 + CO2 + H2O (2-5)
Рівняння 2-5 описує реакцію CaCo 3, карбонату кальцію (вапняку) та HCl, соляної кислоти, для отримання водного розчину хлориду кальцію, CaCl 2 та вуглекислого газу. Рівняння збалансоване, тому що число кожного типу атома однакове з обох сторін. Молярний сенс зрозумілий: на 1 моль або 100.09 г карбонату кальцію потрібно 2 моль або 72,92 г соляної кислоти для повної реакції, а продукти будуть по 1 моль кожного хлориду кальцію (110,99 г моль -1), вуглекислого газу (44.01 г моль -1) і води (18,02 г моль -1) ). За цими цифрами можна переконатися, що маса зберігається під час реакції. Молекулярна інтерпретація менш проста, оскільки карбонат кальцію - це сіль, а не молекулярна сполука, Рівняння 2-5 не слід приймати як означає, що одна молекула карбонату кальцію реагує з двома молекулами HCl. Хоча HCl існує як дискретні молекули в газовій фазі, в розчині молекули дисоціюють на H+ і Cl- іони. Краще наближення того, що насправді відбувається на молекулярному рівні
CaCO3(s) + 2 H+(aq) → Ca2+(aq) + CO2(g) + H2O(l) (2-6)
Букви в дужках описують фізичний стан кожного виду (s, твердий; aq, гідратований іон у водному розчині; г, газ; л, рідина). Це рівняння говорить про те, що твердий карбонат кальцію реагує з двома гідратованими протонами (іонами водню) у водному розчині з отриманням гідратованих іонів кальцію, газоподібного вуглекислого газу та рідкої води. Хлоридні іони залишаються як гідратовані іони хлориду в розчині до і після реакції; отже, вони опущені з рівняння. Рівняння 2-5, як і інші збалансовані хімічні рівняння, є найбільш корисним для опису кількості задіяних матеріалів, а не молекулярного механізму реакції. Рівняння 2-6, хоча і кращий опис того, що відбувається на рівні атомів і іонів, менш корисно для відстеження кількості речовини, що беруть участь.
приклад 10
Металевий натрій вступає в реакцію з водою з отриманням газоподібного водню і розчину гідроксиду натрію (суміш Na + і OH - іонів). Напишіть (а) збалансоване рівняння для загальної реакції та (б) рівняння, яке точніше описує фактичні атомні або іонні види, присутні. Рішення
Збалансоване рівняння
- На + Н 2 О → 1/2 Н 2 + НаО
або
- 2 На + 2 Н 2 О → Н 2 + 2 НаО
Кращим описом того, що насправді присутнє, було б
- 2 Na (s) + 2 Н 2 О (л) → Н 2 (г) + 2 Na + (aq) + 2 ОН - (ак)
Розрахунки врожайності реакцій
Збалансовані хімічні рівняння в основному використовуються для розрахунку очікуваного виходу (кількості продукту) від реакції та визначення того, чи залишиться будь-який з реагентів невикористаним, коли інші реагенти виснажуються.
В якості перевірки на арифметику зверніть увагу, що 100,0 г вуглецю і 8,4 г водню об'єднуються з отриманням 108,4 г бензолу. Знову ж таки, маса консервується під час хімічної реакції.Приклад 11
Скільки грам водню потрібно з'єднати з 100,0 г вуглецю
зробити бензол, С 6 Н 6? Скільки молів і скільки грам бензолу буде вироблено?
Рішення
Збалансоване рівняння для реакції дорівнює
- 6 С+ 3 Н 2 → С 2 Н 6
Кількість молів присутнього вуглецю є

Збалансоване рівняння говорить нам, що вдвічі менше молів H 2 потрібно, як молі C, тому нам потрібно 4,163 молі H 2

Молекулярна маса бензол становить
(6 Х 12,011 г) + (6 Х 1,008 г) = 78,11 г моль -1
одна шоста стільки молів бензолу утворюється як молі вуглецю, що використовується, або 8,326/6 = 1,388 моль бензолу. Звідси кількість виробленого бензолу становить

Приклад 12
Скільки грам сульфіду срібла (Ag 2 S) може утворитися в результаті реакції
- 2Аг + S → Вік 2 С
якщо почати з 10.00 г срібла (Ag) і 1,00 г сірки (S)? Який вихідний матеріал, якщо такий є, залишиться, і скільки?
Рішення
-
Реакція: 2 Вік +S → Вік 2 Сх Маси: 215,7 г + 32.06 г = 247,8 г
Кількість сірки, необхідної для реакції з 10,00 г срібла, становить

Але у нас є лише 1,00 г сірки, тому не все срібло може реагувати. Повертаючи проблему, кількість срібла, необхідного для реагування з 1,00 г сірки,

отже, залишиться. Кількість виробленого сульфіду срібла становитиме
залишиться. Кількість виробленого сульфіду срібла становитиме
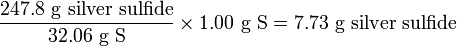
Зверніть увагу, що приклад 12 працював по-іншому: спочатку загальні маси всіх реагентів і продуктів були записані під збалансованим хімічним рівнянням, а потім були розроблені співвідношення цих мас, щоб знайти бажані відповіді. Проблему можна вирішити і за допомогою кротів, і вибір один з зручностей.
Альтернативне рішення
Спочатку знаходимо кількість родимок срібла і сірки:


Оскільки на кожну моль сірки потрібно 2 молі срібла, а родимок срібла в два рази більше, ніж родимок сірки, частина срібла потрібно залишити позаду коли вся сірка була використана. 0,0312 моль сірки з'єднається з 0,0624 моль срібла, а з 0,0312 моль Ag 2 S. залишився позаду 0,0927 - 0,0624 = 0,0303 моль срібла. Переклавши ці кількості назад в грами,


ми прийшли до тих же відповідей в першому рішенні до прикладу. Метод крота вірніше, але повільніше. Метод співвідношення швидший, але ви можете легше збитися, якщо ви не зовсім впевнені в тому, що робите. Використовуйте метод кротів, поки не будете володіти хімічними розрахунками.Розчини як хімічні реагенти
Рідкі розчини є зручним середовищем для хімічних реакцій. Швидке перемішування рідини означає, що потенційні реагенти часто наближаються один до одного, тому зіткнення та хімічні реакції можуть відбуватися набагато швидше, ніж у кристалічній твердій речовині. Більше того, задана кількість молекул у рідині обмежена меншим простором, ніж така ж кількість молекул у газі, тому молекули реагентів у рідині мають більше шансів вступити в контакт. Вода є особливо хорошим розчинником для хімічних реакцій, оскільки її молекули полярні. Молекули Н 2 О, а також H + і OH - іони, в які вода дисоціює в невеликій мірі, можуть допомогти поляризувати зв'язки в інших молекулах, послабити зв'язки і стимулювати хімічну атаку. Не випадково життя еволюціонувало в океанах, а не у верхній атмосфері або на суші. Якби життя було змушене розвиватися за допомогою твердотільних кристалічних реакцій, то 4,5 мільярда років земної історії на сьогоднішній день навряд чи вистачило б часу для початку процесу.
Одиниці концентрації: молярність і молярність
У розчині, в яких беруть участь рідина і газ або тверда речовина, рідкий компонент називається розчинником, а інший компонент - розчиненою речовиною. Якщо розчин складається з двох рідин, відмінність менш чітка, але речовина, присутня у більшій кількості, зазвичай розглядається як розчинник. Найпоширенішим способом вираження концентрації в розчині є молярність, або кількість молів розчиненої речовини на літр розчину. [1] Символ М читається як «молі на літр розчину», як у 1,5 М NaCl. Символ c використовується для позначення концентрації в молі на літр, як і хімічний символ в дужках [H], хоча такі дужки іноді використовуються для представлення концентрації в будь-яких одиницях. Звідси вираз c NaC1 буде читатися як «концентрація хлориду натрію в молі на літр розчину». Це не той розчин, який вийшов би в результаті додавання 1 моль NaCl в літр води, так як загальний обсяг після змішування становив би трохи більше 1 літра. Іони натрію і хлориду займають приміщення, навіть при розчиненні у воді. Правильною процедурою при виготовленні 1,0 М розчину було б розчинити сіль менш ніж в літрі води, а потім повільно додати більше води, при перемішуванні, поки загальний обсяг не досягне 1,00 літра.
Для багатьох солей ми можемо використовувати наближення, що обсяги є добавкою, або що обсяг розчину буде дорівнює початковому об'єму розчинника плюс обсяг кристалів, які були розчинені.
Приклад 13
Якщо 264 г сульфату амонію, (NH 4) 2 SO 4, розчинити в 1.000 л води, яким буде приблизний кінцевий обсяг і приблизна молярність розчину, припускаючи адитивність обсягів? Щільність кристалічних (NH 4) 2 SO 4 становить 1,76 г мл -1. Рішення
Обсяг твердого сульфату амонію
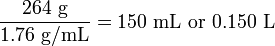
, що додається, становить кінцевий обсяг розчину тоді складе 1,000 + 0,150 = 1,150 л. Кількість молів розчиненої речовини -
молярність сульфату амонію тоді становить
Апроксимація адитивності обсягів повинна застосовуватися з обережністю. В даному прикладі справжня молярність такого розчину дорівнює 1,80 М, тому наближення становить лише 3,3% в похибці. Але для рідин, молекули яких сильно взаємодіють, таких як етиловий спирт і вода, загальний обсяг може скорочуватися після змішування через молекулярних атракціонів. Аддиктивність обсягів повинна використовуватися тільки як приблизний орієнтир до молярності.
Альтернативне вираження концентрації, моляльність, базується на кількості використовуваного розчинника, а не розчину, який призводить. Молярність розчиненої речовини - це кількість молей розчиненої речовини в 1 кг розчинника (не розчину). Щільність води становить 1,00 г мл -1, тому 1 кг води займає обсяг 1 літр. Звідси розчин сульфату амонію Приклад 13 являє собою 2,00 моляль розчин, так як він складався з 2,00 моль розчиненої речовини в кілограмі (1 літрі) води. Для розчинників, відмінних від води, ми повинні використовувати щільність рідини для перетворення з кілограмів в літри.
Приклад 14
Припустимо, 5,00 г оцтової кислоти, С 2 Н 4 О 2, розчиняють в 1 л етанолу.
Розрахуйте молярність отриманого розчину. Щільність етанолу становить 0,789 г мл -1. Чи можете ви обчислити молярність за наданою інформацією?
Рішення
Молекулярна маса оцтової кислоти становить 60,05 г моль -1, тому кількість молів дорівнює

Кількість кілограмів використовуваного розчинника

Зверніть увагу, що 1 г мл -1 дорівнює 1 кг літр -1 , Так як 1000 г в кілограмі і 1000 мл в літрі. Молярність тоді є Розчин

, таким чином, 0.106 мол. Молярність розчину неможливо розрахувати, оскільки ми не знаємо ні обсягу оцтової кислоти, ні того, чи є обсяги добавки при розчиненні оцтової кислоти в етанолі.Символ m використовується для концентрації, вираженої як моляльність. Ми б написали результати Прикладу 14 як
- м оцтової кислоти = 0,106 моль кг -1
Проблеми з розведенням
Якщо розвести розчин (додати більше розчинника), то кількість молів розчиненої речовини не змінюється. Якщо c - молярність (НЕ молярність) розчину, а V - обсяг в літрах, то кількість молів розчиненої речовини дорівнює
- c (молі літр -1) X V (літри) = cV (молі)
Якщо ми використовуємо індекс 1 для представлення розчину перед його розведенням більшою кількістю розчинника, а індекс 2 для розведеного розчину, то
- Молі розчиненої речовини = c l V l = c 2 V 2
Приклад 15
До якого обсягу необхідно розвести 5,00 мл 6,00 М HCl, щоб зробити концентрацію 0.100 M? Рішення
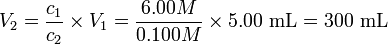
Це не означає, що необхідно додати 300 мл води, а що загальний обсяг розчину необхідно довести до 300 мл.Приклад 16
Якщо 175 мл 2,00 М розчину розвести до 1,00 л, якою буде молярність? Рішення

Кислотно-лужна нейтралізація
Ймовірно, найвідомішим визначенням кислот і основ є те, що шведський фізик і хімік Сванте Арреніус (1859-1927): Кислота - це речовина, яка збільшує концентрацію іонів водню, [H +] при додаванні до води, а основа - речовина, яка збільшує гідроксид-іон концентрації, [ОН -], при додаванні в воду. Деякі з найбільш поширених кислот і підстав наведені в таблицях 2-1 і 2-2. Перші 11 кислот в таблиці 2-1, від HF до HNO 3, дисоціюють у водному розчині з виділенням одного протона або іона водню:
-
HNO 3 → Н + (ак) + НІ 3 - (aq) азотна
кислотанітрат
іон
Таблиця 2-1. Загальні кислоти
HF плавикова HCl Соляна ХКЛО Хлорнуватиста ХЛО 2 Хлорнуватий ХЛО 3 Хлористий ХЛО 4 хлорнокислий HBr гідробромних Бро 3 Бромової ПРИВІТ гідройодний HNO 2 Азот НЕМАЄ 3 Азотний Н 2 СО 3 Вуглекислий Н 2 ТАК 3 Сірчисті Н 2 ТАК 4 Сірчана Н 3 ПОЗ 2 Гіпофосфор Н 3 ПОЗ 3 Фосфор Н 3 ПОЗ 4 Фосфорна Н 3 БО 3 Борна ХОХОХ Мурашиний СН 3 СООН Оцтова Таблиця 2-2. Загальні основи
ЛеО гідроксид літію NaOH Гідроксид натрію Мг (ОН) 2 Гідроксид магнію Са (ОН) 2 гідроксид кальцію Ба (ОН) 2 гідроксид барію NH 3 Аміак Абревіатура (aq) - це нагадування про те, що іони гідратовані, але це насправді не потрібно, оскільки кожен іон у водному розчині гідратований, і ми опустимо його в решті цієї дискусії. Пам'ятайте, що молекули води завжди присутні, оточуючи кожен іон і допомагаючи стабілізувати його в розчині. Вуглекислі, сірчані та сірчані кислоти виділяють два протони в дві стадії, а три фосфорсодержащие кислоти виробляють три протони:
-
Н 2 СО 3 → Н + ГСО 3 - → 2 Н + СО 3 2- вугільна кислота Н 2 СО 4 → Н + ГСО 4 - → 2 Н + СО 4 2- сірчана кислота Н 3 РО 4 → Н + Н + Н 2 РО 4 - → 2 Н + ГПО 4 2- → 3 Н + РО 4 3- фосфорна кислота
Вугільна кислота класифікується як слабка кислота, оскільки її втрата протонів є лише частковою; види, присутні у водному розчині, є сумішшю карбонатних і бікарбонатних іонів та невеликої кількості недисоційованої вугільної кислоти. На відміну від цього, сірчана кислота є сильною кислотою, оскільки втрата першого з двох Н+ повна у водному розчині. (Кислотно-дисоціаційні рівноваги детально розглянуті в главі 5.) Азотна і соляна кислоти є загальними сильними кислотами, а фосфорна - слабкою. Органічні кислоти, такі як мурашина та оцтова, виділяють протон зі своїх карбоксильних груп —COOH:
-
СН 3 СООН → СН 3 СОО - + Н + оцтова кислота ацетат іон
Загальноприйнято використовувати абревіатуру HoAC для оцтової кислоти і ОАК - для ацетатного іона.
Гідроксидні основи, такі як гідроксид натрію та гідроксид магнію, розчиняються у воді, виділяючи гідроксидні
-
Анох → Na + ОН - Мг (ОН) 2 → Мг 2+ 2 ОН -
Гідроксидні іони вже присутні в твердому NaOH, так само, як іони хлориду присутні в NaCl. Аміак, NH 3, також є основою, але він не має власних гідроксидних іонів. Натомість він виробляє їх, реагуючи з молекулами води:
-
NH 3 + Н 2 О → NH 4 + + ОХ - нашатирний спирт
іон амонію
гідроксид-іон
Аміак іноді пишеться як гідроксид амонію, NH 4 OH, щоб він нагадував основи гідроксиду металів (наприклад, гідроксид натрію, NaOH). Але це неправильно; немає такої речовини, як гідроксид амонію, є тільки аміак.
Кислоти та основи корисні, оскільки H + та OH - іони, які вони виробляють, можуть атакувати молекули в розчині та спричиняти хімічні зміни, які були б важкими або повільними за їх відсутності. Коли кислоти і основи вступають в реакцію один з одним, Іони Н + і ОН - об'єднуються, утворюючи молекули води. Це називається нейтралізацією:
- Н + ОН - → Н 2 О
Найпростіший спосіб визначити, скільки кислоти або основи присутній, - це з'ясувати, скільки основи або кислоти відомої концентрації потрібно для її повної нейтралізації. Це процес кислотно-лужного титрування. Один еквівалент (еквівалент) кислоти - це кількість кислоти, яка вивільнить 1 моль протонів або H + при нейтралізації основи, а 1 екв основи - це кількість, яка буде виробляти 1 моль OH - іонів. Повна нейтралізація відбувається, коли однакова кількість еквівалентів кислоти і основи вступають в реакцію один з одним. Для кислот, які виділяють один протон на молекулу, таких як HCl і HNO 3, еквівалент такий же, як моль, а 1 еквівалентна маса така ж, як молекулярна маса. Але так як Н 2 SO 4 здатний виділяти два іони Н +, 1 моль H 2 SO 4 відповідає 2 еквив, а еквівалентна маса сірчаної кислоти при кислотно-лужних нейтралізаціях становить половину молекулярної маси. Еквівалентна маса фосфорної кислоти, H 3 PO 4, або кількість, яка буде виробляти 1 моль іонів H +, становить третину молекулярної маси. Аналогічно, моль і еквівалент ідентичні для NaOH, KOH і NH 3, але еквівалентна вага Ca (OH) 2 становить половину його молекулярної маси. Оцінити корисність поняття еквівалентів можна, подивившись на нейтралізацію фосфорної кислоти гідроксидом магнію:
-
2 Ч 3 ПОЗ 4 + 3 Мг (ОН) 2 → Мг 3 (РО 4) 2 + 6 Ч 2 О Молекулярна маса: 98,0 г 58,3 г 262,9 г 18,0 г Еквівалентна вага: 32,7 г 29,2 г
Один моль або 98,0 г фосфорної кислоти не нейтралізують 1 моль або 58,3 г гідроксиду магнію, але 1 екв або 32,7 г фосфорної кислоти нейтралізує 1 екв або 29,2 г гідроксиду магнію. Це та сама відповідь, яка була б отримана за допомогою показаного збалансованого рівняння. Оскільки 2 молі кислоти вступають в реакцію з 3 молями основи, як показано, 2 Х 98,0 = 196 г фосфорної кислоти нейтралізують 3 Х 58,3 = 175 г гідроксиду магнію. Ці числа є лише числами, отриманими за допомогою еквівалентів, але збільшені в 6 разів.
Приклад 17
Використовуйте еквіваленти, щоб знайти кількість грамів азотної кислоти, HNO 3, необхідної для нейтралізації 100,0 г гідроксиду барію, Ba (OH) 2. Рішення
Молекулярна маса HNO 3 становить 63.01 г моль -1; Ba (OH) 2, 171,34 г моль -1. Відповідні еквівалентні ваги 63,01/1 = 63.01 г еквівалент -1 для HNO 3, і 171,34/2 = 85,67 г еквівалент -1 для Ba (OH) 2. Кількість еквівалентів гідроксиду барію становить
Потрібно стільки ж еквівалентів азотної кислоти:
Альтернативне рішення
Цей приклад можна також вирішити за допомогою збалансованого хімічного рівняння:
- 2 HNO 3 + Ба (ОН) 2 → Ба (НІ 3) 2 + 2 Н 2 О
Кількість молів гідроксиду барію на старті становить
Збалансоване рівняння говорить нам, що потрібно вдвічі більше молів азотної кислоти: 1,167 моль HNO 3. У грамах це
Використання еквівалентів позбавляє від необхідності вироблення збалансованого рівняння реакції.
Нормальність розчину, представленого N, - це кількість еквівалентів розчиненої речовини на літр розчину. 1,00 М розчину фосфорної кислоти становить 3,00 Н, а 0,010 М розчину Са (ОН) 2 - 0,020 Н.
Приклад 18
Якщо 4,00 г гідроксиду натрію розчинено у воді, а обсяг дорівнює
довести до 500 мл, знайти молярність і нормальність розчину.
Рішення
Оскільки молекулярна маса NaOH становить 40,0 г моль -1,
Оскільки 1 моль NaOH виділяє 1 моль ОН - іонів, молярність і нормальність однакові. Розчин становить 0,200 Н.
Приклад 19
Якщо 10,0 г сірчаної кислоти (H 2 SO 4) змішати повільно з достатньою кількістю води, щоб вийшов кінцевий обсяг 750 мл, які молярність і нормальність отриманого розчину? Рішення
Оскільки молекулярна маса NaOH становить 40,0 г моль -1,
Так як кожна моль сірчаної кислоти вносить 2 екві, то розчин
Кислотно-лужне титрування
 Малюнок 2-3. Кислотно-лужний титрування. Розчин в колбі містить невідому кількість еквівалентів основи (або кислоти). Бюретка калібрується, щоб показати об'єм до найближчого 0,001 см 3. Його заливають розчином сильної кислоти (або основи) відомої концентрації. Невеликі збільшення додаються від бюретки до тих пір, поки в кінцевій точці одна крапля або менше не змінює колір індикатора постійно. (Ознакою того, що точка еквівалентності наближається, є поява - і зникнення при перемішуванні - кольору, який індикатор приймає поза нейтралізацією.) У точці еквівалентності за показаннями бюретки записується загальна кількість кислоти (або основи). Кількість еквівалентів кислоти і основи має бути рівним в точці еквівалентності.
Малюнок 2-3. Кислотно-лужний титрування. Розчин в колбі містить невідому кількість еквівалентів основи (або кислоти). Бюретка калібрується, щоб показати об'єм до найближчого 0,001 см 3. Його заливають розчином сильної кислоти (або основи) відомої концентрації. Невеликі збільшення додаються від бюретки до тих пір, поки в кінцевій точці одна крапля або менше не змінює колір індикатора постійно. (Ознакою того, що точка еквівалентності наближається, є поява - і зникнення при перемішуванні - кольору, який індикатор приймає поза нейтралізацією.) У точці еквівалентності за показаннями бюретки записується загальна кількість кислоти (або основи). Кількість еквівалентів кислоти і основи має бути рівним в точці еквівалентності.Хіміки часто використовують титрування для порівняння відносних концентрацій хімічних еквівалентів у кислотно-основних розчинях (рис. 2-3). Коли додано достатню кількість кислотного розчину з бюретки (показано на малюнку) для нейтралізації основи в аналізованому зразку, кількість еквівалентів кислоти та основи, що беруть участь, повинна бути однаковою. Точка нейтралізації називається точкою еквівалентності. Кислотно-базовий показник, такий як лакмус або фенолфталеїн, може бути використаний для визначення точки еквівалентності. З обсягу використовуваного кислотного розчину і його нормальності можна обчислити кількість еквівалентів основи в невідомому зразку. Якщо N A і N B є нормами кислотних і базових розчинів, а V A і V B - об'єми кожного при нейтральності, то
Number of equivalents = NAVA = NBVB (2-7)
Приклад 20
Якщо 25,00 мл фосфорної кислоти (H 3 PO 4) якраз достатньо, щоб нейтралізувати 30.25 мл розчину гідроксиду натрію, яке співвідношення нормальностей
два рішення? Яке співвідношення молярностей?
Рішення
Так як кожна моль сірчаної кислоти вносить 2 екві, то розчин
Оскільки нормальність кислоти в три рази перевищує її молярність, а нормальність основи така ж, як і її молярність, коефіцієнт молярності дорівнює
Приклад 21
При титруванні 25,00 мл розчину гідроксиду кальцію, Са (ОН) 2, для нейтралізації потрібно 10,81 мл 0,100 Н HCl. Обчисліть (а) нормальність розчину Са (ОН) 2, (б) молярність і (в) кількість грамів Са (ОН) 2, присутніх у зразку. Рішення
Нормальність розчину Са (ОН) 2 дорівнює
Оскільки 1 моль гідроксиду кальцію дає 2 еквив ОН -, молярність становить половину норми, або 0,0216 M Ca (OH) 2.
Кількість родимок Са (ОН) 2 дорівнюєОскільки молекулярна маса Са (ОН) 2 становить 74,1 г моль -1, присутня маса дорівнює
Приклад 22
Хімік-органік синтезує нову кислоту. Вона розчиняє 0,500 г в зручному обсязі води і виявляє, що для нейтралізації їй потрібно 15,73 мл 0,437 N NaOH. Яка еквівалентна вага нового з'єднання як кислоти? Якщо відомо, що кислота містить три іонізуючі -СООН групи, яка молекулярна маса? Рішення
Кількість еквівалентів підстави є
Еквівалентна вага знаходить від
Якщо еквівалентна маса кислоти дорівнює 72,8 г, а кожен моль дає 3 екві, то молекулярна маса дорівнює
Нагрівання реакції
Поки що ця глава була присвячена наслідкам збереження маси, і про енергію мало що сказано. Але принцип, що нагрівання реакції є адитивними, що енергія зберігається в процесі, незалежно від того, здійснюється процес в один крок або в кілька, є важливим. Тепло і робота є обома формами енергії, і вимірюються в одних і тих же одиницях. Якщо ви робите роботу над об'єктом або колекцією предметів, можна збільшити енергію або змусити систему нагріватися, в залежності від того, як виконується робота. Підйом важкого предмета - це перетворення роботи в потенційну енергію, а тертя - перетворення роботи в тепло. І навпаки, енергія може бути реконвертована в роботу, коли важкий предмет падає, а тепло перетворюється на роботу в автомобільному двигуні. З цих трьох - тепло, робота та енергія - хімік зазвичай більше стурбований теплом: теплом, яке може поглинатися або віддаватися, коли відбувається хімічна реакція.
За законами руху Ньютона сила на предмет є добутком його маси і прискорення:
-
Сила = маси × прискорення F = м × a
Сила, яка повинна бути застосована до маси 1,00 кг, щоб дати їй прискорення 1 метр в секунду в секунду (1 м с -2), визначається як сила 1 ньютон (N). Звідси 1 Н = 1 кг м с -2. (Одиниці СІ засновані на довжині в метрах і масі в кілограмах.)
Приклад 23
Коли глечик батоги 5.00 унції (oz) бейсбол навколо дуги 5.00 м в окружності для того, щоб прискорити його від нуля до 90 миль годину -1, яке середнє прискорення він дає м'яч під час поля, і яку середню силу він чинити на нього під час його накручування? Рішення
Припустимо рівномірне прискорення на м'яч з моменту початку намотування, поки м'яч не покидає руку глечика. Для рівномірного прискорення від спокою v = at і s = при 2, де v - швидкість, a - прискорення, t - час, а s - відстань. Усунення часу з двох виразів дає a = v 2 /2 с. Якщо v = 40,2 м с -1 (90 миль/год) і s = 5,00 м, то
Оскільки маса (м) становить 0,142 кг (5,00 унції), середня сила, прикладена до м'яча під час гойдалки, становить
Робота, виконана при наданні 1 Н сили на об'єкт на відстань 1 м, визначається як 1 джоуль (J). Звідси 1 Дж = 1 Н м = 1 кг м 2 с -2. Для кинутого предмета вся робота перетворюється в кінетичну енергію (енергію руху); в інших обставин частина або вся робота може закінчитися теплом.
Приклад 24
Скільки роботи виконується на бейсболі на полі, описаному в прикладі 23? Скільки кінетичної енергії має м'яч, коли він залишає руку глечика? Рішення
Робота, виконана на бейсболі - це
Куля закінчується кінетичною енергією 115 Дж.
Як перевірити ці результати, ми можемо розрахувати кінетичну енергію безпосередньо:
де Е - енергія. Перевага джоуля як одиниці тепла полягає в тому, що він відразу робить очевидним зв'язок між теплом, роботою та енергією. Більш стара одиниця енергії, яка виникла в результаті вимірювань тепла, - це калорійність. Одна калорія (кал) визначається як кількість тепла, необхідного для підвищення температури 1 г чистої води на 1° C (точніше від 14,5° C до 15,5° C). Це визначення не мало явного зв'язку з роботою, і насправді калорійність була визначена в дев'ятнадцятому столітті, перш ніж хтось зрозумів, що тепло і робота - це альтернативні форми одного і того ж: енергії. У цій книзі ми будемо використовувати лише джоулі, але ви повинні знати про калорії, оскільки більшість існуючої літератури використовує цю одиницю. Калорійність приблизно в чотири рази більше джоуля: 1 кал = 4,184 Дж. Теплоти реакції мольних кількостей речовин зазвичай знаходяться в діапазоні кілоджоулів (кДж) або кілокалорій (ккал), де 1 кДж = 1000 Дж і 1 ккал = 1000 кал.
В якості ілюстрації теплоти реакції і принципу адитивності тепла розглянемо розкладання перекису водню, Н 2 О 2. Коли водний розчин перекису водню реагує на утворення кисню, газу і рідкої води, тепло віддається. Кількість тепла буде дещо змінюватися в залежності від температури, при якій відбувається реакція, але при 25°C, загальноприйнята стандартна «кімнатна температура» для вимірювання та складання таблиць теплоти реакції, кожен моль H 2 O 2, який розкладається, виробляє 94,7 кДж тепла. (Якби цю енергію можна було б використовувати з ідеальною ефективністю, було б достатньо для прискорення 823 бейсболів, як описано в прикладі 24.)
 Схематичне зображення бомбового калориметра, використовуваного для вимірювання теплоти згоряння. Зважений зразок поміщають в тигель, який в свою чергу поміщається в бомбу. Зразок спалюється повністю в кисні під тиском. Зразок підпалюється залізним дротом котушки запалювання, яка світиться при нагріванні. Калориметр заповнюється рідиною, зазвичай водою, і ізолюється за допомогою сорочки. Температуру води вимірюють за допомогою термометра. Від зміни температури можна обчислити теплоту реакції.
Схематичне зображення бомбового калориметра, використовуваного для вимірювання теплоти згоряння. Зважений зразок поміщають в тигель, який в свою чергу поміщається в бомбу. Зразок спалюється повністю в кисні під тиском. Зразок підпалюється залізним дротом котушки запалювання, яка світиться при нагріванні. Калориметр заповнюється рідиною, зазвичай водою, і ізолюється за допомогою сорочки. Температуру води вимірюють за допомогою термометра. Від зміни температури можна обчислити теплоту реакції.Тепло, що бере участь у хімічній реакції, що здійснюється при постійному тиску (або, принаймні, з кінцевим тиском, повернутим до початкового значення), відоме як зміна ентальпії реагуючої системи, Δ H (читається як «дельта Н»). Як ми побачимо в главі 15, зміна енергії, Δ E, відповідає теплоті реакції, якщо реакція проводиться в постійному обсязі, як в калориметрі бомби, показаному на малюнку 2-4. Ентальпія може розглядатися як «виправлена» енергія, корекція полягає в будь-якій роботі, яку хімічні речовини можуть зробити, натискаючи на атмосферу, якщо вони розширюються. Різниця між Δ E і Δ H невелика, але значна, але вона для нас зараз не важлива. Якщо під час реакції віддається тепло, то ентальпія реагує хімічної системи падає; Δ H, зміна ентальпії, негативне. Така реакція називається екзотермічної. В ендотермічній реакції тепло поглинається і ентальпія реакційної суміші підвищується. Для реакції перекису водню можемо написати
H2O2(aq) → H2O(l) + 1/2 O2 ΔH = -94.7 kJ (2-8)
Це тепло виділяється, коли 1 моль перекису водню розкладається до 1 моль води і 1/2 моль газу кисню, або на 1 моль реакції, як тільки що написано. Якщо всі коефіцієнти реакції подвоєні, то теплоту реакції необхідно також подвоїти, так як вона тоді відноситься до реакції в два рази більше:
2 H2O2(aq) → 2 H2O(l) + O2 ΔH = -189.4 kJ (2-9)
«Один моль реакції як написано» тепер означає 2 молі перекису водню, що розкладається на 2 молі води і 1 моль кисню, тому що коефіцієнти в рівнянні всі були подвоєні. Теплота реакції також залежить від фізичного стану реагентів і продуктів. Якби перекис водню розкладатися, щоб дати газ кисню та водяну пару замість рідини, частина 94,7 кДж була б відведена на випаровування H 2 O:
H2O(l) → H2O(g) ΔH= +44.0 kJ (2-10)
і менше тепла віддавалося б розкладанням перекису:
H2O2(aq) → H2O(g) + 1/2 O2(g) ΔH= -50.7 kJ (2-11)
Тут приховано важливе припущення: що нагрівання реакції є адитивними (рис. 2-5). Рівняння 2-9 плюс рівняння 2-10 дає рівняння 2-11, і тому ми припустили, що теплота третьої реакції буде сумою перших двох:
- Δ Н = -94,7 + 44,0 кДж = -50,7 кДж
 Зміна ентальпії для реакції
Зміна ентальпії для реакції
H 2 O 2 (aq) → H 2 O (g) + 1/2 O 2 (g) може бути отримана без фактичного вимірювання зміни ентальпії для реакції шляхом додавання Δ H для двох реакцій
Н 2 О 2 (ак) → Н 2 О (л) + 1/2 О 2 (г) Δ Н = -94,7 кДж/моль
Н 2 О (л) → Н 2 О (г) Δ Н = +44,0 кДж/мольАддиктивність реакційних нагрівань випливає безпосередньо з першого закону термодинаміки (Глава 15): Зміна енергії або ентальпії між двома
станів залежить тільки від характеру цих держав, а не від того, як здійснюється зміна. Колекція хімічних речовин у заданому стані має певну енергію та певну ентальпію, жодна з яких ніяк не залежить від того, як хімічні речовини були доведені до цього стану. (Тобто минула історія хімічних речовин може впливати на їх теперішню енергію та ентальпію, але нам не потрібно знати цю історію для вимірювання значень Е і Н.) Звідси різниця між ентальпіями реагентів і продуктів, або теплотою реакції, може залежати тільки від характеру початкового і кінцевого станів, а не від конкретного способу, яким здійснюється реакція. Це іноді називають законом Гесса теплового підсумовування, який є досить гідною назвою природного наслідку першого закону термодинаміки.
Аддиктивність нагрівань реакції робить велику кількість експериментів в термохімії (хімії тепла і енергії) непотрібним. Нам не потрібно вимірювати і табулювати зміну ентальпії кожної мислимої хімічної реакції. Наприклад, якщо ми знаємо теплоту випаровування рідкої води (рівняння 2-10) і теплоту розкладання перекису водню на рідку воду (рівняння 2-9), то нам ніколи не потрібно вимірювати теплоту розкладання перекису водню на водяну пару; відповідь можна обчислити завчасно. Якщо певну реакцію проводити незручно, може виникнути набір більш простих реакцій, сума яких є відповідною реакцією. Після того, як ми провели окремі експерименти, ми можемо додати зміни ентальпії так само, як хімічні рівняння, щоб знайти теплоту важковимірної реакції.
Припустимо, що хтось запропонував схему виготовлення алмазів шляхом окислення метану:
- СН 4 (г) + О 2 (г) → С (ді) + 2 Н 2 О (л)
[Позначення (и) недостатньо для вуглецю, оскільки алмаз (di) повинен відрізнятися від графіту (gr).] Ви хотіли б дізнатися, чи буде реакція вивільняти тепло, яке повинно бути дозволено в конструкції реакційного судини. Цей конкретний синтез ніколи не проводився (і, ймовірно, ніколи не буде), все ж ви можете дати своєму оманливому другові його відповідь від знання спеки більш легких реакцій. Теплота згоряння речовини, що містить C, N, O і H - це тепло, на моль речовини, реакції з достатньою кількістю кисню для отримання CO 2, N 2, і рідини H 2 O. Теплоти згоряння легко виміряти, і були одними з перших реакційних нагрівань, щоб бути вимірюється і таблична систематично. Великі таблиці теплоти згоряння можна знайти в таких книгах, як CRC Довідник з хімії та фізики або Довідник Ланге з хімії. Теплоти згоряння метану і алмазу є
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) ΔH = -890 kJ/mol (2-12) C(di) + O2(g) → CO2(g) ΔH = -395 kJ/mol (2-13)Потрібна реакція синтезу алмаза виробляється шляхом віднімання другої реакції з першої, або додаванням першої реакції до зворотної другої, і теплота реакції виявляється таким же чином:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) ΔH = -890 kJ/mol (2-12) CO2(g) → C(di) + O2(g) ΔH = +395 kJ/mol (2-14)Зверніть увагу, що коли реакція обертається і працює в зворотному напрямку, теплота реакції змінюється знак, оскільки процес, який видавав 395 кДж в одному напрямку, повинен поглинати 395 кДж в зворотному напрямку.
Теплоти формування
Через адитивність нагрівань реакції не всі нагрівання доводиться табулювати — тільки ті, що стосуються мінімального набору реакцій, з яких можна отримати всі інші. Набір, який був узгоджений вченими та інженерами, складається з теплот утворення сполук з їх чистих елементів у стандартних станах. Для твердих речовин і рідин цей стандартний стан є найбільш поширеною формою елемента при 25° C або 298 K і 1 атмосфері (атм) [2] зовнішньому тиску; гази визначаються аналогічно, але при парціальному тиску 1 атм. [3] Стандартним станом для термодинамічних вимірювань за участю вуглецю є графіт (гр), а не алмаз (ді). Теплоти утворення для всіх сполук, що беруть участь в синтезі алмазу, є
C(gr) + 2 H2(g) → CH4(g) ΔH = -74.8 kJ/mol (2-16) C(gr) → C(di) ΔH = +1.9 kJ/mol (2-17) H2(g) + 1/2 O2(g) → H2O(l) ΔH = -285.8 kJ/mol (2-18)Таблиця стандартних теплот утворення з'єднань з їх чистих елементів приведена в додатку 3. У цій таблиці індекс 298 відноситься до температури (298 K), а нульовий верхній індекс означає, що реагенти і продукти знаходяться в їх стандартних станах. Щоб проілюструвати, як знаходять теплоти загальних реакцій від теплоти пласта, розглянемо ще раз на алмазний синтез, рівняння 2-15. Ця реакція може бути отримана шляхом додавання рівняння 2-17 до дворазового рівняння 2-18 і зворотного рівняння 2-16:
C(gr) → C(di) ΔH = +1.9 kJ (2-17) 2 H2(g) + O2(g) → 2 H2O(l) ΔH = -571.6 kJ 2x(2-18) CH4(g) → C(gr) + 2 H2(g) ΔH = +74.8 kJ -(2-16)Тепло реакції виявляється точно таким же чином:
- Δ Н = (+1,9) + 2 (-285,8) - (-74,8) = -494,9 кДж
Як бачите, наслідки невідстеження знаків і коефіцієнтів можуть бути згубними. Найвірніший метод - виписати кожне рівняння зі своєю теплотою реакції таким чином, щоб сума окремих рівнянь була бажаною реакцією. Якщо всі коефіцієнти рівняння помножити на довільне число n, то теплоту освіти потрібно також помножити на n, а якщо рівняння освіти обернути і запустити в зворотному напрямку, то знак Δ Н необхідно змінити. Якщо окремі рівняння додати, щоб дати потрібну реакцію, то окремі нагрівання додають, щоб дати відповідну загальну теплоту реакції.
Зручний ярлик - думати про теплоту утворення з'єднання так, ніби це, в певному сенсі, ентальпія самого з'єднання. (Попередження: Це можливо тільки тому, що теплоти освіти елементів за визначенням дорівнюють нулю.) Тоді теплота реакції стає сумою нагрівань освіти всіх продуктів за вирахуванням теплоти утворення всіх реагентів, кожен з яких множиться на коефіцієнт цієї речовини в збалансованому рівнянні.
Приклад 25
Яка стандартна теплота реакції, за допомогою якої оксид заліза відновлюється вуглецем до заліза і чадного газу в доменній печі? Рішення
Реакція така, при цьому стандартна теплота освіти на моль написана під кожним з'єднанням:
Фе 2 О 3 (и) + 3 С (гр) → 2 Фр. (ів) + 3 СО (г) Δ H (кДж/моль) -822.1 0.0 0.0 -110.5 Стандартна теплота освіти елементів від себе, звичайно, дорівнює нулю, за визначенням. За реакцію як написано,
- Δ Н = 2 (0,0) + 3 (-110,5) - (-822.1) - 3 (0,0) = +490,6 кДж
Ці результати узгоджуються з тим, що для зменшення залізної руди до заліза необхідно подавати багато тепла. Однак зауважте, що 490,6 кДж - це чисте тепло, яке було б поглинуто, якби реакція працювала при 298 К, а не 1800 К доменної печі. І все ж цей розрахунковий показник є також теплом, що поглинається, якщо оксид заліза і вуглець нагріваються від 298 К до 1800 К, дають вступити в реакцію, і продукти знову охолоджуються до кімнатної температури. Зміна ентальпії або теплота реакції залежить тільки від початкового і кінцевого станів учасників, а не від того, чи залишалася температура постійною або пішла на доменні рівні між ними. Все, що важливо, це те, що температура зводиться до 298 К в кінці.
Як ще один приклад принципу, чисте тепло, що виділяється при виготовленні води з водню та кисню, буде однаковим, чи бурхливо вибухає суміш H2 і 02 при 298 K, а отримана вода охолоджується назад до 298 К, або ж сама суміш повільно реагує в присутності дрібно розділеної платини, як каталізатор, ніколи не підвищуючи його температуру. Отже, посилаючись на теплоти реакції, коли ми говоримо, що значення правильні для процесу, проведеного «при тиску 1 атм і 298 К», ми вимагаємо лише, щоб реагенти починалися при цих умовах, і щоб продукти там закінчувалися. Саме тому корисні таблиці теплоти формування в стандартних умовах (Додаток 3).
Принципи збереження
Посилання та примітки
- Одиницею довжини СІ є метр (м), розділений на 10 дециметрів (дм) або 100 сантиметрів (см). Одиницею об'єму є кубічний метр (м 3). Для лабораторних робіт кубометр занадто великий, щоб бути зручним, тому прийнято використовувати літр, який в СІ визначається як 1 дм 3, і мілілітр (мл), що дорівнює 1 см 3 (або іноді куб.см). За суворою логікою літр - це стороння одиниця в СІ, але вона занадто зручна, та й її використання занадто глибоко вкорінене, щоб виключити. Вчені в минулому схильні використовувати мілілітри для обсягів рідини, а кубічні сантиметри - для обсягів твердих речовин. Отже, обсяг розчину хлориду натрію вимірювався б в мілілітрах, але щільність кам'яної солі (кристалів хлориду натрію) повідомлятиметься в грамах на кубічний сантиметр, або г см -3. У цьому розділі ми будемо використовувати лише міліметри, але після цього сміливо використовуйте кубічні сантиметри там, де ця одиниця здається більш природною. Пам'ятайте, що 1 м 3 = 1000 літрів, 1 літр = 1000 мл, а 1 мл = 1 см 3. Для отримання додаткової інформації про СІ див. Додаток 1.
- Перетворення в абсолютну або шкалу температури Кельвіна розглядається в главі 3, як і атмосфера як одиниця тиску. (За конвенцією SI жоден знак ступеня не використовується для шкали Кельвіна.)
- Парціальний тиск газу в суміші - це тиск, який газ покаже, якби всі інші гази були видалені, і це був єдиний газ, присутній.