Дикі іоністи
- Page ID
- 24612
Навички для розвитку
- Обговорити значення електролітів і осмосу
Фарадей довів, що чиста вода не проводить електрику, але провідність збільшується, коли додаються деякі типи розчинених речовин. Ці розчинні речовини називаються електролітами. Довгий час люди думали, що іони, які дозволяють воді проводити електрику (для проведення повинні рухатися заряджені частинки, такі як електрони через металевий дріт або іони через розчин), утворюються електрикою.
Сванте Арреніус був сином неповнолітнього співробітника університету в Швеції. Для своїх докторських досліджень він хотів вивчити, чи можна вимірювати молекулярні ваги сполук за допомогою провідності їх розчинів (предмет, який його радник сказав йому не працювати над - він часто ігнорував поради своїх радників). Для цього йому потрібно було зрозуміти, як залежить провідність розчинів електролітів від концентрації, але він виявив, що його дані несподівано збивають з пантелику. Мудро він зрозумів, що пояснення провідності насправді буде цікавіше і корисніше, ніж його початковий план вимірювання молекулярних мас. Він виявив, що електроліти поділяються на 2 види: сильні і слабкі. Сильні електроліти (як сіль і HCl) легко проводять електрику, а їх провідність пропорційна концентрації. Слабкі електроліти (як оцет і аміак) проводять електрику набагато менше, але їх провідність прямо не пропорційна концентрації. Зі зменшенням концентрації провідність теж відбувається, але провідність/маса розчиненої речовини збільшується. Він припустив, що електроліти мали активний стан (який проводить) і неактивний стан (який не проводить електрику); сильні електроліти повністю перебували в активному стані, тоді як слабкі електроліти мали б деякі молекули в активному стані, а деякі - в неактивному стані. У міру розведення слабкого розчину електроліту% молекул в активному стані збільшувався б до 100%. Але це було розпливчасто, і його радникам це не сподобалося і давали йому дуже низьку оцінку. Оскільки оцінка була настільки низькою, йому довелося подорожувати і робити дослідження без оплати в інших лабораторіях протягом багатьох років, щоб утвердитися, замість того, щоб стати самим професором.

Арреній подорожував і зустрівся з іншими вченими. Професор на ім'я Оствальд допоміг представити його. Він подружився з Нернстом (який згодом зробить якусь важливу роботу з термодинаміки та електрохімії). Нернст був диким молодим чоловіком, який думав про те, щоб стати актором, мав шрами від боїв, і часто сильно напився. Він також почав листуватися (писати листи) з van't Hoff, про якого ми згадували раніше. Van't Hoff перейшов від вуглецевої хімії і вивчав осмос. Осмос виникає, коли вода рухається через мембрану (як мембрана біологічної клітини), щоб перейти від розведеного розчину з одного боку до концентрованого розчину з іншого. Це може створити різницю тиску. Ось як деякі антибіотики вбивають бактерії: бактерії вибухають від тиску, оскільки розчин поза клітиною більш розбавлений, ніж розчин всередині клітини. Van't Hoff виявив, що осмотичний тиск залежить від концентрації розчинів, але для електролітів існує додатковий «фактор помадки»; концентрація здається вищою, ніж очікувалося. Виявилося, що електроліти розбиваються на шматки, і ці шматочки збільшують уявну концентрацію розчину при визначенні осмотичного тиску. Арреніус зауважив, що «фактор помадки» в даних Ван Гоффа пов'язаний з фракціями в активних станах Арренія.
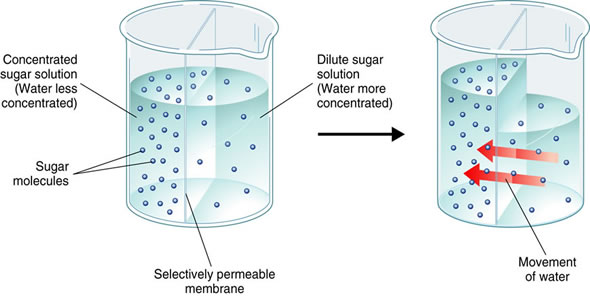
В цей час електрони ще не були виявлені. Люди думали, що іони утворюються в розчині тільки при пропущенні електрики. Однак Арреній зрозумів, що електроліти повинні розщеплюватися на заряджені шматочки (іони), коли вони розчиняються, навіть без електрики, оскільки ці заряджені шматки не впливали на вимірювання осмотичного тиску Гоффа. Думка про те, що сіль, яка так жадібно утворюється з елементів, повністю розщеплюється у воді, здавалася божевільною більшості вчених. (Тепер ми знаємо, що розщеплення на іони проти розщеплення на атоми дуже різне!) Але Оствальд, Нернст і ван 'т Гофф погодилися з Арренієм, і їх називали «дикою армією іоністів». Вони досить швидко переконали інших хіміків, що ця нова теорія іонізації була правильною.
Подяка
Ця дискусія була натхненна першою главою книги «Собори науки» Патріка Коффі.