18.12: Хімія сірки
- Page ID
- 106100
- Опишіть властивості, підготовку та використання сірки
Сірка існує в природі як елементарні відкладення, а також сульфіди заліза, цинку, свинцю та міді, а також сульфати натрію, кальцію, барію та магнію. Сірководень часто є компонентом природного газу і зустрічається у багатьох вулканічних газах, як показано на малюнку\(\PageIndex{1}\). Сірка входить до складу багатьох білків і необхідна для життя.

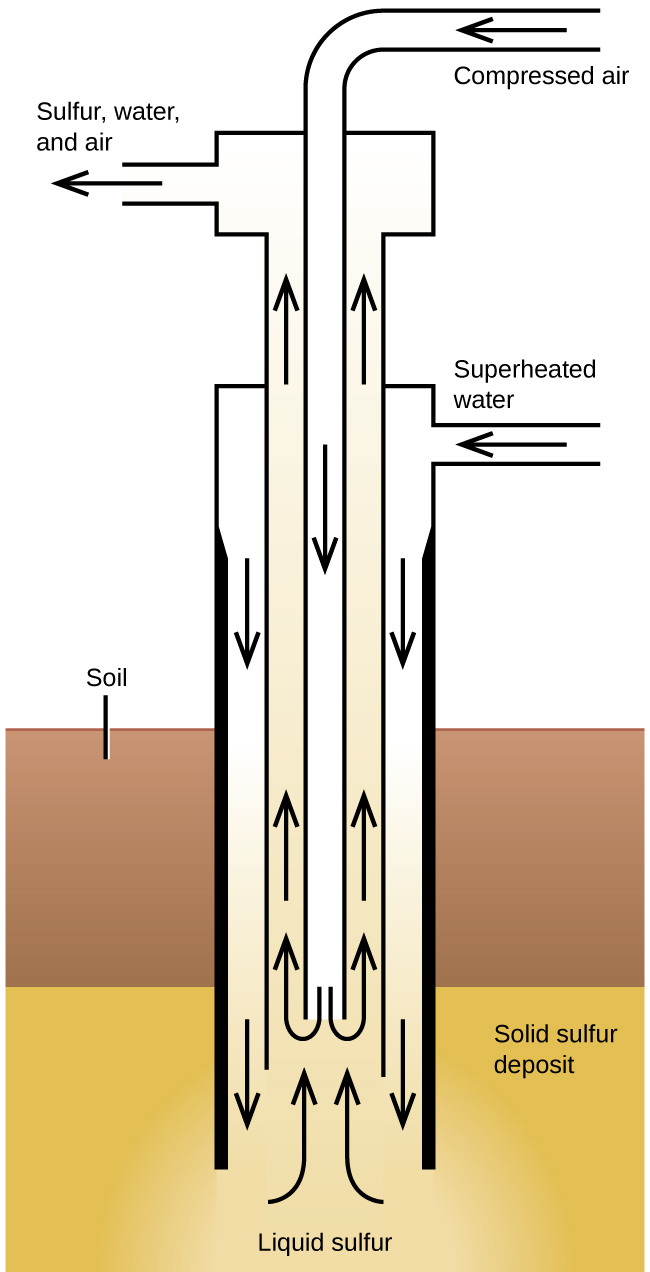
Процес Фреша, проілюстрований на малюнку\(\PageIndex{2}\), має важливе значення при видобутку вільної сірки з величезних підземних родовищ в Техасі та Луїзіані. Перегріта вода (170° C і тиск 10 атм) витісняється по крайній з трьох концентричних труб до підземного родовища. Гаряча вода розтоплює сірку. Сама внутрішня труба проводить стиснене повітря в рідку сірку. Повітря змушує рідку сірку, змішану з повітрям, витікати вгору по вихідній трубі. Перенесення суміші у великі відстійники дозволяє твердій сірці відокремлюватися при охолодженні. Ця сірка є чистою від 99,5% до 99,9% і не вимагає очищення для більшості застосувань.
Більша кількість сірки також надходить із сірководню, відновленого під час очищення природного газу.
Сірка існує в декількох аллотропних формах. Стабільна форма при кімнатній температурі містить восьмичленні кільця, і тому справжньою формулою є S 8. Однак хіміки зазвичай використовують S для спрощення коефіцієнтів в хімічних рівняннях; ми будемо слідувати цій практиці в цій книзі.
Як і кисень, який також входить до групи 16, сірка проявляє чітко неметалічну поведінку. Він окислює метали, даючи різноманітні бінарні сульфіди, в яких сірка проявляє негативну ступінь окислення (2−). Елементарна сірка окислює менше електронегативних неметалів, а більше електронегативних неметалів, таких як кисень та галогени, окислять її. Інші сильні окислювачі також окислюють сірку. Наприклад, концентрована азотна кислота окислює сірку до сульфат-іона, з одночасним утворенням оксиду азоту (IV):
\[\ce{S}(s)+\ce{6HNO3}(aq)⟶\ce{2H3O+}(aq)+\ce{SO4^2-}(aq)+\ce{6NO2}(g) \nonumber \]
Хімія сірки зі ступенем окислення 2− схожа на хімію кисню. На відміну від кисню, однак, сірка утворює багато сполук, в яких проявляє позитивні ступені окислення.
Резюме
Сірка (група 16) реагує майже з усіма металами і легко утворює сульфідний іон S 2−, в якому він має ступінь окислення 2−. Сірка реагує з більшістю неметалів.
Глосарій
- Фреш-процес
- важливе значення при видобутку вільної сірки з величезних підземних родовищ