18.8: Хімія азоту
- Page ID
- 106093
Як і елементи групи 14, найлегший член групи 15, азот, зустрічається в природі як вільний елемент, а найважчі елементи відомі століттями, оскільки вони легко виділяються зі своїх руд. Хоча азот є найпоширенішим елементом в атмосфері, він був останнім з пнікогенів (елементи групи 15), які можна отримати в чистому вигляді. У 1772 році Деніел Резерфорд, працюючи з Джозефом Блеком (який відкрив CO 2), помітив, що газ залишився, коли СО 2 був вилучений з реакції горіння. Антуан Лавуазьє називав газовий азот, що означає «немає життя», тому що він не підтримував життя. Коли було виявлено, що той же елемент також присутній в азотній кислоті та нітратних солей, таких як KNO 3 (нітр), його назвали азотом. Близько 90% виробленого сьогодні азоту використовується для забезпечення інертної атмосфери для процесів або реакцій, чутливих до кисню, таких як виробництво сталі, переробка нафти та упаковка харчових продуктів та фармацевтичних препаратів.
Приготування та загальні властивості азоту
Оскільки атмосфера містить кілька трильйонів тонн елементарного азоту з чистотою близько 80%, це величезне джерело газу азоту. Дистиляція зрідженого повітря дає газ азоту, який є більш ніж 99,99% чистого, але невеликі кількості дуже чистого азотного газу можуть бути отримані в результаті термічного розкладання азиду натрію:
\[\ce{2NaN3(s) ->[\Delta] 2Na(l) + 3N2(g)} \label{Eq1} \]
Навпаки, земна кора відносно бідна азотом. Єдині важливі азотні руди - це великі родовища КНО 3 і NaNO 3 в пустель Чилі і Росії, які, мабуть, утворилися при випаровуванні стародавніх лужних озер. Отже, практично всі азотні сполуки, вироблені в промислових масштабах, використовують в якості вихідного матеріалу атмосферний азот. Фосфор, який становить лише близько 0,1% земної кори, набагато більш рясний в рудах, ніж азот. Як і алюміній і кремній, фосфор завжди міститься в поєднанні з киснем, і для його ізоляції потрібні великі витрати енергії.
Реакції та сполуки азоту
Як і вуглець, азот має чотири валентні орбіталі (один 2s і три 2p), тому він може брати участь у максимум чотирьох електронно-парних зв'язках, використовуючи гібридні орбіталі sp 3. На відміну від вуглецю, однак, азот не утворює довгих ланцюгів через відштовхуючих взаємодій між одинокими парами електронів на сусідніх атомах. Ці взаємодії стають важливими на коротших міжядерних відстанях, що зустрічаються з меншими елементами другого періоду груп 15, 16 та 17. Стабільні сполуки з N—N зв'язками обмежені ланцюгами не більше трьох атомів N, таких як азидний іон (N 3 −).
Азот є єдиним пнікогеном, який зазвичай утворює множинні зв'язки з собою та іншими елементами другого періоду, використовуючи π перекриття сусідніх орбіталей np. Таким чином, стабільною формою елементарного азоту є N 2, зв'язок NN якого настільки міцний (D NN = 942 кДж/моль) порівняно з зв'язками N—N та N = N (D N—N = 167 кДж/моль; D N = 418 кДж/моль), що всі сполуки, що містять N—N та N=N зв'язки термодинамічно нестійкий щодо утворення N 2. Насправді утворення зв'язку NN настільки термодинамічно сприятливе, що практично всі сполуки, що містять N—N зв'язки, потенційно вибухонебезпечні.
Знову ж таки, на відміну від вуглецю, азот зазнає лише двох важливих хімічних реакцій при кімнатній температурі: він реагує з металевим літієм з утворенням нітриду літію, і певні мікроорганізми він зводиться до аміаку. Однак при більш високих температурах N 2 реагує з більшою кількістю електропозитивних елементів, таких як ті, що знаходяться в групі 13, щоб дати бінарні нітриди, які варіюються від ковалентного до іонного характеру. Як і відповідні сполуки вуглецю, бінарні сполуки азоту з киснем, воднем або іншими неметалами зазвичай є ковалентними молекулярними речовинами.
Мало бінарних молекулярних сполук азоту утворюються в результаті безпосередньої реакції елементів. При підвищених температурах N 2 реагує з H 2 з утворенням аміаку, з O 2 утворює суміш NO і NO 2, і з вуглецем з утворенням ціаногену (NC—CN); елементарний азот не реагує з галогенами або іншими халькогенами. Тим не менш, всі бінарні галогеніди азоту (NX 3) відомі. За винятком NF 3, всі вони токсичні, термодинамічно нестабільні та потенційно вибухонебезпечні, і всі вони готуються шляхом реакції галогену з NH 3, а не N 2. Як монооксид азоту (NO), так і діоксид азоту (NO 2) термодинамічно нестабільні, з позитивними вільними енергіями утворення. На відміну від NO, NO 2 легко реагує з надлишком води, утворюючи 1:1 суміш азотної кислоти (HNO 2) та азотної кислоти (HNO 3):
\[\ce{2NO2(g) + H2O(l) -> HNO2(aq) + HNO3(aq)} \label{Eq2} \]
Азот також утворює\(\ce{N2O}\) (окис азоту, або закис азоту), лінійну молекулу, яка є ізоелектронною з\(\ce{CO2}\) і може бути представлена як − N = N + = O Як і інші два оксиди азоту, закис азоту термодинамічно нестабільний. Структури трьох загальних оксидів азоту такі:
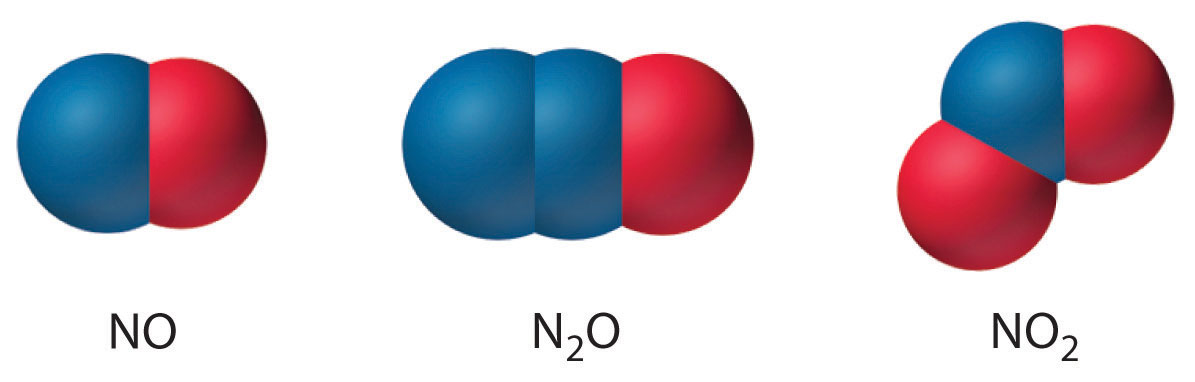
Мало бінарних молекулярних сполук азоту утворюються в результаті безпосередньої реакції елементів.
При підвищених температурах азот реагує з високоелектропозитивними металами з утворенням іонних нітридів, таких як\(\ce{Li3N}\) і\(\ce{Ca3N2}\). Ці сполуки складаються з іонних решіток, утворених\(\ce{N^{3−}}\) іонами\(\ce{M^{n+}}\) і. Подібно до того, як бор утворює інтерстиціальні бориди, а вуглець утворює інтерстиціальні карбіди, з меншою кількістю електропозитивних металів азот утворює ряд інтерстиціальних нітридів, в яких азот займає отвори в щільно упакованій металевій структурі. Як і інтерстиціальні карбіди та бориди, ці речовини, як правило, дуже тверді, високоплавкі матеріали, які мають металевий блиск і провідність.
Азот також реагує з напівметалами при дуже високих температурах для отримання ковалентних нітридів, таких як\(\ce{Si3N4}\) і\(\ce{BN}\), які є твердими речовинами з розширеними ковалентними мережними структурами, подібними до структур графіту або алмазу. Отже, вони, як правило, є високоплавкими і хімічно інертними матеріалами.
Аміак (NH 3) є одним з небагатьох термодинамічно стійких бінарних сполук азоту з неметалом. Він не горючий на повітрі, але горить в\(\ce{O2}\) атмосфері:
\[\ce{4NH3(g) + 3O2(g) -> 2N2(g) + 6H2O(g)} \label{Eq3} \]
Близько 10% виробленого щорічно аміаку використовується для виготовлення волокон та пластмас, що містять амідні зв'язки, такі як нейлони та поліуретани, тоді як 5% використовується у вибухових речовині, таких як аміачна селітра, тротил (тринітротолуол) та нітрогліцерин. В якості добрива використовується велика кількість безводного рідкого аміаку.
Азот утворює дві інші важливі бінарні сполуки з воднем. Гідразойна кислота (\(\ce{HN3}\)), яку також називають азидом водню, є безбарвною, високотоксичною та вибухонебезпечною речовиною. Гідразин (\(\ce{N2H4}\)) також потенційно вибухонебезпечний; він використовується як ракетне паливо і для пригнічення корозії в котлах.
B, C і N всі реагують з перехідними металами, утворюючи інтерстиціальні сполуки, які є твердими, високоплавкими матеріалами.
Для кожної реакції поясніть, чому при нагріванні реагентів утворюються дані продукти.
- \(\ce{Sr(s) + N2O(g) ->[\Delta] SrO(s) + N2(g)}\)
- \(\ce{NH4NO2(s) ->[\Delta] N2(g) + 2H2O(g)}\)
- \(\ce{Pb(NO3)2(s) ->[\Delta] PbO2(s) + 2NO2(g)}\)
Задано: збалансовані хімічні рівняння
Запитували: чому дані продукти формують
Стратегія:
Класифікують тип реакції. Використовуючи періодичні тенденції атомних властивостей, термодинаміки та кінетики, поясніть, чому утворюються спостережувані продукти реакції.
Рішення
- Як лужний метал стронцій є сильним відновником. Якщо інший реагент може виступати в ролі окислювача, то відбудеться окислювально-відновна реакція. Закис азоту містить азот у низькому ступені окислення (+1), тому ми зазвичай не вважаємо його окислювачем. Однак закис азоту термодинамічно нестійкий (ΔH° f > 0 і ΔG° f > 0), і його можна зменшити до N 2, який є стабільним видом. Отже, ми прогнозуємо, що відбудеться окислювально-відновна реакція.
- Коли речовина нагрівається, ймовірно, відбудеться реакція розкладання, яка часто передбачає виділення стабільних газів. При цьому нітрит амонію містить азот в двох різних ступенях окислення (−3 і +3), тому можлива внутрішня окислювально-відновна реакція. Завдяки своїй термодинамічній стійкості N 2 є ймовірним азотовмісним продуктом, тоді як ми прогнозуємо, що H і O об'єднаються з утворенням H 2 O.
- Знову ж таки, це, ймовірно, реакція термічного розкладання. Якщо один елемент знаходиться в зазвичай високому ступені окислення, а інший - в низькому ступені окислення, ймовірно, відбудеться окислювально-відновна реакція. Нітрат свинцю містить катіон Pb 2+ та нітратний аніон, який містить азот у найвищому ступені окислення (+5). Отже, азот може бути відновлений, і ми знаємо, що свинець може окислюватися до ступеня окислення +4. Отже, цілком ймовірно, що нітрат свинцю (II) при нагріванні буде розкладатися на оксид свинцю (IV) і діоксид азоту. Незважаючи на те, що PbO 2 є потужним окислювачем, виділення газу, такого як NO 2, часто може викликати інакше несприятливу реакцію на завершення (принцип Ле Шательє). Однак зауважте, що PbO 2, ймовірно, розкладається до PbO при високих температурах.
Прогнозуйте продукт (и) кожної реакції і напишіть збалансоване хімічне рівняння для кожної реакції.
- \(\ce{NO(g) + H2O(l) ->[\Delta]}\)
- \(\ce{NH4NO3(s) ->[\Delta]}\)
- \(\ce{Sr(s) + N2(g) ->}\)
Відповідь
- \(\ce{NO(g) + H2O(l) ->[\Delta] no reaction}\)
- \(\ce{NH4NO3(s) ->[\Delta] N2O(g) + 2H2O(g)}\)
- \(\ce{3Sr(s) + N2(g) -> Sr3N2(s)}\)
Резюме
Азот поводиться хімічно, як неметали, азот утворює сполуки в дев'яти різних станах окислення. Азот не утворює стабільних катенованих сполук через відштовхування між одинокими парами електронів на сусідніх атомах, але він утворює множинні зв'язки з іншими атомами другого періоду. Азот реагує з електропозитивними елементами для отримання твердих речовин, які варіюються від ковалентного до іонного характеру. Реакція з електропозитивними металами виробляє іонні нітриди, реакція з меншою кількістю електропозитивних металів виробляє інтерстиціальні нітриди, а реакція з напівметалами виробляє ковалентні нітриди.