18.3: Хімія водню
- Page ID
- 106101
- Охарактеризувати фізико-хімічні властивості водню та спрогнозувати його реакційну здатність.
Тепер ми перейдемо від огляду періодичних тенденцій до обговорення елементів s-блоку, спочатку зосередившись на водні, хімія якого досить виразна і важлива для обговорення в категорії своєї власної. Більшість версій таблиці Менделєєва розміщують водень у верхньому лівому куті безпосередньо над літієм, маючи на увазі, що водень з конфігурацією електронів 1s 1 входить до групи 1. Насправді хімія водню не сильно нагадує хімію металів 1-ї групи. Дійсно, деякі версії таблиці Менделєєва розміщують водень вище фтору в групі 17, оскільки додавання одного електрона до атома водню завершує його валентну оболонку.
Хоча водень має конфігурацію електронів ns 1, його хімія не схожа на хімію металів групи 1.
Ізотопи водню
Водень, найпоширеніший елемент у Всесвіті, є кінцевим джерелом всіх інших елементів в процесі ядерного синтезу. Таблиця\(\PageIndex{1}\) «Ізотопи водню» порівнює три ізотопи водню, всі з яких містять один протон і один електрон на атом. Найбільш поширеним ізотопом є протій (1 Н або Н), за ним йде дейтерій (2 Н або D), який має додатковий нейтрон. Найрідкіснішим ізотопом водню є тритій (3 Н або Т), який утворюється у верхній атмосфері ядерною реакцією, коли космічні промені вражають азот та інші атоми; потім він вимивається в океани опадами. Тритій радіоактивний, розпадається до 3 Він з періодом напіврозпаду всього 12,32 років. Отже, атмосфера і океани містять лише дуже низький, стійкий рівень тритію. Термін водень і символ H зазвичай відносяться до природної суміші трьох ізотопів.
| Протіум | дейтерій | Тритій | |
|---|---|---|---|
| символ | \(\mathrm{_1^1H}\) | \(\mathrm{_1^2H}\) | \(\mathrm{_1^3H}\) |
| нейтрони | 0 | 1 | 2 |
| маса (аму) | 1,00783 | 2.0140 | 3.01605 |
| достаток (%) | 99.9885 | 0.0115 | ~10 −17 |
| період напіврозпаду (років) | — | — | 12.32 |
| температура кипіння X 2 (K) | 20.28 | 23.67 | 25 |
| температура плавлення/температура кипіння X 2 O (° C) | 0,0/100.0 | 3.8/101.4 | 4.5/? |
Різні маси трьох ізотопів водню змушують їх мати різні фізичні властивості. При цьому Н 2, Д 2 і Т 2 відрізняються за температурами плавлення, температурою кипіння, щільності і теплоти плавлення і випаровування. У 1931 році Гарольд Юрі і колеги виявили дейтерій, повільно випаровуючи кілька літрів рідкого водню, поки не залишився обсяг близько 1 мл. Коли ця рідина, що залишилася, була випарована і досліджена її спектр випромінювання, вони спостерігали нові лінії поглинання на додаток до тих, які раніше ідентифікувалися як походять з водню. Природна велика кількість тритію, навпаки, настільки низька, що його не вдалося виявити подібними експериментами; вперше він був підготовлений в 1934 році ядерною реакцією.
Юрі отримав Нобелівську премію з хімії в 1934 році за відкриття дейтерію (2 H). Юрі народився і отримав освіту в сільській Індіані. Після отримання ступеня бакалавра зоології в Університеті Монтани в 1917 році, Юрі змінив напрямки кар'єри. Він отримав докторську ступінь з хімії в Берклі з Г.Н. Льюїсом і згодом працював з Нільсом Бором в Копенгагені. Під час Другої світової війни Юрі був директором військових досліджень для проекту атомної бомби в Колумбійському університеті. У більш пізні роки його дослідження були зосереджені на еволюції життя. У 1953 році він і його аспірант Стенлі Міллер показали, що органічні сполуки, включаючи амінокислоти, можуть утворюватися шляхом пропускання електричного розряду через суміш сполук, які, як вважають, присутні в атмосфері первісної Землі.
Оскільки нормальна температура кипіння D 2 O становить 101,4° C (порівняно з 100,0° C для H 2 O), випаровування або фракційна перегонка можуть бути використані для збільшення концентрації дейтерію у зразку води шляхом селективного видалення більш летких H 2 O. Таким чином, водойми які не мають виходу, такі як Велике Солоне озеро та Мертве море, які підтримують свій рівень виключно випаровуванням, мають значно вищі концентрації дейтрованої води, ніж озерна або морська вода з принаймні одним виходом. Більш ефективним способом отримання високозбагаченої дейтерієм води є тривалий електроліз водного розчину. Оскільки дейтрон (D +) має вдвічі більшу масу протона (H +), він повільніше дифується до поверхні електрода. Отже, газ, що виділяється на катоді, збагачується Н, видом, який дифузує швидше, сприяючи утворенню Н 2 над D 2 або HD. Тим часом розчин стає збагаченим дейтерієм. Багату дейтерієм воду називають важкою водою, оскільки щільність D 2 O (1,1044 г/см 3 при 25° C) більша, ніж у H 2 O (0,99978 г/см 3). Важка вода була важливою складовою ранніх ядерних реакторів.
Оскільки дейтрони розсіюються набагато повільніше, D 2 O не підтримуватиме життя і насправді токсичний, якщо вводити ссавцям у великих кількостях. Крок обмеження швидкості у багатьох важливих реакціях, каталізованих ферментами, включає перенесення протонів. Передача D + настільки повільна порівняно з перенесенням H +, оскільки зв'язки з D розриваються повільніше, ніж ті, що до Н, тому делікатний баланс реакцій в клітині порушується. Тим не менш, дейтерій і тритій є важливими дослідницькими інструментами для біохіміків. Включаючи ці ізотопи у певні положення у вибраних молекулах, де вони діють як мітки або сліди, біохіміки можуть слідувати шляху молекули через організм або клітину. Трасери також можуть використовуватися для надання інформації про механізм ферментативних реакцій.
Склеювання у водні та водневмісних сполуках
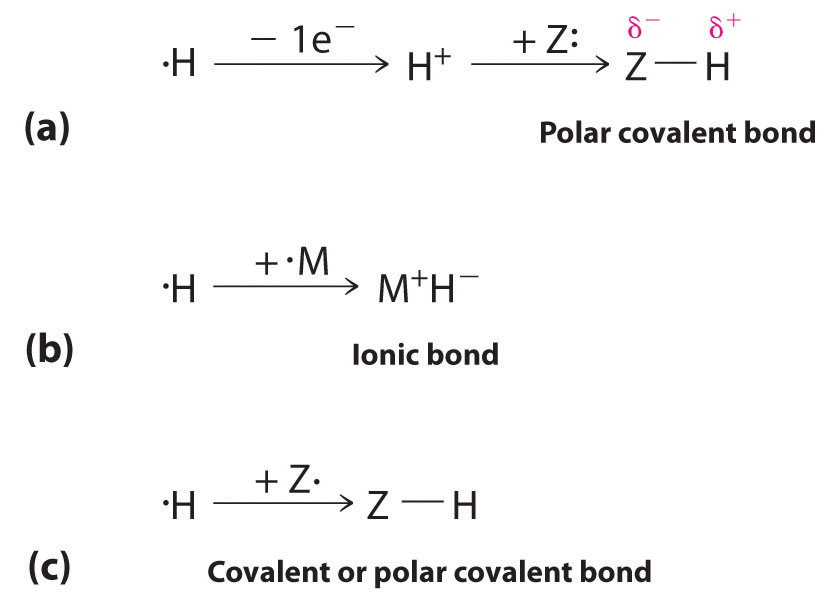
1s 1 електронна конфігурація водню вказує на єдиний валентний електрон. Оскільки 1s орбіталь має максимальну ємність двох електронів, водень може утворювати сполуки з іншими елементами трьома способами (рис.\(\PageIndex{1}\)):
- Втрата свого електрона, щоб утворити протон (H +) з порожньою орбітою 1s. Протон - це кислота Льюїса, яка може приймати пару електронів від іншого атома, щоб сформувати електронно-парний зв'язок. У кислотно-основоположних реакціях протон завжди зв'язується з самотньою парою електронів на атомі в іншій молекулі, утворюючи полярний ковалентний зв'язок. Якщо одинока пара електронів належить атому кисню молекули води, результатом є іон гідронію (H 3 O +).
- Приймаючи електрон для утворення іона гідриду (H −), який має заповнену орбіту 1s 2. Водень реагує з відносно електропозитивними металами, такими як лужні метали (група 1) та лужноземельні метали (група 2), утворюючи іонні гідриди, які містять катіони металів та H − іони.
- Поділивши свій електрон з електроном на іншому атомі, щоб утворити електронно-парний зв'язок. При наполовину заповненій орбіталі 1s 1 атом водню може взаємодіяти з одиночно зайнятими орбіталями на інших атомах, утворюючи або ковалентну, або полярну ковалентну електронно-парну зв'язок, залежно від електронегативності іншого атома.
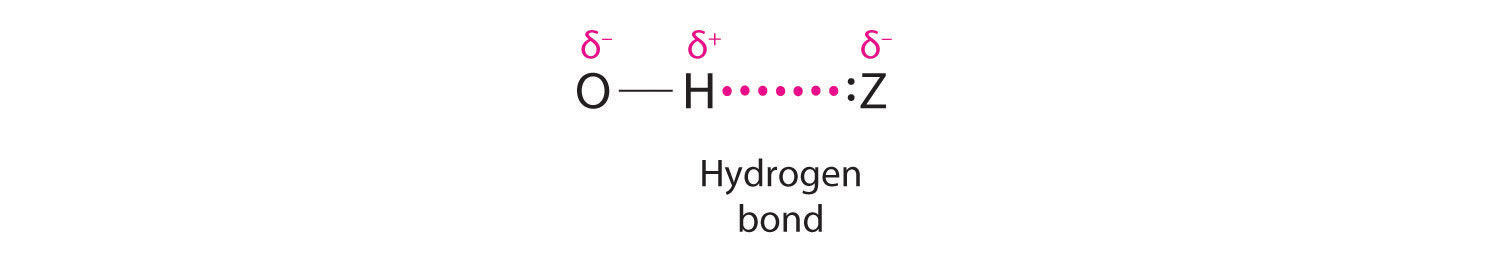
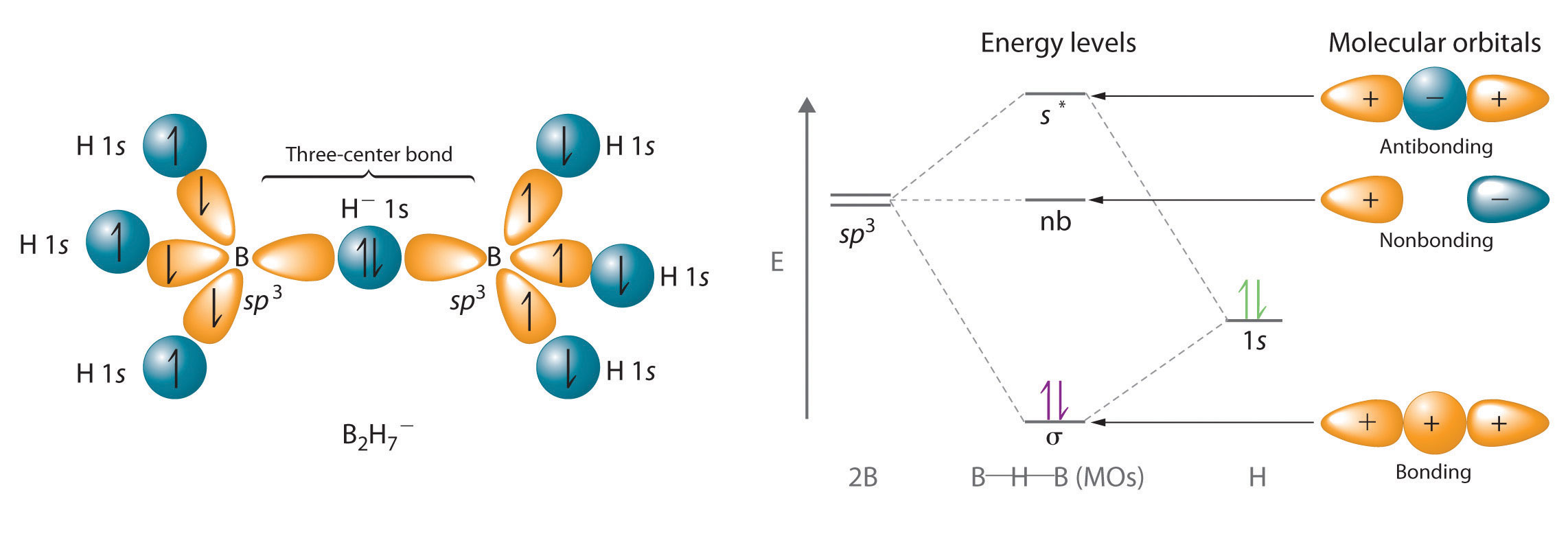
Водень також може виступати мостом між двома атомами. Один знайомий приклад - водневий зв'язок, електростатична взаємодія між воднем, зв'язаним з електронегативним атомом, і атомом, який має одну або кілька одиноких пар електронів (рис.\(\PageIndex{2}\)). Прикладом такого роду взаємодії є воднева зв'язкова мережа, виявлена у воді (рис.\(\PageIndex{2}\)). Водень також може утворювати трицентровий зв'язок (або електрон-дефіцитний зв'язок), в якій гідрид перемикає два електропозитивних атома. Сполуки, що містять водень, пов'язаний з бором і подібними елементами, часто мають такий тип зв'язку. Одиниці B—H—B, виявлені в гідридах бору, не можуть бути описані термінами локалізованих електронно-парних зв'язків.
Оскільки атом H в середині такої одиниці може вмістити максимум два електрони в своїй 1s орбіталі, блок B—H—B може бути описаний як містить гідрид, який взаємодіє одночасно з порожніми орбіталями sp 3 на двох атомах бору (рис.\(\PageIndex{3}\)). У цих зв'язках для утримання трьох атомів разом використовуються лише два зв'язку електронів, що робить їх електронно-дефіцитними зв'язками. Ви зіткнулися з подібним явищем при обговоренні π зв'язку в озоні та іоні нітриту. Нагадаємо, що в обох цих випадках ми використовували наявність двох електронів у π молекулярній орбіталі, що простягається на три атоми, щоб пояснити той факт, що дві відстані O—O зв'язку в озоні та дві відстані N—O зв'язку в нітриті однакові, що інакше можна пояснити лише використанням резонансних структур.
Водень може втратити свій електрон, утворюючи H +, приймати електрон для утворення H -, ділитися своїм електроном, водневим зв'язком або утворювати трицентровий зв'язок.
Синтез, реакції та сполуки водню
Перший відомий препарат елементарного водню був в 1671 році, коли Роберт Бойл розчиняв залізо в розведеній кислоті і отримав безбарвний, без запаху, газоподібний продукт. Водень був остаточно ідентифікований як елемент в 1766 році, коли Генрі Кавендіш показав, що вода є єдиним продуктом реакції газу з киснем. Вибухонебезпечні властивості сумішей водню з повітрям були виявлені лише на початку 18 століття; вони частково викликали вражаючий вибух наповненого воднем дирижабля Гінденбурга в 1937 році (рис.\(\PageIndex{4}\)). Через свою надзвичайно низьку молекулярну масу водневий газ важко конденсується до рідини (температура кипіння = 20,3 К), а твердий водень має одну з найнижчих відомих температур плавлення (13,8 К).

Найпоширеніший спосіб отримання невеликої кількості високочистого водневого газу в лабораторії був виявлений Бойлом: реагування активного металу (М), такого як залізо, магній або цинк, з розведеною кислотою:
\[M_{(s)} + 2H^+_{(aq)} \rightarrow H_{2(g)} + M^{2+}_{(aq)} \label{21.1}\]
Водень також може генеруватися шляхом реагування металів, таких як алюміній або цинк, з міцною основою:
\[\mathrm{Al(s)}+\mathrm{OH^-(aq)}+\mathrm{3H_2O(l)}\rightarrow\frac{3}{2}\mathrm{H_2(g)}+\mathrm{[Al(OH)_4]^-(aq)} \label{21.2}\]
Тверді комерційні очищувачі дренажу, такі як Драно, використовують цю реакцію для утворення бульбашок газу, які допомагають розбити засмічення у водостічній трубі. Водень також утворюється шляхом взаємодії іонних гідридів з водою. Оскільки іонні гідриди коштують дорого, ця реакція зазвичай використовується лише для спеціалізованих цілей, таких як отримання газу HD шляхом реагування гідриду з D 2 O:
\[MH_{(s)} + D_2O(l) \rightarrow HD_{(g)} + M^+(aq) + OD^−_{(aq)} \label{21.3}\]
У промислових масштабах Н 2 отримують з метану за допомогою каталітичного парового риформінгу - методу, що використовується для перетворення вуглеводнів у суміш СО і Н 2, відому як синтез-газ, або синтез-газ. Процес здійснюється при підвищених температурах (800°С) в присутності нікелевого каталізатора:
\[\mathrm{CH_4(g)}+\mathrm{H_2O(g)}\xrightarrow{\mathrm{Ni}}\mathrm{CO(g)}+\mathrm{3H_2(g)} \label{21.4}\]
Більшість елементів таблиці Менделєєва утворюють бінарні сполуки з воднем, які в сукупності іменуються гідридами. Бінарні гідриди в свою чергу можна класифікувати одним з трьох способів, кожен зі своїми характерними властивостями. Ковалентні гідриди містять водень, пов'язаний з іншим атомом через ковалентний зв'язок або полярний ковалентний зв'язок. Ковалентні гідриди, як правило, є молекулярними речовинами, які є відносно летючими і мають низькі температури плавлення. Іонні гідриди містять іон гідриду як аніон з катіонами, отриманими з електропозитивних металів. Як і більшість іонних сполук, вони, як правило, є нелеткими твердими речовинами, які містять тривимірні решітки катіонів та аніонів. На відміну від більшості іонних сполук, однак, вони часто розкладаються до Н 2 (г) і вихідного металу після нагрівання. Металеві гідриди утворюються воднем і менш електропозитивними металами, такими як перехідні метали. Властивості металевих гідридів зазвичай схожі з властивостями основного металу. Отже, металеві гідриди найкраще розглядаються як метали, які містять багато атомів водню, присутніх як інтерстиціальні домішки.
Ковалентні гідриди відносно летючі і мають низькі температури плавлення; іонні гідриди, як правило, нелеткі тверді речовини в решітчастому каркасі.
Підсумок та ключовий винос
Водень може втратити електрон, утворюючи протон, отримати електрон для утворення гідридного іона або утворювати ковалентний зв'язок або полярний ковалентний електронно-парний зв'язок. Три ізотопи водень - протій (1 Н або Н), дейтерій (2 Н або D) та тритій (3 Н або Т) - мають різні фізичні властивості. Дейтерій і тритій можуть бути використані як сліди, речовини, які дозволяють біохімікам слідувати шляху молекули через організм або клітину. Водень може утворювати сполуки, що містять протон (H +), гідридний іон (H -), електронно-парний зв'язок з H, водневий зв'язок або трицентровий зв'язок (або електрон-дефіцитний зв'язок), в якій два електрони поділяються між трьома атомами. Газ водню може утворюватися шляхом реакції активного металу з розведеною кислотою, реагуючи Al або Zn з сильною основою, або промислово шляхом каталітичного парового риформінгу, який виробляє синтез-газ, або синтез-газ.