11.7: Електроліз
- Page ID
- 106016
- Щоб зрозуміти електроліз і описати його кількісно.
У цьому розділі ми описали різні гальванічні елементи, в яких для отримання електричної енергії використовується спонтанна хімічна реакція. Однак в електролітичному елементі відбувається зворотний процес, званий електролізом: подається зовнішня напруга для приводу неспонтанної реакції. У цьому розділі ми розглянемо, як будуються електролітичні елементи, і досліджуємо деякі з їх численних комерційних застосувань.
Електролітичні клітини
Якщо побудувати електрохімічну комірку, в якій одним електродом є мідний метал, занурений в розчин 1 М Cu 2 +, а інший електрод - металом кадмію, зануреним в\(\,1\; M\, Cd^{2+}\) розчин і потім замкнути ланцюг, різниця потенціалів між двома відсіками складе 0,74 В. Електрод кадмію почне розчинятися (Cd окислюється до Cd 2 +) і є анодом, тоді як металева мідь буде осідати на мідний електрод (Cu 2 + зменшується до Cu), який є катодом (рис.\(\PageIndex{1a}\)).
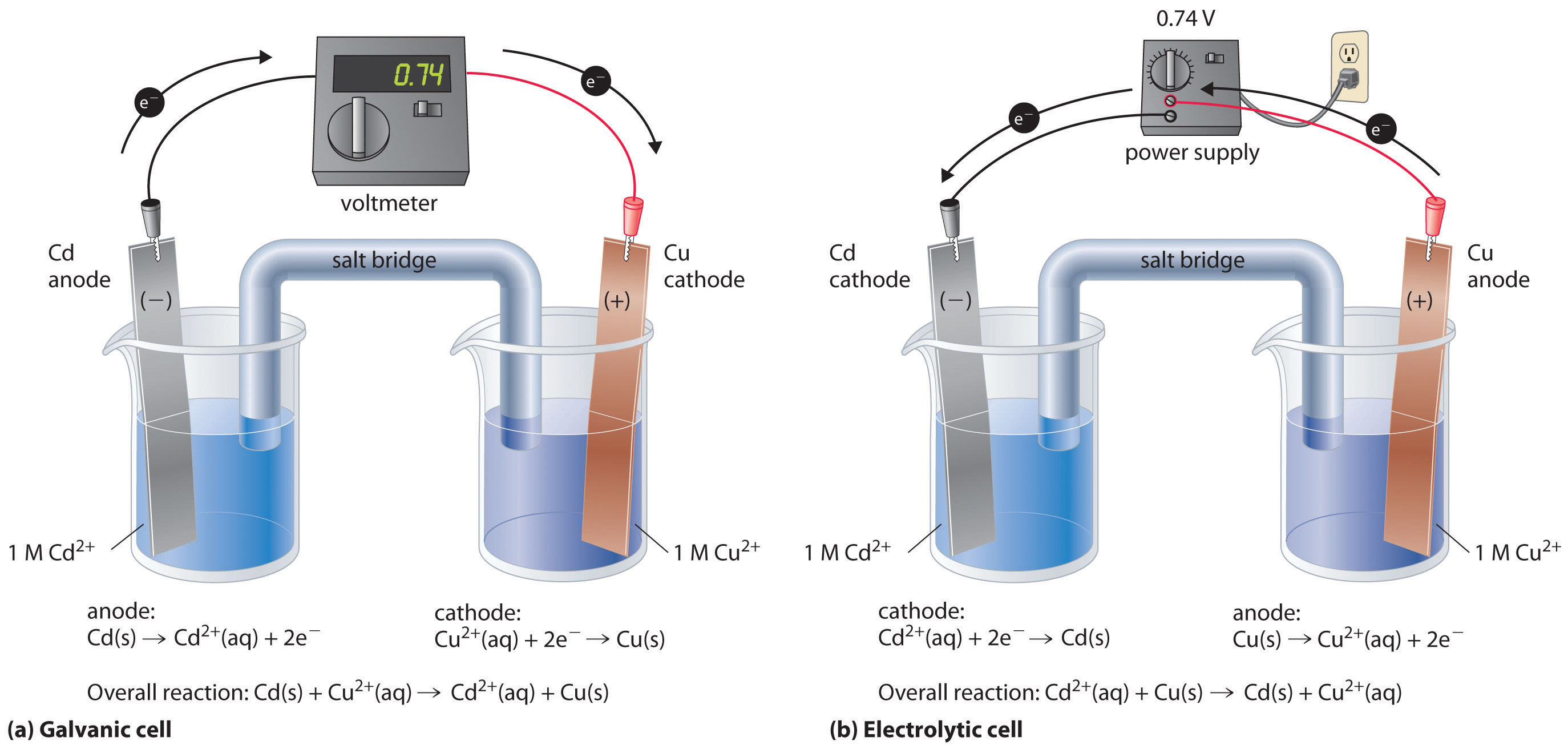
Загальна реакція виглядає наступним чином:
\[ \ce{Cd (s) + Cu^{2+} (aq) \rightarrow Cd^{2+} (aq) + Cu (s)} \nonumber \]
з\(E°_{cell} = 0.74\; V\)
Ця реакція термодинамічно спонтанна, як написано (\(ΔG^o < 0\)):
\[ \begin{align*} \Delta G^\circ &=-nFE^\circ_\textrm{cell} \\[4pt] &=-(\textrm{2 mol e}^-)[\mathrm{96,485\;J/(V\cdot mol)}](\mathrm{0.74\;V}) \\[4pt] &=-\textrm{140 kJ (per mole Cd)} \end{align*} \nonumber \]
У цьому напрямку система виступає в ролі гальванічного елемента.
В електролітичному елементі подається зовнішня напруга для приводу неспонтанної реакції.
Зворотна реакція, зменшення Cd 2 + на Cu, термодинамічно неспонтанна і буде відбуватися тільки при вході 140 кДж. Ми можемо змусити реакцію протікати в зворотному напрямку, застосувавши електричний потенціал більше 0,74 В від зовнішнього джерела живлення. Прикладений напруга змушує електрони через ланцюг в зворотному напрямку, перетворюючи гальванічний елемент в електролітичний елемент. Таким чином, мідний електрод тепер є анодом (Cu окислюється), а кадмієвий електрод тепер є катодом (Cd 2 + зменшується) (рис.\(\PageIndex{1b}\)). Знаки катода і анода переключилися, щоб відобразити потік електронів в ланцюзі. Напівреакції, що відбуваються на катоді і аноді, такі:
- напівреакція на катоді:
\[\ce{Cd^{2+}(aq) + 2e^{−} \rightarrow Cd(s)}\label{20.9.3} \]
з\(E^°_{cathode} = −0.40 \, V\)
- напівреакція на аноді:
\[\ce{Cu(s) \rightarrow Cu^{2+}(aq) + 2e^{−}} \label{20.9.4} \]
з\(E^°_{anode} = 0.34 \, V \)
- Загальна реакція:
\[\ce{Cd^{2+}(aq) + Cu(s) \rightarrow Cd(s) + Cu^{2+}(aq) } \label{20.9.5} \]
з\(E^°_{cell} = −0.74 \: V\)
\(E^°_{cell} < 0\)Тому що загальна реакція - зменшення\(Cd^{2+}\) на\(Cu\) - явно не може відбуватися спонтанно і протікає лише тоді, коли застосовується достатня кількість електричної енергії. Відмінності гальванічних і електролітичних елементів зведені в табл\(\PageIndex{1}\).
| Нерухомість | Гальванічний елемент | Електролітична комірка |
|---|---|---|
| ΔГ | < 0 | > 0 |
| E осередок | > 0 | < 0 |
| Електродний процес | ||
| анод | окислення | окислення |
| катод | скорочення | скорочення |
| Знак електрода | ||
| анод | − | + |
| катод | + | − |
Електролітичні реакції
При досить високих температурах іонні тверді речовини плавиться з утворенням рідин, які надзвичайно добре проводять електрику через високі концентрації іонів. Якщо два інертних електрода вставляються в розплавлений\(\ce{NaCl}\), наприклад, і подається електричний потенціал,\(\ce{Cl^{-}}\) окислюється на аноді, а\(\ce{Na^{+}}\) на катоді зменшується. Загальна реакція виглядає наступним чином:
\[\ce{ 2NaCl (l) \rightarrow 2Na(l) + Cl2(g)} \label{20.9.6} \]
Це зворотне формування\(\ce{NaCl}\) з її елементів. Продукт реакції відновлення - рідкий натрій, оскільки температура плавлення металу натрію становить 97,8° C, що значно нижче температури\(\ce{NaCl}\) (801° C). Приблизно 20 000 тонн металу натрію виробляються комерційно в США щороку електролізом розплавленого\(\ce{NaCl}\) в клітці Даунса (рис.\(\PageIndex{2}\)). У цій спеціалізованій камері спочатку додають\(\ce{CaCl2}\) (температура плавлення = 772° C),\(\ce{NaCl}\) щоб знизити температуру плавлення суміші приблизно до 600° C, тим самим знижуючи експлуатаційні витрати.
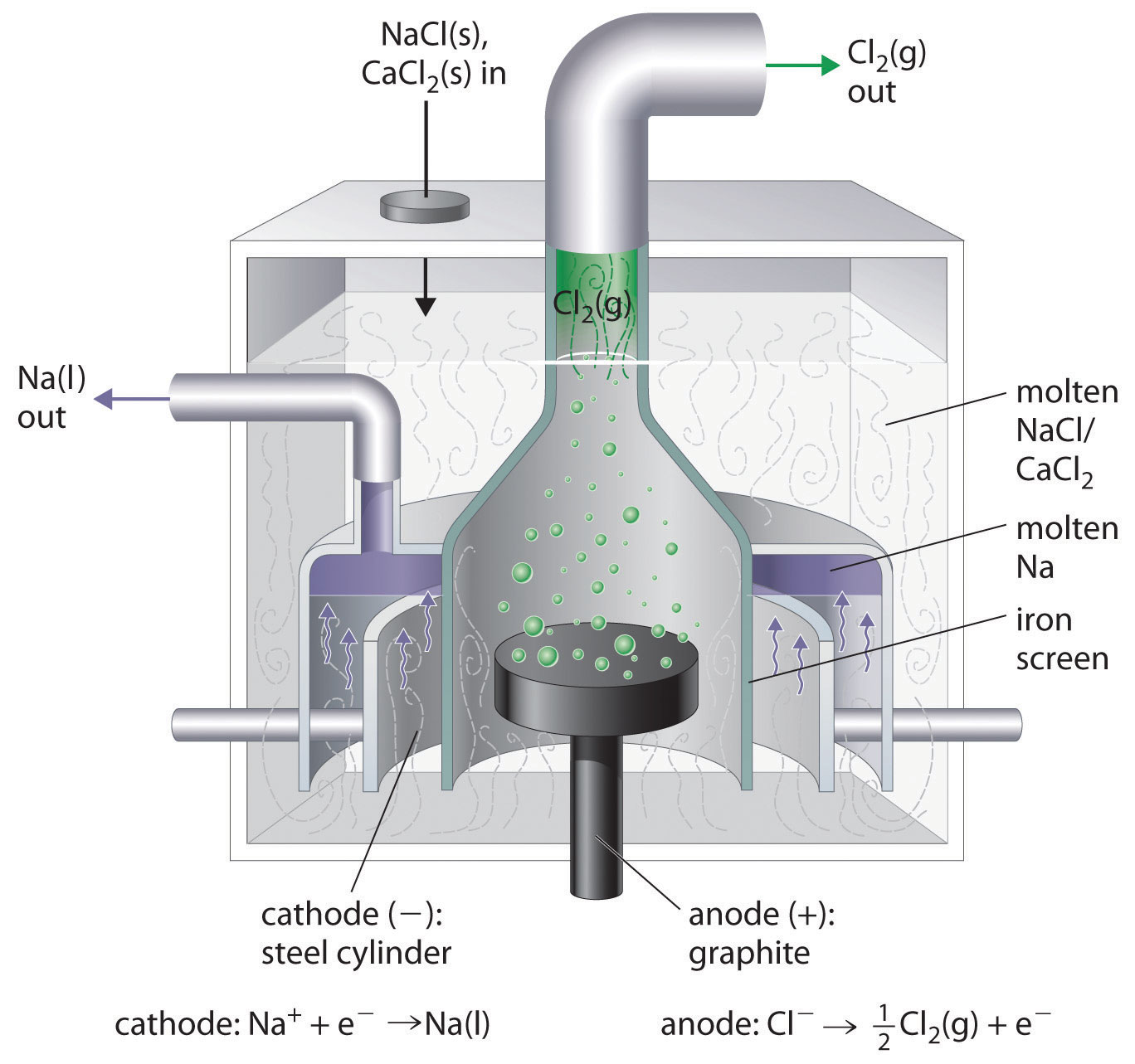
Аналогічно, в процесі Холла - Герульта, який використовується для виробництва алюмінію комерційно, розплавлена суміш приблизно 5% оксиду алюмінію (Al 2 O 3; температура плавлення = 2054° C) та 95% кріоліту (Na 3 AlF 6; температура плавлення = 1012° C) електролізується при температурі близько 1000° C, виробляючи розплавлений алюміній на катоді і газ СО 2 на вуглецевому аноді. Загальна реакція виглядає наступним чином:
\[\ce{2Al2O3(l) + 3C(s) -> 4Al(l) + 3CO2(g)} \label{20.9.7} \]
Іони оксиду вступають в реакцію з окисленим вуглецем на аноді, виробляючи СО 2 (г).
Є два важливі моменти, які слід зробити щодо цих двох комерційних процесів та про електроліз розплавлених солей загалом.
- Електродні потенціали для розплавлених солей, швидше за все, будуть сильно відрізнятися від стандартних потенціалів клітин, перерахованих в таблиці Р2, які складені для відновлення гідратованих іонів у водних розчині в стандартних умовах.
- Використання змішаної сольової системи означає, що існує можливість конкуренції між різними електролітичними реакціями. Коли суміш NaCl і CaCl 2 електролізується, Cl - окислюється, оскільки він є єдиним аніоном, але або Na +, або Ca 2 + можна зменшити. І навпаки, в процесі Холла — Герульта присутній лише один катіон, який може бути відновлений (Al 3 +), але є три види, які можуть окислюватися: C, O 2− та F −.
У процесі Холла - Герульта С окислюється замість O 2 - або F - оскільки кисень і фтор є більш електронегативними, ніж вуглець, а це означає, що C є слабшим окислювачем, ніж O 2 або F 2. Аналогічно, в клітині Даунса ми можемо очікувати, що електроліз суміші NaCl/CaCl 2 виробляє кальцій, а не натрій, оскільки Na трохи менш електронегативний, ніж Ca (θ = 0,93 проти 1,00 відповідно), що робить Na легше окислювати і, навпаки, Na + важче зменшити. По суті, зниження Na + до Na є спостережуваною реакцією. У випадках, коли електронегативність двох видів схожі, інші фактори, такі як утворення складних іонів, стають важливими і можуть визначати результат.
Якщо електролізувати розплавлену суміш MgCl 2 і KBr, які продукти будуть утворюватися на катоді і аноді відповідно?
Дано: ідентичність солей
Запитували: продукти електролізу
Стратегія:
- Перерахуйте всі можливі продукти відновлення і окислення. Виходячи з значень електронегативності, показаних на малюнку 7.5, визначте, які види будуть відновлені, а які види будуть окислюватися.
- Визначте продукти, які будуть утворюватися на кожному електроді.
Рішення
A Можливими продуктами відновлення є Mg і K, а можливі продукти окислення - Cl 2 і Br 2. Оскільки Mg є більш електронегативним, ніж K (θ = 1,31 проти 0,82), цілком ймовірно, що Mg буде зменшений, а не K. Оскільки Cl є більш електронегативним, ніж Br (3,16 проти 2,96), Cl 2 є сильнішим окислювачем, ніж Br 2.
B Електроліз буде виробляти Br 2 на аноді і Mg на катоді.
Прогнозуйте продукти, якщо розплавлена суміш AlBr 3 і LiF електролізується.
- Відповідь
-
Br 2 і Ал
Електроліз також може бути використаний для приводу термодинамічно неспонтанного розкладання води на складові її елементи: Н 2 і О 2. Однак, оскільки чиста вода є дуже поганим електричним провідником, спочатку потрібно додати невелику кількість іонного розчиненого речовини (наприклад, H 2 SO 4 або Na 2 SO 4), щоб збільшити його електропровідність. Введення інертних електродів в розчин і подача між ними напруги призведе до швидкої еволюції бульбашок Н 2 і О 2 (рис.\(\PageIndex{3}\)).

Реакції, які відбуваються, такі:
- катод:\[2H^+_{(aq)} + 2e^− \rightarrow H_{2(g)} \;\;\; E^°_{cathode} = 0 V \label{20.9.8} \]
- анод:\[2H_2O_{(l)} → O_{2(g)} + 4H^+_{(aq)} + 4e^−\;\;\; E^°_{anode} = 1.23\; V \label{20.9.9} \]
- загальний:\[2H_2O_{(l)} → O_{2(g)} + 2H_{2(g)}\;\;\; E^°_{cell} = −1.23 \;V \label{20.9.10} \]
Для системи, що містить електроліт типу Na 2 SO 4, який має незначний вплив на іонізаційну рівновагу рідкої води, рН розчину складе 7,00 і [H +] = [OH −] = 1,0 × 10 −7. Припускаючи, що\(P_\mathrm{O_2}\)\(P_\mathrm{H_2}\) = = 1 атм, ми можемо використовувати стандартні потенціали для обчислення Е для загальної реакції:
\[\begin{align}E_\textrm{cell} &=E^\circ_\textrm{cell}-\left(\dfrac{\textrm{0.0591 V}}{n}\right)\log(P_\mathrm{O_2}P^2_\mathrm{H_2}) \\ &=-\textrm{1.23 V}-\left(\dfrac{\textrm{0.0591 V}}{4}\right)\log(1)=-\textrm{1.23 V}\end{align} \label{20.9.11} \]
Таким чином, E клітина становить −1,23 В, що є значенням E° клітини, якщо реакція проводиться в присутності 1 M H +, а не при рН 7,0.
На практиці для електролізу води потрібно напруга приблизно на 0,4-0,6 В більше розрахункового значення. Ця додана напруга, звана перенапругою, являє собою додаткову рушійну силу, необхідну для подолання бар'єрів, таких як велика енергія активації для утворення газу на поверхні металу. Перенапруги потрібні у всіх електролітичних процесах, які пояснюють, чому, наприклад, потрібно подати приблизно 14 В для підзарядки акумулятора 12 В у вашому автомобілі.
Загалом, будь-який метал, який не реагує легко з водою для отримання водню, може бути отриманий електролітичним відновленням водного розчину, який містить катіон металу. Метали p-блоку і більшість перехідних металів відносяться до цієї категорії, але метали з високими ступенями окислення, які утворюють оксоаніони, не можуть бути зведені до металу простим електролізом. Активні метали, такі як алюміній і групи 1 і 2, настільки легко реагують з водою, що їх можна отримати тільки електролізом розплавлених солей. Аналогічно будь-який неметалічний елемент, який не легко окислює воду до O 2, може бути отриманий електролітичним окисленням водного розчину, який містить відповідний аніон. На практиці серед неметалів за допомогою цього методу не можна приготувати тільки F 2. Оксоаніони неметалів у найвищих ступенях окислення, такі як NO 3 -, SO 4 2 -, PO 4 3 -, зазвичай важко зменшити електрохімічно і зазвичай поводяться як іони глядачів, які залишаються в розчині під час електролізу.
Загалом, будь-який метал, який не реагує легко з водою для отримання водню, може бути отриманий електролітичним відновленням водного розчину, який містить катіон металу.
Гальванічне покриття
У процесі, який називається гальванічним покриттям, шар другого металу наноситься на металевий електрод, який діє як катод під час електролізу. Гальваніка застосовується для поліпшення зовнішнього вигляду металевих предметів і захисту їх від корозії. Приклади гальванічних покриттів включають шар хрому, виявлений на багатьох сантехнічних приладах або (в попередні дні) на бамперах і ковпачках автомобілів, а також тонкий шар дорогоцінного металу, який покриває срібний посуд або ювелірні вироби. У всіх випадках основне поняття однакове. Схематичний вигляд апарату для гальванічного срібла і фотографія комерційної гальванічної осередку наведені на малюнку\(\PageIndex{4}\).
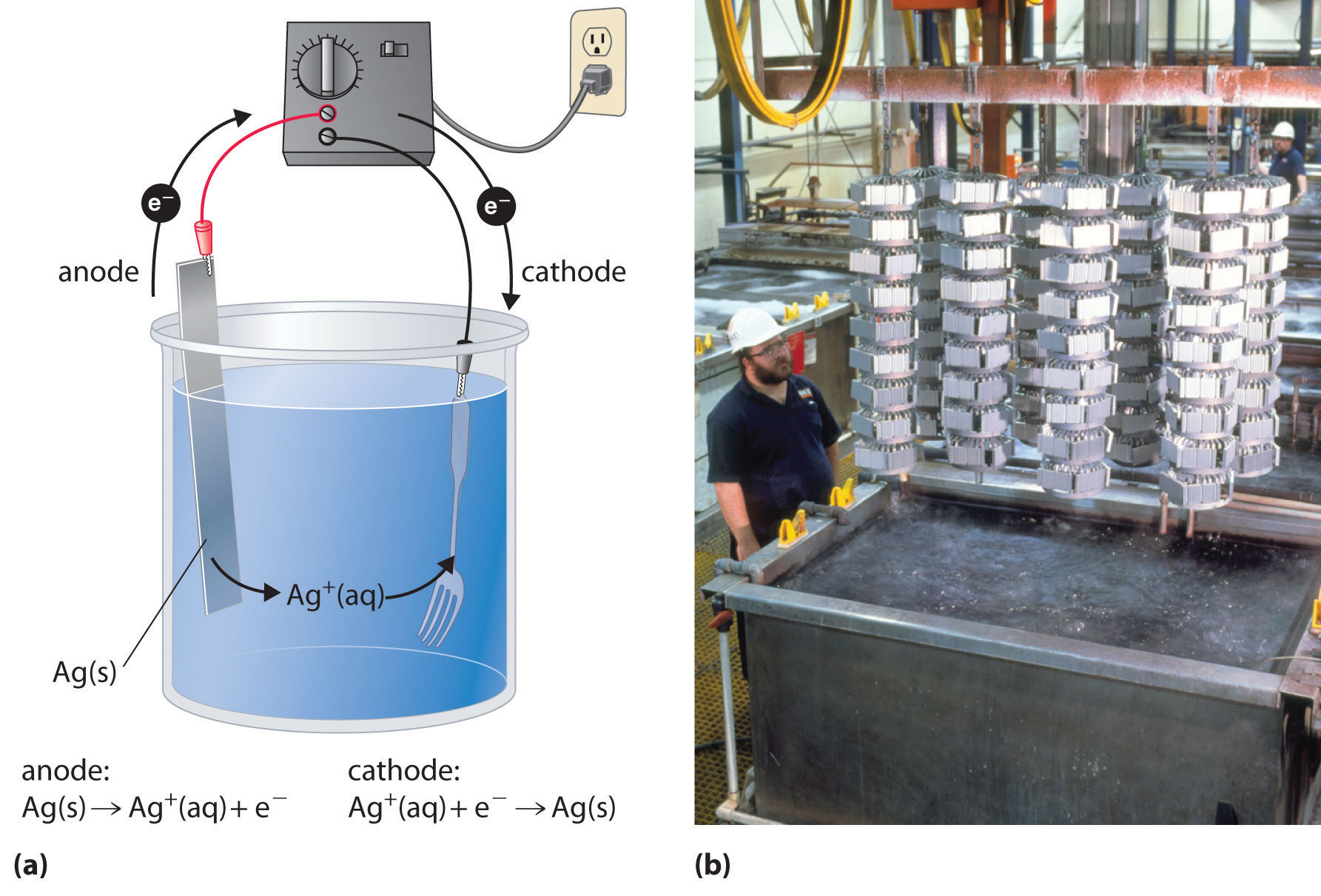
Напівреакції при гальванічному покритті виделкою, наприклад, сріблом такі:
- катод (вилка):\[\ce{Ag^{+}(aq) + e^{−} -> Ag(s)} \quad E°_{cathode} = 0.80 V\ \nonumber \]
- анод (срібний брусок):\[\ce{Ag(s) -> Ag^{+}(aq) + e^{-}} \quad E°_{anode} = 0.80 V \nonumber \]
Загальна реакція - це перенесення срібного металу з одного електрода (срібного стрижня, що виконує роль анода) на інший (вилка, яка виконує роль катода). \(E^o_{cell} = 0\, V\)Тому що для керування процесом гальванічного покриття потрібно лише невелика прикладена напруга. На практиці в розчин для покриття можуть бути додані різні інші речовини, щоб контролювати його електропровідність і регулювати концентрацію вільних іонів металів, забезпечуючи тим самим гладке, рівне покриття.
Кількісні міркування
Якщо ми знаємо стехіометрію реакції електролізу, кількість пройденого струму та тривалість часу, ми можемо обчислити кількість матеріалу, споживаного або виробленого в реакції. І навпаки, ми можемо використовувати стехіометрію для визначення поєднання струму і часу, необхідного для отримання заданої кількості матеріалу.
Кількість матеріалу, яке окислюється або відновлюється у електрода під час електрохімічної реакції, визначається стехіометрією реакції і кількістю заряду, який переноситься. Наприклад, в реакції
\[\ce{Ag^{+}(aq) + e^{−} → Ag(s)} \nonumber \]
1 моль електронів зменшує 1\(\ce{Ag^{+}}\) моль\(\ce{Ag}\) металу. На відміну від цього, в реакції
\[\ce{Cu^{2+}(aq) + 2e^{−} → Cu(s)} \nonumber \]
1 моль електронів зменшує лише 0,5\(\ce{Cu^{2+}}\) моль\(\ce{Cu}\) металу. Нагадаємо, що заряд на 1 моль електронів становить 1 фарадей (1 F), що дорівнює 96 485 С. Таким чином, ми можемо обчислити кількість молів електронів, переданих при проходженні відомого струму через осередок за заданий проміжок часу. Сумарний заряд (\(q\)в кулоні) переданий - це добуток струму (\(I\)в амперах) і часу (\(t\), в секундах):
\[ q = I \times t \label{20.9.14} \]
Стехіометрія реакції і загальний переведений заряд дозволяють обчислити кількість продукту, що утворюється в ході реакції електролізу, або кількість металу, осадженого в процесі гальваніки.
Наприклад, якщо через водний розчин\(\ce{CuSO4}\) протягом 6,0 хв проходить струм 0,60 А, то загальна кількість кулонів заряду, що проходить через осередок, виглядає наступним чином:
\[\begin{align*} q &= \textrm{(0.60 A)(6.0 min)(60 s/min)} \\[4pt] &=\mathrm{220\;A\cdot s} \\[4pt] &=\textrm{220 C} \end{align*} \nonumber \]
Таким чином, кількість молів електронів,\(\ce{Cu^{2+}}\) що передаються
\[\begin{align*} \textrm{moles e}^- &=\dfrac{\textrm{220 C}}{\textrm{96,485 C/mol}} \\[4pt] &=2.3\times10^{-3}\textrm{ mol e}^- \end{align*} \nonumber \]
Оскільки для зменшення одного іона Cu 2 + потрібні два електрони, загальна кількість вироблених молів Cu становить половину кількості молів перенесених електронів, або 1,2 × 10 −3 моль. Це відповідає 76 мг Cu. У комерційних процесах електрорафінування використовуються значно вищі струми (більші або рівні 50 000 А), відповідні приблизно 0,5 Ф/с, а час реакції становить близько 3-4 тижнів.
Посріблена ложка зазвичай містить близько 2,00 г Ag. Якщо для досягнення бажаної товщини покриття Ag потрібно 12,0 ч, який середній струм на ложку повинен протікати в процесі гальваніки, припускаючи ефективність 100%?
Задано: маса металу, час і ефективність
Запитано: необхідний струм
Стратегія:
- Розрахуйте кількість молів металу, відповідне заданій масі, що передається.
- Запишіть реакцію і визначте кількість молів електронів, необхідних для процесу гальваніки.
- Використовуйте визначення фарадея для обчислення кількості необхідних кулонів. Потім конвертуємо кулони в струм в амперах.
Рішення
A Потрібно спочатку визначити кількість родимок Ag, що відповідає 2,00 г Ag:
\(\textrm{moles Ag}=\dfrac{\textrm{2.00 g}}{\textrm{107.868 g/mol}}=1.85\times10^{-2}\textrm{ mol Ag}\)
B Реакція відновлення становить Ag + (aq) + e − → Ag (s), тому 1 моль електронів виробляє 1 моль срібла.
C Використовуючи визначення фарадея,
Струм в амперах, необхідний для доставки цієї кількості заряду за 12.0 год, тому
\ [\ почати {вирівнювати*}\ текст {ампер} &=\ dfrac {1.78\ times10^3\ текст {C}} {(\ текст {12.0 h}) (\ текст {60 хв/год}) (\ текст {60 с/хв})}\\
& = 4.12\ times10^ {-2}\ текст {C/s}} =4.12\ times10^ {-2}\ текст {A}\ end {align*}\ number\]
Оскільки процес гальванічного покриття, як правило, набагато менше 100% ефективного (типові значення ближче до 30%), фактичний необхідний струм перевищує 0,1 А.
Типовий алюмінієвий безалкогольний напій може важити близько 29 м Скільки часу потрібно для отримання цієї кількості Al (s) в процесі Халл—Герульта, використовуючи струм 15 А для зменшення розплавленої суміші Al 2 O 3 /Na 3 AlF 6?
- Відповідь
-
5.8 год
Гальванічне покриття: Гальванічне покриття (відкривається в новому вікні) [youtu.be]
Резюме
При електролізі подається зовнішня напруга для приводу неспонтанної реакції. Кількість окисленого або відновленого матеріалу можна розрахувати по стехіометрії реакції і кількості перенесеного заряду. Взаємозв'язок заряду, струму і часу:
\[ q = I \times t \nonumber \]
При електролізі подається зовнішня напруга для приводу неспонтанної реакції. Електроліз також може бути використаний для отримання Н 2 і О 2 з води. На практиці додаткова напруга, зване перенапругою, повинна застосовуватися для подолання таких факторів, як велика енергія активації та потенціал переходу. Гальванічне покриття - це процес, за допомогою якого другий метал наноситься на металеву поверхню, тим самим покращуючи зовнішній вигляд об'єкта або забезпечуючи захист від корозії. Кількість матеріалу, споживаного або виробленого в реакції, можна розрахувати по стехіометрії реакції електролізу, кількості пройденого струму і тривалості електролітичної реакції.