11.5: Акумулятори
- Page ID
- 106023
Оскільки гальванічні елементи можуть бути автономними та переносними, їх можна використовувати як акумулятори та паливні елементи. Акумулятор (елемент зберігання) - це гальванічний елемент (або серія гальванічних елементів), який містить всі реагенти, необхідні для виробництва електроенергії. На відміну від цього, паливний елемент - це гальванічний елемент, який вимагає постійної зовнішньої подачі одного або декількох реагентів для вироблення електроенергії. У цьому розділі ми опишемо хімію, що стоїть за деякими з найбільш поширених типів батарей і паливних елементів.
Акумулятори
Існує два основних типи акумуляторів: одноразові або первинні батареї, в яких реакції електродів є фактично незворотними і які не можна заряджати; і акумуляторні, або вторинні, батареї, які утворюють нерозчинний продукт, який прилипає до електродів. Ці батареї можна заряджати, застосовуючи електричний потенціал в зворотному напрямку. Процес підзарядки тимчасово перетворює акумуляторну батарею з гальванічного елемента в електролітичний елемент.
Акумулятори - це спритно розроблені пристрої, які базуються на тих же фундаментальних законам, що і гальванічні елементи. Основна відмінність між батареями та гальванічними елементами, які ми описали раніше, полягає в тому, що комерційні батареї використовують тверді речовини або пасти, а не розчини як реагенти, щоб максимізувати електричний вихід на одиницю маси. Використання висококонцентрованих або твердих реагентів має ще один сприятливий ефект: концентрації реагентів та продуктів не сильно змінюються під час розряду акумулятора; отже, вихідна напруга залишається надзвичайно постійною під час процесу розряду. Ця поведінка на відміну від поведінки комірки Zn/Cu, вихід якої логарифмічно зменшується в міру протікання реакції (рис.\(\PageIndex{1}\)). Коли акумулятор складається з більш ніж одного гальванічного елемента, елементи, як правило, з'єднані послідовно - тобто з позитивним (+) клемою однієї комірки, з'єднаною з негативною (−) клемою наступної тощо. Таким чином, загальна напруга акумулятора є сумою напруг окремих елементів.
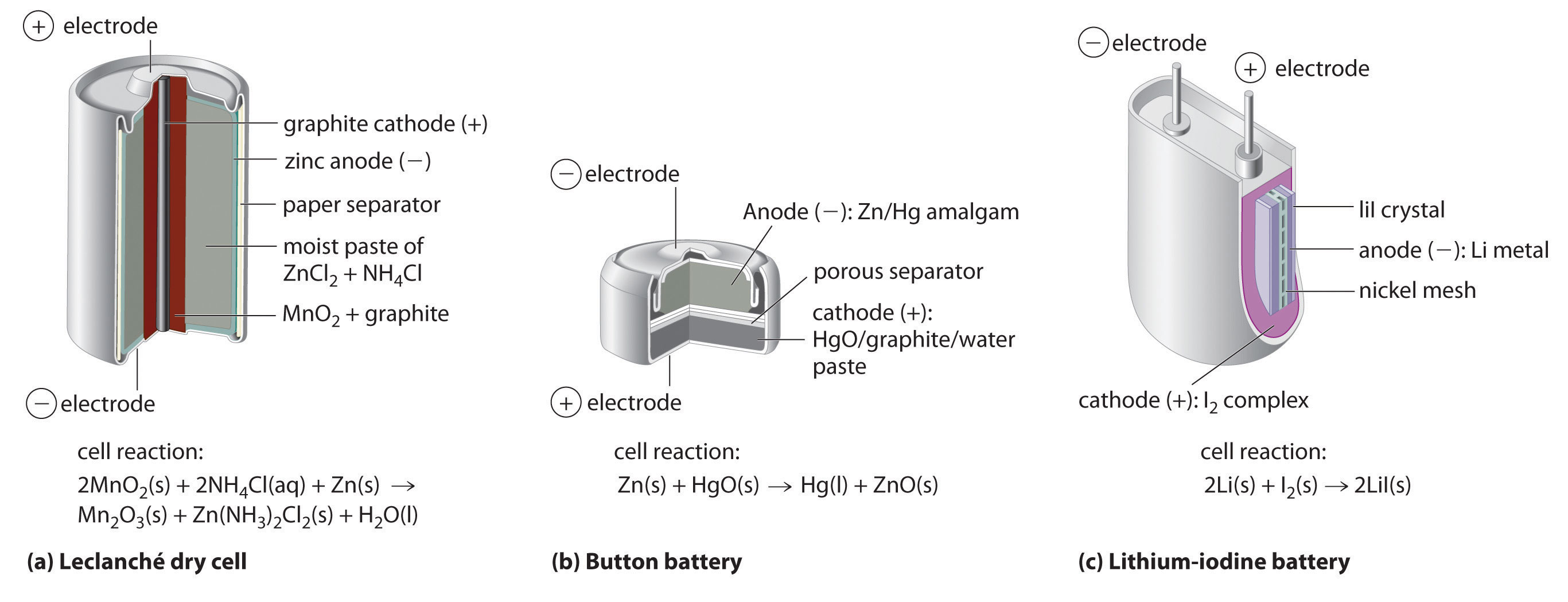
Основна відмінність між батареями та гальванічними елементами полягає в тому, що комерційні, як правило, батареї використовують тверді речовини або пасти, а не розчини як реагенти, щоб максимізувати електричний вихід на одиницю маси. Очевидним винятком є стандартний автомобільний акумулятор, в якому використовувався розчин фазової хімії.
Сухі клітини Лекланше
Сухий елемент, на сьогоднішній день найпоширеніший тип акумуляторів, використовується в ліхтарях, електронних пристроях, таких як Walkman і Game Boy, і багатьох інших пристроях. Хоча сухий елемент був запатентований в 1866 році французьким хіміком Жоржем Лекланше і щорічно продається понад 5 мільярдів таких клітин, деталі його електродної хімії досі не до кінця зрозумілі. Незважаючи на свою назву, суха комірка Лекланше насправді є «вологою коміркою»: електроліт - це кисла паста на водній основі\(MnO_2\)\(NH_4Cl\)\(ZnCl_2\), що містить графіт та крохмаль (частина (а) на рис.\(\PageIndex{1}\)). Напівреакції на аноді і катоді можна підсумувати наступним чином:
- катод (редукційний):
\[\ce{2MnO2(s) + 2NH^{+}4(aq) + 2e^{−} -> Mn2O3(s) + 2NH3(aq) + H2O(l)} \nonumber \]
- анод (окислення):
\[\ce{Zn(s) -> Zn^{2+}(aq) + 2e^{−}} \nonumber \]
\(\ce{Zn^{2+}}\)Іони, утворені окисленням\(\ce{Zn(s)}\) на аноді, реагують з\(\ce{NH_3}\) утвореними на катоді і\(\ce{Cl^{−}}\) іонами, присутніми в розчині, тому загальна реакція клітин виглядає наступним чином:
- загальна реакція:
\[\ce{2MnO2(s) + 2NH4Cl(aq) + Zn(s) -> Mn2O3(s) + Zn(NH3)2Cl2(s) + H2O(l)} \label{Eq3} \]
Суха камера виробляє близько 1,55 В і коштує недорого у виготовленні. Однак це не дуже ефективно виробляє електричну енергію, оскільки лише відносно невелика частка\(\ce{MnO2}\) того, що знаходиться біля катода, насправді зменшується, і лише невелика частка катода цинку фактично споживається, коли розряди клітини. Крім того, сухі клітини мають обмежений термін зберігання, оскільки\(\ce{Zn}\) анод спонтанно реагує з\(\ce{NH4Cl}\) електролітом, викликаючи корозію корпусу і дозволяючи вмісту витікати назовні.
Лужна батарея - це, по суті, клітина Лекланше, пристосована для роботи в лужних або основних умовах. Напівреакції, що відбуваються в лужній батареї, такі:
- катод (редукційний)
\[\ce{2MnO2(s) + H2O(l) + 2e^{−} -> Mn2O3(s) + 2OH^{−}(aq)} \nonumber \]
- анод (окислення):
\[\ce{Zn(s) + 2OH^{−}(aq) -> ZnO(s) + H2O(l) + 2e^{−}} \nonumber \]
- загальна реакція:
\[\ce{Zn(s) + 2MnO2(s) -> ZnO(s) + Mn2O3(s)} \nonumber \]
Цей акумулятор також виробляє близько 1,5 В, але він має більш тривалий термін зберігання і більш постійну вихідну напругу, оскільки комірка розряджається, ніж суха комірка Лекланше. Хоча лужний акумулятор у виробництві дорожче, ніж сухий елемент Leclanché, покращена продуктивність робить цю батарею більш економічно вигідною.
Кнопкові батареї
Хоча деякі невеликі кнопкові акумулятори, що використовуються для живлення годин, калькуляторів та камер, є мініатюрними лужними елементами, більшість засновані на зовсім іншій хімії. У цих «кнопкових» батареях анод - це амальгама цинк-ртуть, а не чистий цинк, і катод використовує\(\ce{HgO}\) або\(\ce{Ag2O}\) як окислювач, а не на\(\ce{MnO2}\) малюнку\(\PageIndex{1b}\)).

Катод, анод і загальні реакції і вихід комірки для цих двох типів кнопочних батарей такі (дві напівреакції відбуваються на аноді, але показана загальна напівреакція окислення):
- катод (ртутний акумулятор):\[\ce{HgO(s) + H2O(l) + 2e^{−} -> Hg(l) + 2OH^{−}(aq)} \nonumber \]
- Анод (ртутний акумулятор):\[\ce{Zn + 2OH^{−} -> ZnO + H2O + 2e^{−}} \nonumber \]
- загальна реакція (ртутний акумулятор):\[\ce{Zn(s) + 2HgO(s) -> 2Hg(l) + ZnO(s)} \nonumber \] с\(E_{cell} = 1.35 \,V\).
- реакція катода (срібна батарея):\[\ce{Ag2O(s) + H2O(l) + 2e^{−} -> 2Ag(s) + 2OH^{−}(aq)} \nonumber \]
- анод (срібний акумулятор):\[\ce{Zn + 2OH^{−} -> ZnO + H2O + 2e^{−}} \nonumber \]
- Загальна реакція (срібна батарея):\[\ce{Zn(s) + 2Ag2O(s) -> 2Ag(s) + ZnO(s)} \nonumber \] с\(E_{cell} = 1.6 \,V\).
Основними перевагами ртутних і срібних елементів є їх надійність і високе співвідношення вихідної маси. Ці фактори роблять їх ідеальними для застосувань, де малі розміри мають вирішальне значення, як у камерах та слухових апаратах. Недоліками є витрати та екологічні проблеми, спричинені утилізацією важких металів, таких як\(\ce{Hg}\) і\(\ce{Ag}\).
Літій-йодний акумулятор
Жоден з описаних вище батарей не є насправді «сухим». Всі вони містять невелику кількість рідкої води, що додає значної маси і викликає потенційні проблеми корозії. Отже, значні зусилля були витрачені на розробку безводних батарей. Однією з небагатьох комерційно успішних безводних акумуляторів є літій-йодний акумулятор. Анод є металевим літієм, а катод являє собою твердий комплекс\(I_2\). Розділення їх являє собою шар твердого тіла\(LiI\), який діє як електроліт, дозволяючи дифузію іонів Li +. Реакції електродів такі:
- катод (редукційний):
\[I_{2(s)} + 2e^− \rightarrow {2I^-}_{(LiI)}\label{Eq11} \]
- анод (окислення):
\[2Li_{(s)} \rightarrow 2Li^+_{(LiI)} + 2e^− \label{Eq12} \]
- загальний:
\[2Li_{(s)}+ I_{2(s)} \rightarrow 2LiI_{(s)} \label{Eq12a} \]
з\(E_{cell} = 3.5 \, V\)

Як показано на частині (c) на малюнку\(\PageIndex{1}\), типовий літій-йодний акумулятор складається з двох клітин, розділених металевою сіткою з нікелевого металу, яка збирає заряд з анода. Через високий внутрішній опір, викликаний твердим електролітом, може бути втягнутий лише низький струм. Тим не менш, такі батареї зарекомендували себе як довговічні (до 10 років) і надійні. Тому вони використовуються в додатках, де часта заміна важка або небажана, наприклад, в кардіостимуляторах та інших медичних імплантатах та в комп'ютерах для захисту пам'яті. Ці батареї також використовуються в охоронних передавачах і димових сигналізаціях. Інші батареї на основі літієвих анодів і твердих електролітів знаходяться в стадії розробки\(TiS_2\), використовуючи, наприклад, для катода.
Сухі елементи, кнопкові батареї та літій-йодні батареї є одноразовими і не можуть бути заряджені після їх розрядки. Акумуляторні батареї, навпаки, пропонують значні економічні та екологічні переваги, оскільки їх можна заряджати та розряджати багато разів. В результаті витрати на виробництво та утилізацію різко знижуються за певну кількість годин використання акумулятора. Дві звичайні акумуляторні батареї - це нікель-кадмієвий акумулятор та свинцево-кислотний акумулятор, про які ми опишемо далі.
Нікель-кадмієвий (NiCad) акумулятор
Нікель-кадмієвий або NiCad, акумулятор використовується в невеликих електроприладах та пристроях, таких як дрилі, портативні пилососи та цифрові тюнери AM/FM. Це клітина на водній основі з кадмієвим анодом і високоокисленим нікелевим катодом, який зазвичай описується як оксо-гідроксид нікелю (III), NiO (OH). Як показано на малюнку\(\PageIndex{2}\), конструкція максимально збільшує площу поверхні електродів і мінімізує відстань між ними, що зменшує внутрішній опір і робить можливим досить високий струм розряду.

Реакції електродів під час розряду\(NiCad\) акумулятора такі:
- катод (редукційний):
\[2NiO(OH)_{(s)} + 2H_2O_{(l)} + 2e^− \rightarrow 2Ni(OH)_{2(s)} + 2OH^-_{(aq)} \label{Eq13} \]
- анод (окислення):
\[Cd_{(s)} + 2OH^-_{(aq)} \rightarrow Cd(OH)_{2(s)} + 2e^- \label{Eq14} \]
- загальний:
\[Cd_{(s)} + 2NiO(OH)_{(s)} + 2H_2O_{(l)} \rightarrow Cd(OH)_{2(s)} + 2Ni(OH)_{2(s)} \label{Eq15} \]
\(E_{cell} = 1.4 V\)
Оскільки продуктами напівреакцій розряду є тверді речовини, які прилипають до електродів [Cd (OH) 2 і 2Ni (OH) 2], загальна реакція легко змінюється, коли клітина перезаряджається. Хоча клітини NiCad легкі, акумуляторні та мають високу ємність, вони мають певні недоліки. Наприклад, вони, як правило, швидко втрачають ємність, якщо не дозволяють повністю розряджатися перед підзарядкою, вони погано зберігаються протягом тривалого періоду часу, коли повністю заряджені, і вони представляють значні проблеми з навколишнім середовищем та утилізацією через токсичність кадмію.
Варіацією батареї NiCad є нікель-металгідридний акумулятор (NiMH), що використовується в гібридних автомобілей, пристроях бездротового зв'язку та мобільних обчислень. Загальне хімічне рівняння для цього типу акумуляторів виглядає наступним чином:
\[NiO(OH)_{(s)} + MH \rightarrow Ni(OH)_{2(s)} + M_{(s)} \label{Eq16} \]
Акумулятор NiMH має покращення ємності на 30% - 40% порівняно з акумулятором NiCad; він є більш екологічним, тому зберігання, транспортування та утилізація не підлягають екологічному контролю; і він не настільки чутливий до підзарядки пам'яті. Однак це залежить від 50% більшої швидкості саморозряду, обмеженого терміну служби та більш високого технічного обслуговування, і це дорожче, ніж акумулятор NiCad.
Директива 2006/66/EC Європейського Союзу забороняє розміщення на ринку портативних акумуляторів, які містять більше 0,002% кадмію за вагою. Метою цієї директиви було покращити «екологічні показники акумуляторів та акумуляторів»
Свинцево-кислотний (свинцевий накопичувач) акумулятор
Свинцево-кислотний акумулятор використовується для забезпечення пускової потужності практично в кожному автомобільному та морському двигуні на ринку. Морські та автомобільні акумулятори зазвичай складаються з декількох елементів, з'єднаних послідовно. Загальна напруга, що генерується акумулятором, - це потенціал на комірку (E° комірки), що перевищує кількість комірок.

Як показано на малюнку\(\PageIndex{3}\), анод кожної осередку в свинцевому акумуляторі являє собою пластину або сітку з губчастого свинцевого металу, а катод являє собою аналогічну сітку, що містить порошкоподібну сітку, що містить порошкоподібний діоксид свинцю (\(PbO_2\)). Електроліт зазвичай являє собою приблизно 37% розчин (по масі) сірчаної кислоти у воді, щільністю 1,28 г/мл (близько 4,5 М\(H_2SO_4\)). Оскільки окислювально-активні види є твердими речовинами, немає необхідності відокремлювати електроди. Електродні реакції в кожній клітині під час розряду такі:
- катод (редукційний):
\[PbO_{2(s)} + HSO^−_{4(aq)} + 3H^+_{(aq)} + 2e^− \rightarrow PbSO_{4(s)} + 2H_2O_{(l)} \label{Eq17} \]
з\(E^°_{cathode} = 1.685 \; V\)
- анод (окислення):
\[Pb_{(s)} + HSO^−_{4(aq)} \rightarrow PbSO_{4(s) }+ H^+_{(aq)} + 2e^−\label{Eq18} \]
з\(E^°_{anode} = −0.356 \; V\)
- загальний:
\[Pb_{(s)} + PbO_{2(s)} + 2HSO^−_{4(aq)} + 2H^+_{(aq)} \rightarrow 2PbSO_{4(s)} + 2H_2O_{(l)} \label{Eq19} \]
і\(E^°_{cell} = 2.041 \; V\)
У міру розрядження клітини на електродах\(PbSO_4\) утворюється порошок. Більш того, витрачається сірчана кислота і виробляється вода, зменшуючи щільність електроліту і забезпечуючи зручний спосіб контролю стану акумулятора шляхом простого вимірювання щільності електроліту. Це часто робиться із застосуванням ареометра.
Ареометр може бути використаний для перевірки питомої ваги кожної комірки як міри її стану заряду (www.youtube.com/ watchv=srCoqFl6GQQ).
Коли зовнішня напруга понад 2,04 В на елемент подається на свинцево-кислотну батарею, реакції електрода зворотні, і\(PbSO_4\) перетворюється назад в металевий свинець і\(PbO_2\). Однак якщо акумулятор заряджається занадто енергійно, то електроліз води може відбутися:
\[ 2H_2O_{(l)} \rightarrow 2H_{2(g)} +O_{2 (g)} \label{EqX} \]
Це призводить до виділення потенційно вибухонебезпечного водневого газу. Утворені таким чином бульбашки газу можуть витіснити частину\(PbO_2\) частинок\(PbSO_4\) або з сіток, дозволяючи їм впасти на дно клітини, де вони можуть накопичуватися і викликати внутрішнє коротке замикання. Таким чином, процес підзарядки необхідно ретельно контролювати, щоб оптимізувати термін служби акумулятора. Однак при належному догляді свинцево-кислотний акумулятор можна розряджати і заряджати тисячі разів. В автомобілі генератор змінного струму подає електричний струм, що викликає реакцію розряду в зворотному напрямку.
Паливні елементи
Паливний елемент - це гальванічний елемент, який вимагає постійної зовнішньої подачі реагентів, оскільки продукти реакції безперервно видаляються. На відміну від акумулятора, він не зберігає хімічну або електричну енергію; паливний елемент дозволяє витягувати електричну енергію безпосередньо з хімічної реакції. В принципі, це повинен бути більш ефективним процесом, ніж, наприклад, спалювання палива для приводу двигуна внутрішнього згоряння, який перетворює генератор, який, як правило, менш 40% ефективний, і насправді ефективність паливного елемента, як правило, становить від 40% до 60%. На жаль, значні проблеми з вартістю та надійністю перешкоджали широкому впровадженню паливних елементів. На практиці їх використання було обмежено додатками, в яких маса може бути значним фактором витрат, наприклад, пілотованими космічними апаратами США.
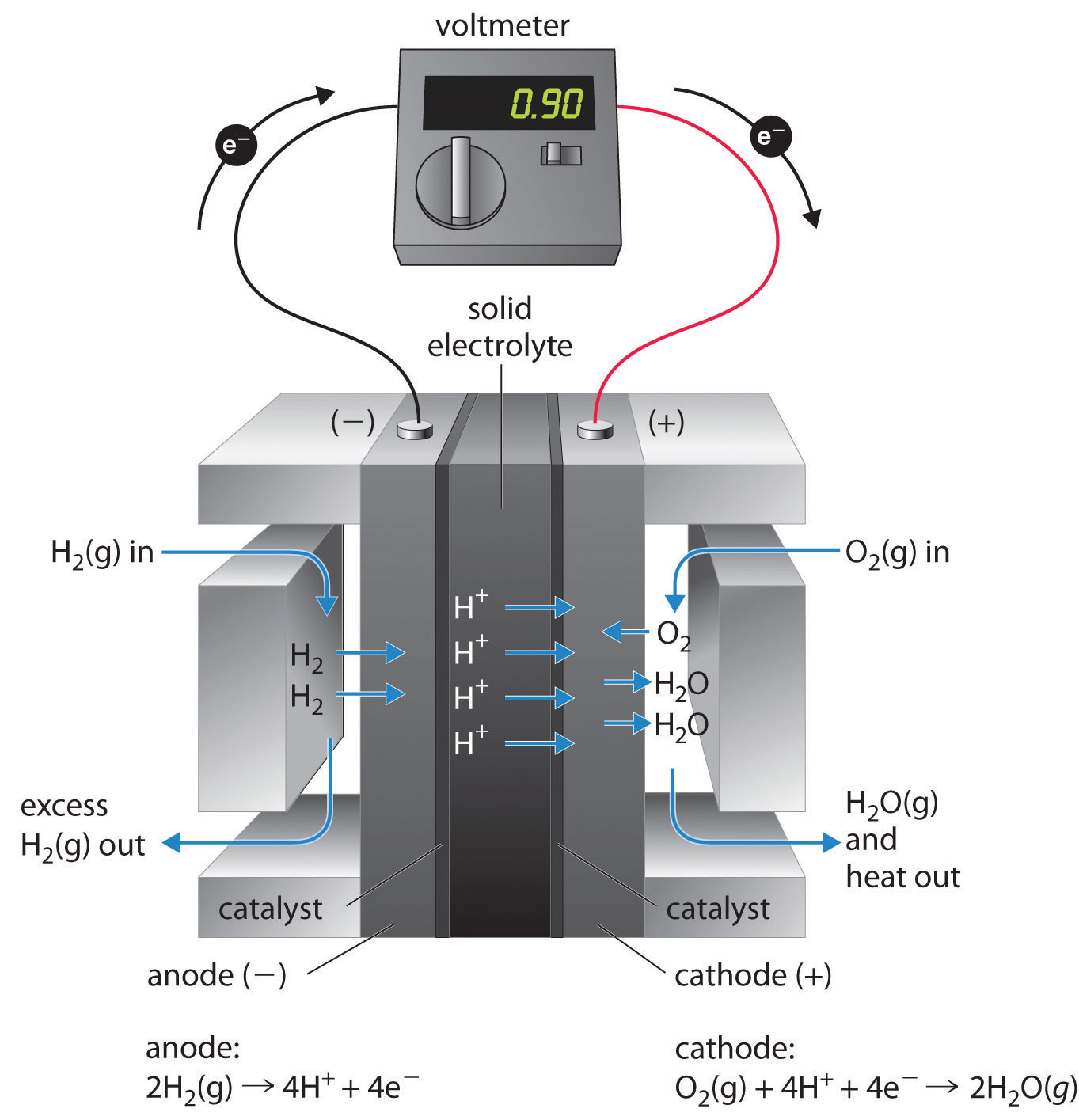
Ці космічні апарати використовують воднево-кисневий паливний елемент, який вимагає безперервного введення H 2 (g) та O 2 (g), як показано на малюнку\(\PageIndex{4}\). Реакції електродів такі:
- катод (редукційний):
\[O_{2(g)} + 4H^+ + 4e^− \rightarrow 2H_2O_{(g)} \label{Eq20} \]
- анод (окислення):
\[2H_{2(g)} \rightarrow 4H^+ + 4e^− \label{Eq21} \]
- загальний:
\[2H_{2(g)} + O_{2(g)} \rightarrow 2H_2O_{(g)} \label{Eq22} \]
Загальна реакція являє собою по суті беззабруднене перетворення водню та кисню у воду, яка потім збирається та використовується в космічних апаратах. Хоча цей тип паливного елемента повинен виробляти 1,23 В в стандартних умовах, на практиці пристрій досягає всього близько 0,9 В. Одним з основних бар'єрів для досягнення більшої ефективності є той факт, що чотириелектронне зниження\(O_2 (g)\) на катоді по суті досить повільне, що обмежує струм що може бути досягнуто. Всі великі виробники автомобілів мають великі науково-дослідні програми за участю паливних елементів: однією з найважливіших цілей є розробка кращого каталізатора для скорочення\(O_2 (g)\).
Резюме
Комерційні батареї - це гальванічні елементи, які використовують тверді речовини або пасти як реагенти для максимізації електричної потужності на одиницю маси. Акумулятор - це міститься блок, який виробляє електроенергію, тоді як паливний елемент - це гальванічний елемент, який вимагає постійної зовнішньої подачі одного або декількох реагентів для виробництва електроенергії. Одним з видів акумуляторів є суха комірка Leclanché, яка містить електроліт в кислої пасті на водній основі. Ця батарея називається лужною батареєю, коли пристосована для роботи в лужних умовах. Кнопкові акумулятори мають високе співвідношення вихідної маси; літій-йодні акумулятори складаються з твердого електроліту; нікель-кадмієвий (NiCad) акумулятор перезаряджається; а свинцево-кислотна батарея, яка також перезаряджається, не вимагає, щоб електроди знаходилися в окремих відсіках. Паливний елемент вимагає зовнішньої подачі реагентів, оскільки продукти реакції безперервно видаляються. У паливному елементі енергія не зберігається, електрична енергія забезпечується хімічною реакцією.