Глава 10: Додаток - Спектроскопія
- Page ID
- 25090

Як ми знаємо, що знаємо про структуру матерії? Якщо згадати наші обговорення атомної структури, одним з найважливіших доказів природи атомів - зокрема розташування їх електронів - було те, як атоми взаємодіють з електромагнітним випромінюванням, тобто світлом. Наприклад: ідея про те, що і енергія електромагнітного випромінювання, і енергія електронів квантуються, виникла з аналізу Ейнштейна фотоелектричного ефекту. Електрони викидаються з металів тільки в тому випадку, якщо вони взаємодіють з фотонами достатньої і дискретної кількості енергії. Більше доказів квантованих енергетичних станів електронів було надано з дослідження спектрів поглинання та емісії атомів, оскільки фотони енергії, що відповідають енергетичним проміжкам між рівнями енергії електронів, або поглинаються, або випромінюються електронами. Фотони з «неправильним» кількістю енергії не поглинаються. Тепер, коли ми вивчили різні збірки атомів (молекули, іони, мережеві структури), ми також можемо подивитися на те, як ці більші сутності взаємодіють з енергією (у вигляді електромагнітного випромінювання).
Взаємодія електромагнітного випромінювання та електронів у молекулах: Як ми бачили, так само, як електрони займають атомні орбіталі в атомах, електрони в молекулах займають молекулярні орбіталі. Як і у випадку з атомними орбіталями, електрони на молекулярних орбіталах можуть поглинати або вивільняти фотони певної енергії, коли вони рухаються від однієї молекулярної орбіталі до іншої. Однак існує значна різниця між процесом поглинання/емісії ізольованих атомів (або іонів) та процесом молекул. Коли електрон підвищується до більш високого рівня енергії в атомі, продукт є атомом у збудженому стані - як правило, збуджений атом (або іон) розпадається назад до основного стану, випромінюючи фотон. \(\mathrm{A} + hν \rightarrow \mathrm{A}^{*} (\text{excited state}) \rightarrow \mathrm{A} (\text{ground state}) + hν\)

Однак, коли електрон всередині молекули збуджується, він рухається (або «просувається») від початкової молекулярної орбіти до іншої. Зараз існує ряд різних наслідків, які можуть виникнути. Наприклад, якщо електрон поглинає фотон і просувається від склеювальної молекулярної орбіти до антизв'язкової орбіти, результатом буде те, що зв'язок розірветься, оскільки зараз немає загальної стабілізуючої взаємодії. Розглянемо\(\mathrm{H–H}\), яка є найпростішою можливою молекулою. Набір молекулярних орбіталей для водню включає в себе зв'язки σ і\(\sigma^{*}\) антизв'язуючу орбіталь. У наземному (або найнижчому енергетичному) стані молекулярний водень має орбітальну зв'язок σ, що містить обидва електрони молекули. Якщо один із зв'язкових електронів поглинає фотон, який має потрібну кількість енергії (різниця енергії між зв'язком та антизв'язковою орбіталлю), він буде просуватися і рухатися в дестабілізовану антизв'язкову орбіту - викликаючи зв'язок між атомами розриву. Як ви могли собі уявити, якби хімічні зв'язки були схильні до розриву лише шляхом впливу електромагнітного випромінювання низької енергії, такого як видиме світло, світ був би іншим (і досить нудним) місцем. Наприклад, життя було б неможливим, так як це залежить від стабільності молекул.
Енергія фотонів, необхідних для розриву зв'язку, досить велика. Наприклад, енергія, необхідна для розриву\(\mathrm{H–H}\) зв'язку (енергія зв'язку) є\(436 \mathrm{~kJ/mol}\). Якщо обчислити довжину хвилі фотона, який може доставити цю кількість енергії, кількість енергії, необхідної для розриву одного\(\mathrm{H–H}\) зв'язку, буде знаходитися в далекій УФ секції електромагнітного спектра (\(\sim 280\mathrm{nm}\)). Типово сильний ковалентний сигма (або одиночний) зв'язок вимагає досить високоенергетичних фотонів, щоб розірвати їх.

Отже, питання полягає в тому, якщо атмосфера Землі блокує більшість (\(>98 \%\)) високоенергетичних (ультрафіолетових) фотонів, а більшість біологічно важливих молекул не можуть поглинати видиме світло, навіщо потрібен сонцезахисний крем, який фільтрує УФ-фотони A (\(400-315 \mathrm{~nm}\)) та UV B (\(315-280 \mathrm{~nm}\)). Відповідь полягає в тому, що більшість біологічних молекул містять більше простих σ зв'язків. Наприклад, більшість складних біологічних молекул також містять π зв'язки та незв'язні електрони на додаток до\(\sigma\) зв'язків; можуть спостерігатися переходи між цими орбіталями, оскільки ці орбіталі потребують меншої енергії для здійснення. Як видно на малюнку, енергетичні проміжки між цими орбіталями досить різні і менше\(\sigma - \sigma^{*}\) різниці. Фотони з достатньою енергією, щоб викликати ці електронні переходи, присутні в сонячному світлі. Наприклад, подвійний зв'язок має як a, так\(\sigma\) і\(\pi\) зв'язок. Поглинання фотона, який сприяв би електрону від орбітальної зв'язки пі до\(\pi^{*}\) антизв'язкової орбіти, матиме ефект розриву вихідного\(\pi\) зв'язку. Один із способів представити це показано тут\(\rightarrow\). Один з електронів, який був у\(\pi\) зв'язку, зараз знаходиться в орбіталі\(\pi^{*}\) антизв'язування високої енергії і є набагато більш реактивним.
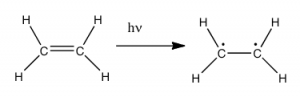
Інший спосіб подумати про це полягає в тому, що електрони зараз непарні, і набагато частіше реагують на формування більш стабільної сутності. [1] Очевидний спосіб відновити стабільність полягає в тому, щоб електрон в\(\pi\) антизв'язній орбіті опустився до рівня енергії зв'язку і випромінював фотон тієї ж енергії, і в більшості випадків це відбувається - врешті-решт не завдаючи шкоди. Одне застереження тут полягає в тому, що оскільки подвійні зв'язки обмежені обертально, можливо, що обертання може відбуватися навколо єдиного (\(\sigma\)) зв'язку перед реформами π зв'язку; це призводить до ізомеру вихідного алкена. З іншого боку, якщо поблизу є потенційно реактивні форми, можуть відбуватися реакції між молекулами (або у випадку біологічних макромолекул, між різними областями цих молекул). Наприклад, більшість з нас знають, що перебування на сонці спричиняє пошкодження шкіри, що може призвести до раку шкіри. Основний механізм цих ефектів включає в себе\(\mathrm{DNA}\). Там, де дві тимідинові основи примикають одна до одної, УФ-фотон може бути поглинутий π зв'язком в одній тимінової основі. Цей розірваний π зв'язок (і в результаті непарний електрон) дуже реактивний. Він може реагувати з π зв'язком у сусідній тимін-Moeity, що призводить до нового зв'язку, реакції, яка виробляє чотиричленне вуглецеве кільце, відоме як тиміновий димер. Машини\(\mathrm{DNA}\) реплікації не можуть точно повторити послідовність, що містить тиміновий димер, що призводить до зміни\(\mathrm{DNA}\) послідовності - мутації. Мутації цього типу є поширеним раннім етапом генерації ракових клітин шкіри. [2]

Більш доброякісний приклад поглинання фотонів у біологічних системах лежить в основі механізму, за допомогою якого ми (та інші організми) виявляємо світло, саме так ми можемо бачити речі! Хоча спочатку вважалося (принаймні деякими), що бачення включало промені, що випромінюються з очей, [3] ми тепер розуміємо, що для того, щоб побачити, нам потрібно виявити фотони, які відбиваються або випромінюються об'єктами навколо нас. Процес починається, коли фотони світла потрапляють на клітини, відомі як фоторецептори. У наших очах ці клітини розташовані всередині сітківки, аркуша клітин, ніж вирівнюють внутрішню поверхню ока. Усередині підмножини клітин сітківки знаходиться ряд різних типів молекул, які містять π зв'язки. Ці молекули - це білки, загально відомі як опсіни. Опсин складається з поліпептиду (або апопротеїну), який ковалентно пов'язаний з іншою молекулою, 11-цис-сітківки. [4] Ця молекула походить від вітаміну А (весь транс-ретинол). Комплекс апопротеїну і сітківки - функціональний білок опсін. Існує ряд різних компонентів опсіна, які впливають на довжину хвилі фотонів, поглинених функціональним білком опсін. Коли фотон поглинається, він просуває електрон від однієї з π зв'язків сітківки (між\(C_{11}\) і\(C_{12}\)) до антизв'язуючої орбіти. Замість того, щоб взаємодіяти з іншою молекулою, як тимін, відбувається обертання навколо залишилася одиничної (\(\sigma\)) зв'язку, а потім повторне утворення\(\pi\) зв'язку, що призводить до ізомеризації вихідної 11-цис-форми в транс-ізомер. Ця зміна форми фрагмента сітківки, в свою чергу, впливає на форму білка опсіна, який ініціює каскад електрохімічних подій, які несуть сигнали до решти мозку (сітківка вважається продовженням мозку), які врешті-решт визнаються візуальним входом.

УФ-спектроскопія та хромофори - або чому морква помаранчева? Однією з поширених рекомендацій лікарів є те, що ми їмо багато яскраво забарвлених фруктів і овочів. З'єднання, які надають цим продуктам їх сильний колір, мають ряд спільних рис. Наприклад, з'єднання, яке надає моркві і солодкій картоплі їх характерний помаранчевий колір, - це бета-каротин. Ви цілком можете помітити його схожість з сітківкою. З'єднання, яке сприяє червоному забарвленню томатів, - лікопін. Молекули цього типу відомі в загальному сенсі як пігменти.
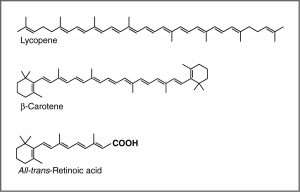
Довжини хвиль, на яких сполука поглинає світло, залежить від енергетичного розриву між орбіталями, які беруть участь у переході. Ця енергетична щілина визначається будовою молекули. Молекула з лише поодинокими зв'язками поглинає світло на більш коротких довжині хвиль (в ультрафіолетовому випромінюванні високої енергії), тоді як більш складні схеми зв'язку пов'язані з поглинанням видимого світла. Наприклад, наявність множинних π зв'язків і їх взаємодії всередині молекули можуть впливати на енергетичний проміжок між молекулярними орбіталями. Нагадаємо, наше обговорення графіту. Замість того, щоб думати про графіт як аркуші злитих шести членних кілець із чергуванням одинарних і подвійних зв'язків, ми можемо думати про кожен зв'язок як локалізовану зв'язок σ та делокалізовану π зв'язок. Існує величезна кількість\(\pi\) молекулярних орбіталей, розкинутих по всьому аркушу атомів вуглецю. Чим більше\(\pi\) MO, тим більше зменшується енергетичний розрив між цими орбітальними, тобто тим менше енергії (довша довжина хвилі світла) потрібно для переміщення електрона від a\(\pi\) до\(\pi^{*}\) орбіти. У випадку мережевих речовин, таких як графіт та метали, енергетичний розрив між орбіталями стає незначним, і ми думаємо про модель зв'язку як про смугу молекулярних орбіталей. У цих випадках багато довжин хвиль світла можуть бути поглинені, а потім повторно випромінюються, що надає графіту та металам їх характерну блиск. У таких речовині, як лікопін або\(\beta\) -каротин, ми також знаходимо цю закономірність чергування одинарних і подвійних зв'язків. Ми говоримо, що сполуки з таким малюнком чергуються одинарних і подвійних зв'язків (наприклад\(\mathrm{–C=C–C=C–}\)) сполучені, і ми можемо моделювати зв'язок так само, як графіт. Є\(\pi\) МО, які можуть поширюватися на область молекули, і чим більше орбіталів є, тим ближче один до одного за енергією вони отримують.
Для ізольованого\(\mathrm{C=C}\) подвійного зв'язку енергія, необхідна для просування електрона з\(\pi\)\(\pi^{*}\) орбіти, відповідає світлу в УФ-області (навколо\(170 \mathrm{~nm}\)), але в міру збільшення кількості подвійних зв'язків, які кон'юговані (розділені одинарними зв'язками), енергетичний зазор між зменшується найвища зайнята молекулярна орбіта (HOMO) та найнижча незайнята молекулярна орбіта (LUMO). Зрештою, довжина хвилі світла, необхідна для просування електрона від HOMO до LUMO, рухається у видиму область, і речовина стає кольоровою. (Зверніть увагу, що він стає не кольором світла, яке поглинається, а навпаки, решта світла, яке передається або відбивається). Ці кон'юговані ділянки молекул називаються хромофорами. [5] Чим довше кон'югований ділянку молекули, тим довша довжина хвилі, яка поглинається. Ви помітите, що і лікопін, і В-каротин містять великі області хромофорів.

Тут показані зразки спектрів поглинання UV-VIS. Зауважимо, що на відміну від спектрів атомного поглинання, які ми бачили раніше, які складалися з гострих ліній, що відповідають довжині хвилі світла, поглиненого атомами, ці спектри широкі і погано визначені. Крім того, ви можете бачити, що чим довше (більше) хромофор, тим довша довжина хвилі, яка поглинається, і кожне з цих сполук здається різним кольором.
Той факт, що піки в цих спектрах не є гострими, означає, що UV-VIS спектроскопія зазвичай не використовується для ідентифікації сполук (див. Нижче для ІЧ- та ЯМР-спектроскопії, які можуть бути використані для цієї мети). Однак кількість світла, що поглинається, пропорційна концентрації речовини, і тому UV-VIS спектроскопія може бути використана для визначення концентрації зразків. Існують інші оптичні поведінки, пов'язані зі складними молекулами в організмах, включаючи молекулярні системи, що випромінюють світло, процес, відомий як біолюмінесценція, який ми тут обговорювати не будемо. [6]
Інфрачервона спектроскопія - дивлячись на молекулярні коливання: До сих пір ми зосереджувалися на поглинанні (і емісії) енергії, викликаної переходами електронів між квантованими рівнями енергії. Однак, як ми обговорювали раніше, електронні енергії не є єдиними квантованими енергіями на атомно-молекулярному рівні. У молекулах енергії як молекулярних коливань, так і обертань також квантуються, але задіяні енергії набагато нижчі, ніж ті, які необхідні для розриву зв'язків. Коли два атоми пов'язані, атоми можуть рухатися взад-вперед відносно один одного: у міру їх руху потенційна енергія двох атомних систем змінюється (чому це так?). Існують також рухи, пов'язані з обертаннями навколо облігацій. Але (дивно, і квантово механічно) замість того, щоб мати можливість приймати будь-яке значення, енергії цих вібрацій (і обертань) також квантуються. Енергетичні проміжки між вібраційними рівнями енергії, як правило, знаходяться в діапазоні інфрачервоного випромінювання. Коли ми дивимося на світло, поглинене або випромінюване коливальними змінами енергії, ми робимо те, що відомо як інфрачервона спектроскопія. Переходам від одного обертального рівня енергії до пильовика може сприяти мікрохвильове випромінювання, що призводить до мікрохвильової спектроскопії. У таблиці нижче наведено приклади різних типів спектроскопії, довжини хвилі електромагнітного випромінювання, як правило, задіяного, та використання кожного виду спектроскопії.
| Тип спектроскопії | Довжина хвилі випромінювання | Взаємодія з матерією | Призначення |
|---|---|---|---|
| УФ-ВІС | \(350-700 \mathrm{~nm}\) | Електронні переходи в молекулах | Часто використовується для визначення концентрацій |
| ІР | \(2,500-16,000 \mathrm{~nm}\) | Молекулярні коливання | Визначити наявність окремих груп атомів (функціональних груп) |
| ЯМР | \(10-100 \mathrm{~m}\) | Ядерні переходи | Визначте типи С і Н в молекулах |
| МРТ | \(10-100 \mathrm{~m}\) | Ядерні переходи | Візуалізація (як правило, частини тіла людини) |

Чому, ви можете запитати, нас цікавлять вібрації та обертання молекул? Виявляється, багато молекул і фрагментів молекул мають дуже характерні схеми поглинання ІЧ, які можна використовувати для їх ідентифікації. На малюнку показано ІЧ-спектр карбонової кислоти і те, як різні піки можуть бути приписані коливанням різних зв'язків або груп всередині молекули. Інфрачервона спектроскопія дозволяє нам ідентифікувати речовини з цих закономірностей, як в лабораторії, так і, наприклад, в міжзоряних пилових хмарах. Наявність досить складних молекул у космосі (сотні мільйонів світлових років від землі) було виявлено за допомогою ІЧ-спектроскопії.

Ядерно-магнітно-резонансна спектроскопія (ЯМР): ЯМР - це форма спектроскопії, яка використовує той факт, що певні ядра можуть, залежно від їх структури, вести себе як крихітні обертаються магніти. Два найпоширеніших ядра, що використовуються для спектроскопії ЯМР, - це\({}^{1}\mathrm{H}\) і\({}^{13}\mathrm{C}\). Коли матеріали, що містять атоми вуглецю або водню в них, поміщаються в магнітне поле, існують дві можливі орієнтації цих ядер щодо поля: орієнтація з низькою енергією, при якій ядерний магніт вирівняний з полем, і висока енергетична орієнтація, в якій ядерний магніт вирівняний по відношенню до поля. Ефект від цього полягає в розщепленні енергетичних рівнів ядер. Це дозволяє викликати перехід між двома енергетичними рівнями шляхом поглинання електромагнітного випромінювання відповідної енергії, яка в даному випадку знаходиться в діапазоні радіохвиль.
Точна енергія цих змін залежить від середовища ядер, якщо\(\mathrm{C}\) або\(\mathrm{H}\) знаходиться в електронно-дефіцитному середовищі, воно з'явиться з іншою частотою в спектрі, ніж а\(\mathrm{C}\) або\(\mathrm{H}\) яка оточена більшою щільністю електронів (ядро, як кажуть, є екранований електронами.) З вивчення різних енергій, поглинених у міру переходу ядра з одного спінового стану в інший, можна отримати інформацію про структуру сполуки.
Інформація, яка може бути отримана від простих спектрів ЯМР, пов'язана з кількістю та типом ядер, які знаходяться в певній сполуці. Найпростіший тип спектра ЯМР заснований на\({}^{13}\mathrm{C}\). \({}^{13}\mathrm{C}\)є незначним ізотопом вуглецю (близько 1% природного достатку) і присутній у всіх природних зразках вуглецевих сполук. У\({}^{13}\mathrm{C}\) спектрі кожен атом вуглецю в молекулі призведе до сигналу або піку в спектрі на основі його хімічного середовища. Наприклад, етанол (\(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{OH}\)) має два піки в своєму\({}^{13}\mathrm{C}\) спектрі, оскільки існує два, і лише два різних хімічних середовища, які може «населяти» атом вуглецю. На відміну від цього, циклогексенон виробляє спектр, який має шість різних піків, оскільки кожен з шести атомів вуглецю в молекулі населяє чітко різне середовище. Бензол (\(\mathrm{C}_{6}\mathrm{H}_{6}\)) з іншого боку має лише один сигнал у своєму спектрі\({}^{13}\mathrm{C}\) ЯМР, оскільки в цій молекулі є лише один тип вуглецю, всі позиції в кільці еквівалентні. (Намалюйте структуру Льюїса, щоб переконати себе, що це правда)



Протонні або\({}^{1}\mathrm{H}\) ЯМР спектри здаються більш складними, оскільки кожен атом водню має тенденцію подавати сигнал, який розщеплюється на кілька різних піків. Це пояснюється тим, що кожне\(\mathrm{H}\) ядро може бути уражено сусідніми ядрами. Це створює кілька рівнів енергії для кожного\(\mathrm{H}\), що призводить до більш складних спектрів. \({}^{13}\mathrm{C}\)здається простішим, оскільки в будь-якій молекулі зазвичай є лише одне (або нульове)\({}^{13}\mathrm{C}\) ядро, тому немає взаємодій сусідніх вуглеців (\({}^{12}\mathrm{C}\)не має різних рівнів ядерної енергії в магнітному полі). Зверніть увагу, що цей спектр\({}^{1}\mathrm{H}\) ЯМР набагато складніший, ніж\({}^{13}\mathrm{C}\) ЯМР. Однак існує п'ять різних кластерів сигналів, і в сполуці є п'ять видів протонів, що породжує цей спектр.
Варіант ЯМР - магнітно-резонансна томографія (МРТ), яка базується на тій же основній ядерній поведінці, але використовує дещо інший підхід. У МРТ матеріал (як правило, людина), з якого ви хочете записати спектр, поміщений у великий магніт, який відокремлює ядерні спінові стани, як описано вище. Мішень опромінюється імпульсом радіохвиль, який просуває всі ядра до їх найвищого доступного енергетичного стану. Коли ядра розпадаються назад до стану нижнього спина, вони випромінюють фотони. Замість того, щоб виявляти енергії цих фотонів, система записує час, необхідний для випромінювання фотонів, коли ядра падають назад до найнижчих енергетичних станів. Ці часи залежать від середовища ядер, що дозволяє за допомогою маніпулювання даними розвивати внутрішні візуалізації тіла в сканері.
Це лише кілька типів прикладів спектроскопії. Є багато інших, з якими ви можете зіткнутися, але, як правило, всі ці методи залежать від запису взаємодії речовини та енергії та використання цих даних для визначення розташування атомів у досліджуваному речовині.
Мініатюра: Біле світло розсіюється призмою на кольори видимого спектру. (CC BY-SA 3.0; Д-Куру).
