6.5: Полярність
- Page ID
- 25238
Поки ми розглядали рішення, що складаються з молекул, які є полярними або неполярними або іонними видами, які мають властивості, які відносно легко передбачити. Однак багато речовин мають більш складні структури, які включають полярні, іонні та неполярні групи. Наприклад, багато біомолекул не можна класифікувати як виключно полярні або неполярні, але вони досить великі, щоб мати різні області різної полярності. Їх називають амфіпатичними. Незважаючи на те, що структури білків\(\mathrm{RNA}\)\(\mathrm{DNA}\), таких як та інші біомолекули, є складними, ми можемо використовувати ті самі принципи, що включають ентропні та ентальпічні ефекти взаємодії з водою, щоб зрозуміти взаємодію між біомолекулами, а також всередині даної біомолекули. Біомолекули дуже великі в порівнянні з молекулами, розглянутими в більшості курсів хімії, і часто одна частина молекули взаємодіє з іншою частиною тієї ж молекули. Внутрішньомолекулярні [6] взаємодії біологічних макромолекул разом з їх взаємодією з водою є ключовими факторами прогнозування їх форми. [7]
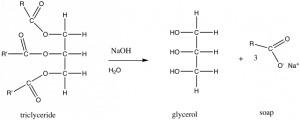

Почнемо з відносно простої біомолекулярної структури. У попередньому розділі ми розглянули розчинність масел у воді. Масла або жири також відомі як тригліцериди. На малюнку\(\mathrm{R}_{\prime}\) вказують\(\mathrm{R}\) і вуглеводневі ланцюги, які мають родову будову\(\mathrm{CH}_{3}\mathrm{CnH}_{2\mathrm{n}}\), показану на малюнку. Якщо обробити масло або жир гідроксидом натрію (\(\mathrm{NaOH}\)), то отримана хімічна реакція призводить до утворення того, що відомо як жирна кислота (в даному прикладі атоми кисню - бордові). Типова жирна кислота має довгу неполярну вуглеводневий ланцюг і один кінець, який часто містить як полярну, так і іонну групу. Полярна головка молекули взаємодіє з водою з невеликим або зовсім відсутнім збільшенням ентропії, на відміну від вуглеводню, де відсутність\(\mathrm{H}\) -зв'язуючих взаємодій з водою змушує більш впорядковану оболонку молекул води навколо молекули вуглеводню, що призводить до зниження ентропії. З іншого боку, у воді неполярна область молекули створює зменшення ентропії, оскільки молекули води організовуються у тип клітки навколо неї - несприятливий результат з точки зору\(\Delta \mathrm{S}\), а отже,\(\Delta \mathrm{G}\) також. Отже, який кінець молекули «виграє»? Тобто розчиняються такі молекули у воді чи ні? Відповідь: Обидва! Ці амфіпатичні молекули влаштовуються таким чином, що їх полярні групи контактують з водою, тоді як їх неполярні області - ні. (Подивіться, чи зможете ви намалювати таку композицію, не забуваючи включити молекули води в свій малюнок.)

Насправді існує кілька способів виготовлення такого розташування, в залежності частково від кількості води в системі. Стандартна міцелла - це сферична структура з полярними головками зовні і неполярними хвостами зсередини. Це найпростіша структура, яка може вмістити як гідрофільні, так і гідрофобні групи в одній молекулі. Якщо вода гранична, то можна отримати перевернуте розташування міцел, при якому всередині знаходяться полярні головні групи (і вода), а неполярні хвости спрямовані назовні (як показано на малюнку). Інші високоорганізовані структури можуть формуватися спонтанно в залежності від будови головної групи і хвоста. Наприклад, молекули ліпідів мають кілька вуглеводневих хвостів і вуглецеві кільцеві структури, які називаються стеринами. Ця структура створює ліпідний бішар - полярну мембрану, що складається з двох шарів ліпідних молекул, які утворюють клітинні та органеллярні межі у всіх організмах. Слід зазначити, що ці впорядковані структури можливі лише тому, що диспергування молекул ліпідів у воді призводить до істотного зменшення розладу системи. Насправді багато впорядкованих структур, пов'язаних з живими системами, такі як структура\(\mathrm{DNA}\) та білки, є результатом процесів, керованих ентропією, ще однією контрінтуїтивною ідеєю. Це одна з багатьох причин, чому біологічні системи не порушують закони термодинаміки і чому науково правдоподібно, що життя виникло виключно завдяки природним процесам! [8]
Питання
Питання, на які потрібно відповісти
- Якщо у вас була сполука, яка, як ви підозрювали, може утворитися міцели:
- Які структурні особливості ви б шукали?
- Як ви можете розробити експеримент, щоб визначити, чи буде сполука утворювати міцели у воді?
- Якими були б експериментальні докази?
- Чому, на вашу думку, деякі амфіпатичні молекули утворюють сферичні скупчення (міцели або ліпосоми), тоді як інші утворюють аркуші (бішари)? (Підказка: розглянемо форму самої окремої молекули.)
- Амфіпатичні молекули часто називають поверхнево-активними речовинами. Наприклад, сполуки, що використовуються для диспергування розливів нафти, є поверхнево-активними речовинами. Як ви думаєте, як вони працюють?
Питання для роздумів
- Якщо утворення мембран та згортання білка є процесами, керованими ентропією, чи робить це витоки життя більш-менш «природними» для вас?
Розчини, колоїди та емульсії
Отже, чи розчиняються міцели у воді? Ну, міцели - це не молекули, а супрамолекулярні збірки, що складаються з багатьох різних молекул. Розчин глюкози складається з ізольованих молекул глюкози, але міцели в розчині складаються з більших молекулярних агрегатів. Розчини високомолекулярних розчинів називаються колоїдами. Ці частинки можуть бути агрегатами молекул (наприклад, міцел), атомів (наночастинок) або більших макромолекул (білки, нуклеїнові кислоти), серед інших. Коли ці частинки знаходяться на порядку довжини хвилі видимого світла, вони розсіюють світло; більш дрібні предмети - ні. Ось чому розчин солі або цукру напівпрозорий, тоді як колоїдна дисперсія міцел або клітин каламутна. [9] Цей принцип також пояснює, чому мильні розчини, як правило, хмарні - вони містять частинки, достатньо великі, щоб розсіювати світло. Коли частинки в розчині підтримують структуру твердої речовини, кінцевий результат відомий як колоїд. Колоїд стабільний, оскільки теплові рухи цих дрібних твердих частинок підвішені. Коли частинки стають більшими, колоїд стає нестійким; вплив сили тяжіння долає вплив теплового руху і частинки осідають. Перш ніж вони осядуть, такі нестабільні системи відомі як підвіска.
Але якщо зважені частинки рідкі, система відома як емульсія. Наприклад, якби ми подивилися на салатну заправку з олії та води під мікроскопом, ми побачили б краплі олії, підвішені у воді. Емульсії часто нестабільні, і з часом дві рідкі фази розділяються. Ось чому ви повинні збовтати заправку для салату безпосередньо перед її використанням. У навколишньому світі багато колоїдів і емульсій. Молоко, наприклад, являє собою емульсію жирових глобул і колоїду білкових (казеїнових) міцел.
