6.2: Розчинність: чому одні речі утворюють рішення, а інші ні?
- Page ID
- 25216
Скажімо, у вас є\(100-\mathrm{mL}\) градуйований циліндр, і ви\(50 \mathrm{~mL}\) берете етанол і додаєте його до\(50 \mathrm{~mL}\) води. Ви можете здивуватися, виявивши, що обсяг отриманого розчину менше\(100 \mathrm{~mL}\). Насправді мова йде про те\(98 \mathrm{~mL}\), припускаючи хорошу техніку (відсутність розливу). Як ми можемо це пояснити? Ну, ми можемо спочатку заспокоїти себе, що матерія не була зруйнована. Якщо зважити розчин, він важить так само, як\(50 \mathrm{~mL}\) і вода плюс\(50 \mathrm{~mL}\) етанол. Це означає, що щільність розчину вода-етанолу повинна бути більшою, ніж щільність води або етанолу окремо. На молекулярному рівні ми можемо негайно зробити висновок, що молекули ближче один до одного в суміші етанолу та води, ніж були чистими (перед змішуванням) - спробуйте намалювати картину молекулярного рівня, щоб переконати себе, що це можливо. Тепер, якби ви взяли\(50 \mathrm{~mL}\)\(50 \mathrm{~mL}\) нафту і воду, ви б виявили, що вони не змішуються - як би ви не намагалися. Вони завжди будуть відокремлюватися один від одного на два шари. Які фактори визначають, утворюють речовини розчини чи ні?
По-перше, ми повинні знати, що розчинність не є властивістю «все або нічого». Навіть у випадку з нафтою та водою у воді (водна фаза) присутня дуже мала кількість молекул нафти, а в олії присутня невелика кількість молекул води. Існує ряд способів опису розчинності. Найпоширенішим способом є визначення кількості молів розчиненої речовини на літр розчину. Це називається молярністю рішення (\(\mathrm{M}, \mathrm{~mol/L}\)). Іншим поширеним способом є визначення кількості грамів розчиненої речовини на масу розчину. Наприклад:\(1 \mathrm{~mg}\) (\(10^{-3} \mathrm{~g}\)) розчиненої речовини, розчиненої в\(1 \mathrm{~kg}\) (\(10^{3} \mathrm{~g}\)) розчину становить 1 частина на мільйон (\(10^{6}\)) розчиненої речовини, або\(1 \mathrm{~ppm}\). Як і слід було очікувати, враховуючи температурний термін у рівнянні вільної енергії, дані про розчинність завжди повідомляються при певній температурі. Якщо більше розчиненої речовини не може розчинятися при заданій температурі, розчин, як кажуть, насичений; якщо більше розчиненої речовини може розчинитися, він ненасичений.
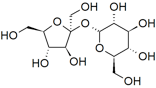
Якщо ми подивимося на структуру сполук, які розчиняються у воді, ми можемо почати бачити деякі тенденції: вуглеводні не дуже розчинні у воді (пам'ятайте з глави,\(4\) що це сполуки, що складаються тільки з вуглецю та водню), тоді як спирти (вуглеводні з приєднаною\(—\mathrm{O–H}\) групою) з вгору до 3 вуглець повністю розчинні. Зі збільшенням кількості атомів вуглецю розчинність з'єднання у воді зменшується. Наприклад, гексанол (\(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{OH}\)), тільки дуже слабо розчинний у воді (\(0.4 \mathrm{~g/L}\)). Тож, можливо, гідроксильна (\(—\mathrm{O–H}\)) група відповідає за розчинність молекули у воді. Докази, що підтверджують цю гіпотезу, можна знайти в тому, що діоли (сполуки з\(2—\mathrm{O–H}\) групами) більш розчинні, ніж аналогічні спирти. Наприклад, у порівнянні з гексанолом 1,6-гександіол (\(\mathrm{HO}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{OH}\)) досить розчинний у воді. Більш звичними водорозчинними сполуками, такими як цукру, глюкоза, фруктоза і сахароза (димер глюкози і фруктози — показаний на малюнку) є, по суті, поліспирти. Кожен з шести вуглеців приєднаний до гідроксильної групи.
| З'єднання | Молярна маса (\ mathrm {г/моль}\)) | Структура | Розчинність (\(\mathrm{g/L}\))\(20 { }^{\circ}\mathrm{C}\) |
| пропан | \(44\) | \(\(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{CH}_{3}\) | \(0.07 \mathrm{~g/L}\) |
| Етанол | \(46\) | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{OH}\) | Повністю змішується |
| Диметиловий ефір | \(46\) | \(\(\mathrm{CH}_{3}\mathrm{OCH}_{3}\) | \(328 \mathrm{~g/L}\) |
| Пентан | \(72\) | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{3}\) | \(0.4 \mathrm{~g/L}\) |
| Бутанол | \(74\) | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{OH}\) | \(80 \mathrm{~g/L}\) |
| Діетиловий ефір | \(74\) | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{OCH}_{2}\mathrm{CH}_{3}\) | \(69 \mathrm{~g/L}\) |
| Гексанол | \(102\) | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{OH}\) | \(0.4 \mathrm{~g/L}\) |
| 1,6 Гександіол | \(226\) | \(\mathrm{HO}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{OH}\) | \(500 \mathrm{~g/L}\) |
| Глюкоза | \(180\) | \(\mathrm{C}_{6}\mathrm{H}_{12}\mathrm{O}_{6}\) | \(910 \mathrm{~g/L}\) |
Питання
Питання, на які потрібно відповісти
- Складіть список речовин, які ви знаєте, розчиняються у воді.
- Які з них розчиняються: метали, іонні сполуки, молекулярні сполуки (полярні, неполярні), мережеві тверді речовини (алмазний графіт)?
- Чи можете ви зробити будь-які узагальнення про те, які речі розчиняються, а які ні?
- Що повинно статися для того, щоб щось розчинилося у воді?
- Як би ви розробили експеримент для визначення розчинності розчинної речовини?
- Як би ви визначали, чи був розчин насиченим?
- Намалюйте картину молекулярного рівня розчину етанолу та води, показуючи, чому розчин більш щільний, ніж окремі рідини.
- Намалюйте молекулярний рівень зображення суміші нафти і води.
- Намалюйте молекулярний рівень зображення процесу розв'язання
- Коли ви намагаєтеся змішати масло і воду, який шар закінчується зверху? Чому?
Питання для роздумів
- У вас є насичений розчин, з деякою твердою розчиненою речовиною.
- Як ви думаєте, розчинені частинки, які знаходяться в розчині, однакові з часом?
- Як би ви визначали, чи були вони однаковими?
Питання для Пізніше
- Що б ви передбачили для знака\(\Delta \mathrm{S}\) при формуванні будь-якого рішення? Чому?
- Що б ви передбачили для знака\(\Delta \mathrm{H}\) при формуванні будь-якого рішення? Чому?
- Що б ви передбачили для знака\(\Delta \mathrm{G}\) при формуванні будь-якого рішення? Чому?
