1.6: Ділимий атом
- Page ID
- 25404
Протилежність правильному твердженню - помилкове твердження. Але протилежність глибокої істини цілком може бути ще однією глибокою істиною. Нільс Бор (1865—1962)
Теорія Дальтона про атоми як неподільні, незнищувані, об'єкти різних розмірів, ваги і, можливо, форми, залежно від елемента, трималася майже 100 років, хоча існувало значне інакомислення щодо того, чи дійсно атоми існують, особливо серед філософів. До 1900 року атомна теорія була майже загальновизнана хіміками. Стало накопичуватися більше доказів, було виявлено більше елементів, і навіть стало можливим обчислити кількість атомів в конкретному зразку. Перший крок, уздовж цього напрямку, зробив Амедео Авогадро (1776—1856). У 1811 році він запропонував, щоб в умовах рівної температури і тиску рівні обсяги газів містили рівну кількість частинок (молекул) і щоб щільності газів, тобто їх вага, поділена на їх об'єм, були пропорційні вазі окремих молекул. Це було розширено вчитель австрійської середньої школи Йозеф Лошмідт (1821—1895), який у 1865 році поєднав висновок Авогадро з припущенням, що атоми і молекули рухаються дуже сильно, як пружні об'єкти, вважають більярдні кулі. Це дозволило йому обчислити силу, яку молекула чинить під час подорожі з певною швидкістю, щось важко виміряти, і пов'язати це з тиском, щось легко виміряне. Насправді це припущення дозволило фізикам зробити висновок, що температура газу пов'язана із середньою кінетичною енергією молекул всередині нього, поняття, до якого ми незабаром повернемося.
Зондування субструктури атомів
Початкове грецьке припущення полягало в тому, що атоми були неподільними, по суті незмінними від їх початкового створення. Однак поступово почали накопичуватися докази того, що атоми не були ні неподільними, ні непорушними. Докази існування частинок, менших за атоми, нарощувалися протягом деякого часу, хоча це не було визнано таким. Наприклад, добре визнане явище статичної електрики було відомо ще з давніх греків. Назва електрика походить від латинського electricus, що означає бурштиновий. Натирання бурштину хутром генерує статичну електрику - той самий тип іскри, яка перескакує від пальця до дверної ручки або іншої людини в сухих умовах. Наприкінці 1700-х Луїджі Гальвані (1737—1798) виявив, що тварини можуть виробляти та реагувати на електрику, мабуть, найбільш драматичним прикладом є електричні вугри та промені, які приголомшують свою здобич електричним струмом. Відкриття біоелектрики було використано в багатьох романах і фільмах, починаючи з роману Мері Шеллі (1797—1851) Франкенштейн і продовжуючи через комедійний фільм Мела Брука (нар. 1926), Молодий Франкенштейн. Гальвані виявив, що нога мертвої жаби смикається у відповідь на вплив статичної електрики; здавалося, вона повернулася до життя, як і монстр Франкенштейна. Він припустив, правильно виявляється, що електрична активність задіяна в нормальному русі тварин. Він вважав, що специфічна форма електрики, біоелектрика, переноситься в рідині всередині м'язів і є унікальним продуктом біологічних систем, типом життєвої сили. Зараз ми визнаємо, що ряд біологічних явищ, таких як скорочення м'язів та активність мозку, ініціюються змінами електричних полів (через мембрани) і що основні фізико-хімічні принципи подібні до тих, що відбуваються в небіологічних системах.
Ажіотаж щодо електрики та її можливого використання спонукав Алессандро Вольту (1745—1827) розробити першу сучасну батарею, нині відому як вольтаїчна купа. Він чергував листи двох різних металів, таких як цинк і мідь, з дисками, змоченими в солоній воді (розсолі). Він виробляв перший стійкий електричний струм, який при застосуванні до м'язів жаби змусив їх скорочуватися. Такі спостереження вказували на те, що біологічні системи можуть як генерувати, так і реагувати на електричні струми, припускаючи, що біоелектрика нічим не відрізняється від будь-якої іншої форми електрики. Те, що ні Вольта, ні Гальвані не знали, - це природа електрики. Що це було, саме, і як воно текло з місця на місце? Що було в іскрі, яка стрибнула з пальця на металеву дверну ручку, або від струни змія Бенджаміна Франкліна (1705—1790) до його пальця? З чого була зроблена ця «електрична рідина»?
Прогрес у розумінні природи та поведінки електрики продовжувався протягом 19 століття, і сила електроенергії була використана для кардинальних змін у способі життя людей, електроживлення фабрик, освітлення будинків та вулиць тощо. Але не було глибокого розуміння фізичної природи електрики. Було відомо, що електричний заряд надходив у двох формах, позитивну та негативну, і що ці заряди були збережені; тобто їх неможливо створити або знищити, ідеї, вперше запропоновані Франкліном. Електрична (заряджена) природа матерії була добре встановлена, але не звідки взялися ці заряди або якими вони були.
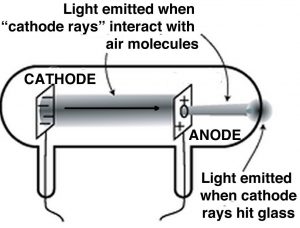
Ключовий крок до розуміння електрики полягав у розгаданні ідеї неподільного атома та включав серію експериментів Джей Джей Томпсона (1856—1940), іншого манкунійського. [14] Хоча ідея електрики зараз була добре оцінена, Томпсон та інші вчені хотіли вивчити її більш контрольованим способом. Вони використовували те, що були і зараз відомі як електронно-променеві трубки (CRT). Колись поширені в телевізорах, вони тепер були замінені різними пристроями з плоским екраном. ЕПТ - це скляні трубки з вбудованими в них дротами; ці дроти з'єднані з металевими дисками. Внутрішня частина трубки покрита хімічною речовиною, яка світиться (флуоресценція) у відповідь на електрику. Вони, як правило, мають отвори в стінках, які можуть бути підключені до вакуумного насоса, так що більшу частину повітря всередині трубки можна видалити, як правило, порти потім герметичні. При підключенні до джерела електрики, такого як вольтаїчна паля, люмінесцентний матеріал на одному кінці трубки світиться. У серії експериментів (1897 р.) Томсон зміг показати, що:
- Промені виходили з одного диска (катода) і переміщалися на інший (анод).
- «Катодні» промені відхилялися електричними полями в напрямку, яке вказувало на те, що вони були негативно заряджені.
- Промені також могли відхилятися магнітними полями. [15]
- Промені несли електричний заряд; тобто якщо промінь був зігнутий, наприклад магнітним полем, заряд йшов разом з ним.
- Метал, з якого виготовлявся катод, не впливав на поведінку променя; тому незалежно від складу променя, він виявився незалежним від елемента, з якого він прийшов.
У всіх цих експериментах потрібно підкреслити, що «позитивні» і «негативні» означають протилежне і призначаються за умовністю. Це означає, що завтра ми можемо вирішити, що позитив був негативним, а негативним позитивним, і нічого не зміниться, доки ми будемо послідовними. З цих експериментів Томпсон зробив висновок, що «катодні» промені несли дискретні заряджені частинки, він назвав їх корпускулами, і він призначив цим частинкам негативний заряд. Але воістину приголомшливий висновок, до якого він дійшов, полягав у тому, що ці частинки повинні надходити зсередини атомів металевого катода. Оскільки тип металу не впливав на природу або поведінку катодних променів, він припустив, що ці частинки не були новоствореними, але повинні існувати в атомах катода. Більш того, він висунув гіпотезу, що однакові частинки повинні бути присутніми у всіх атомах, а не тільки в атомах одного конкретного металу. Ви бачите, як він перескакує від експериментальних результатів, використовуючи кілька металів до всіх елементів і всіх атомів? Звичайно, зараз ми знаємо ці частинки як електрони, але важко уявити, який величезний вплив ця нова теорія мала на вчених того часу.
Оскільки електрони можуть вироблятися всіма хімічними елементами, треба зробити висновок, що вони входять в конституцію всіх атомів. Таким чином, ми зробили свій перший крок у розумінні структури атома. Дж. Томсон, Атомна теорія, 1914 [16]
Відкриття електрона зробило стару ідею атома як трохи незламних більярдних кульоподібних об'єктів застарілою і вимагала нової моделі. Це приклад зміни парадигми [17] —фундаментальної зміни наукового мислення, керованого новими доказами. Перша версія Томпсона цієї нової моделі стала відома як модель сливового пудингу. [18] Його основна ідея полягала в тому, що атом - це кулька позитивно зарядженої, але, мабуть, аморфної, речовини з електронами, шипованими тут і там, як родзинки в пудингу. Оскільки він містив рівну кількість позитивних і негативних зарядів, загальна структура була електрично нейтральною. Наступна робота Томпсона і Роберта Міллікана (1868—1953) встановила, що всі електрони ідентичні, кожен з однаковою, дуже малою масою і негативним зарядом. Маса електрона менше\(\frac{1}{1000\mathrm{th}}\) маси атома водню.
Запропонована Томпсоном модель атома сливового пудингу підстьобула багато експериментальної та теоретичної роботи і призвела до значної кількості наступних відкриттів. Наприклад, незабаром було визнано, що\(\beta\) частинки, що виділяються деякими радіоактивними мінералами і елементами, є, по суті, електронами. Інші дослідження виявили, що кількість електронів, присутніх в атомах конкретного елемента, приблизно пропорційна половині атомної ваги елемента, хоча чому це повинно бути так, було незрозуміло.
Однак, оскільки все більше даних почали накопичуватися, від моделі сливового пудингу довелося відмовитися, оскільки вона просто не могла пояснити, що спостерігається. Ключовий експеримент, який призвів до створення нової моделі атома, був проведений в 1908 році Ернестом Резерфордом (1871—1937). Як ви вже здогадалися, він працював в Манчестерському університеті. У цьому експерименті він дослідив, як альфа (\(\alpha\)) частинки, які, як він знав, були позитивно зарядженими частинками, виготовленими з елемента гелію без його електронів, поводилися, коли їх обстрілювали дуже тонкий лист металу, такий як золото або платина. В експерименті вузький паралельний промінь α частинок був спрямований на тонкий аркуш золотої фольги і були виявлені кути, під якими відхилені частинки розсіяні. Спостережуваний результат виявився абсолютно несподіваним. Замість того, щоб пройти прямо через тонкий лист фольги, він виявив, що кілька частинок відхилені, деякі з них під великими кутами. Резерфорд писав: «Це так, ніби я випустив гарматну кулю в шматок цигаркового паперу, і він відскочив назад». Тут ми знову бачимо особливий аспект наукового підприємства, а саме те, що хоча лише кілька альфа-частинок відскочили назад, нам все одно потрібно пояснити, як це може статися. Ми не могли просто сказати: «Лише кілька частинок були відскочені, тому це не має значення»; ми повинні надати правдоподібний сценарій, щоб пояснити спостереження. Часто саме звертають увагу і ставляться серйозно до несподіваного результату, який призводить до найглибших відкриттів.
На підставі цих експериментальних результатів Резерфорд міркував, що позитивно заряджені α частинки відштовхуються позитивними частинами атома. Оскільки лише дуже малий відсоток альфа-частинок відхилявся, лише дуже мала область кожного атома могла бути позитивно заряджена. Тобто позитивний заряд в атомі не міг бути розподілений більш-менш рівномірно, як передбачала модель сливового пудингу; натомість він повинен бути зосереджений у дуже маленькій області. Це означало, що більша частина атома порожня (пам'ятаєте порожнечу стародавніх греків?) або зайнятий чимось, що мало або зовсім не опір проходженню α частинок. Те, що залишилося незрозумілим, так це чому позитивно заряджені частинки (які ми зараз знаємо як протони), сконцентровані в такому малому обсязі, не відштовхували один одного — відповіді на які довелося чекати відкриття сильної ядерної сили (див. Нижче). Знову ми бачимо, як вчений робить величезний інтуїтивний стрибок від експериментального спостереження до гіпотези, яка відповідала цим доказам і яка робить конкретні прогнози, які можуть бути підтверджені або фальсифіковані подальшим експериментом та спостереженням. Модель Резерфорда, яка стала відомою як планетарна модель, постулювала дуже, дуже маленьке ядро, де знаходився весь позитивний заряд і майже вся маса атома; це ядро було оточене електронами. У 1920 році Резерфорд продовжував ідентифікувати одиницю позитивного заряду і назвав її протоном. У 1932 році Джеймс Чедвік (1891—1974) (який випадково навчався в Манчестерському університеті) визначив другий компонент ядра - нейтрон. Нейтрони важкі, як протони. Насправді вони трохи важче протонів, але не мають заряду. Ідентичність елемента залежить від кількості протонів, проте кількість нейтронів може бути різним у різних атомів одного і того ж елемента. Наприклад, атом вуглецю завжди має шість протонів, але він може мати різну кількість нейтронів. Більшість атомів вуглецю мають шість нейтронів (\(\mathrm{C-} 12\)), але деякі мають сім (\(\mathrm{C-} 13\)), а деякі мають вісім (\(\mathrm{C-} 14\)).
Питання для Пізніше
- Якщо атоми - це переважно порожній простір, чому ми не можемо пройти крізь стіни?
- Що таке випромінювання?
- Як змінюється атом, коли він випромінює альфа-частинку? Або бета-частинка/електрон?
Питання для роздумів
- Якби першовідкривачі електрики вирішили, що електрони мають позитивний заряд, чи це змінило б наше розуміння електрики?
- Чому, на вашу думку, електрони були першими субатомними частинками, які були виявлені?
- Як саме Резерфорд виявив альфа-частинки?
- Чи можете ви придумати альтернативну модель атома, засновану на спостереженнях Резерфорда?
- Як би змінився експеримент, якби він використовував електрони або нейтрони?
