13.13: Активізація хімічних реакцій та інтенсифікація процесів
- Page ID
- 18984
Одним з найважливіших аспектів зеленої хімії є підвищення швидкості і ступеня завершення хімічних реакцій. Одним із способів цього є зниження енергії активації, необхідної для продовження реакції. Це те, що роблять каталізатори, як обговорювалося в попередньому розділі. Інший спосіб посилення реакції - додавання енергії, як обговорюється в цьому розділі.
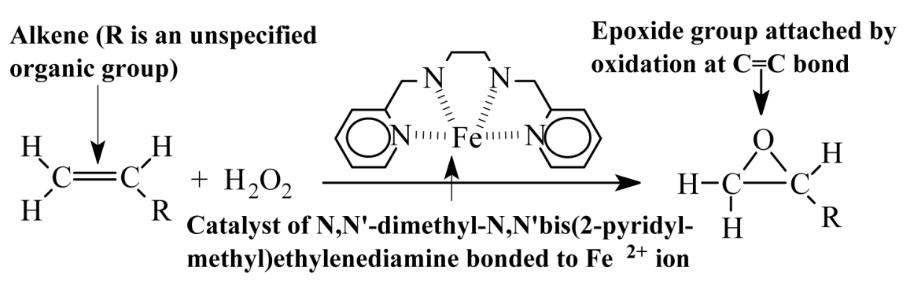
Найпростішим засобом додати енергії до реакції є нагрівання реакційної суміші. У промислових масштабах це зазвичай досягається за допомогою змійовиків труб, занурених в реакційну суміш, які нагріваються парою, що проходить через змійовики. Нагрівання шляхом пропускання струму електрики через електростійкі котушки також є засобом додавання енергії в хімічну систему. Значна частина зусиль у зеленій хімії була присвячена пошуку більш складних способів активізації хімічних систем.
Мікрохвильові печі можуть бути використані для додавання енергії до реакцій для підвищення швидкості реакції. Мікрохвильові печі - це електромагнітне випромінювання з довжинами хвиль від 1 см до 1 м (частота від 30 ГГц до 300 Гц). Щоб уникнути перешкод мікрохвильовим діапазонам, використовуваним у зв'язку, промислові та побутові мікрохвильові генератори зазвичай працюють на частоті 2,45 ГГц. Мікрохвилі поглинаються полярними молекулами, такими як молекули води, викликаючи швидко повторювану переорієнтацію молекул у мікрохвильовому полі. Результатом є високий надходження енергії безпосередньо в речовини, що піддаються мікрохвиль, тим самим додаючи енергію і прискорюючи реакції. Мікрохвильова енергія може бути введена безпосередньо у відносно невеликі обсяги реакційних середовищ, зменшуючи вимоги до матеріалу та мінімізуючи відходи. Мікрохвильові печі можуть бути використані для посилення реакцій у (1) водних середовищах, (2) полярних органічних розчинниках, таких як диметилформамід, і (3) реакціях без середовищ, таких як змішані тверді реагенти.
Sonochemistry додає енергію, піддаючи реакційне середовище ультразвуковій енергії на частотах від 20 до 100 кГц, що вводить дуже високі імпульси енергії в середовище. Зазвичай ультразвук виробляється п'єзоелектричним ефектом, завдяки якому кристали речовин, таких як титанат барію, просочений керамікою, піддаються швидкому реверсу електричних полів, перетворюючи електричну енергію в звукову енергію з ефективністю, яка може досягати 95%. Перевага сонохімії полягає в тому, що вона може вводити високу енергію в мікроскопічні області, що дозволяє реакції відбуватися без помітного нагрівання реакційного середовища.
Електрохімія шляхом проходження постійного струму електрики через реакційне середовище може спричинити як скорочення, так і окислення. Зменшення, додавання електронів, е -, відбувається на відносно негативно зарядженому катоді, а окислення, втрата електронів, на відносно позитивно зарядженому аноді. Електрохімічне окислення та відновлення можна контролювати застосованими електричними потенціалами, середовищами, в яких вони відбуваються, та використовуваними електродами. Оскільки додавання електронів до реакційного середовища (відновлення) і супутнє їх видалення (окислення) не додають речовини, електролітичні синтези відповідають цілям зеленої хімії. Електролітичне виробництво кисню та водню, екологічно чистого палива та цінної сировини, показано в розділі 13.15 та малюнку 13.10.
Фотохімічні реакції використовують енергію фотонів світла або ультрафіолетового випромінювання, щоб викликати реакції. Енергія, Е, фотона електромагнітного випромінювання частоти, ν, дорівнює E = h ν, де h - константа Планка. Оскільки фотон може бути поглинений безпосередньо молекулою або функціональною групою на молекулі, застосування електромагнітного випромінювання відповідної енергії до реакційного середовища може вводити велику кількість енергії в вид реагентів без значного нагрівання середовища. Фотохімічна енергія може бути використана для того, щоб реакції синтезу відбувалися ефективніше і з меншим виробництвом побічних продуктів відходів, ніж нефотохімічні процеси. Одним із прикладів є ацилювання бензохінону альдегідом для отримання ацильного гідрохінону, проміжного продукту, який використовується для виготовлення деяких спеціальних полімерів:
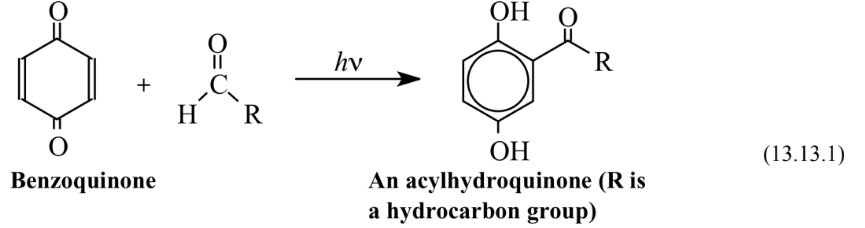
Ця реакція відбувається при 100% економії атомів. На відміну від стандартного типу реакції Friedel-Crafts, який використовує каталітичний ефект кислотних галогенідів кислотного типу Льюїса, зокрема хлориду алюмінію, AlCl 3, фотохімічний процес не вимагає каталітичних речовин, які, як правило, реактивні та чутливі до вологи та повітря.
Учасник реакції не повинен поглинати фотон безпосередньо, щоб пройти фотохімічно індуковану реакцію. У деяких випадках фотохімічно реактивні форми додають в реакційну суміш для поглинання фотонів, потім виробляють реактивні збуджені форми або вільні радикали, які здійснюють додаткові реакції. Прикладом цього є перекис водню, яка поглинає фотони.
\[\ce{H2O2 + } h \nu \rightarrow \ce{ HO \cdot + HO \cdot}\]
виробляти реактивні гідроксильні радикали, які реагують з рядом інших видів.
Інтенсифікація процесу та підвищена безпека при меншому розмірі
Інтенсифікація процесу може бути використана з реакторами безперервного потоку (рис. 13.8), що використовуються для інтенсифікації хімічних процесів і забезпечення збільшення виходу продукту з меншим розміром апарату. Особливо це стосується випадків, коли безперервний потік поєднується з гетерогенним каталізом і введенням енергії. Великою перевагою таких реакторів з точки зору зеленої хімії є підвищена безпека. Якщо щось піде не так в реакторі великої партії, в гіршому випадку може статися така аварія, як вибух або пожежа з великою кількістю матеріалу. З реактором безперервного потоку проблема може бути обмежена невеликим об'ємом реактора, і процес може бути негайно зупинений шляхом зупинки припливу реагентів.
