6.2: Сполуки вуглецю та водню - вуглеводні
- Page ID
- 18867
Величезна різноманітність та різноманітність органічної хімії обумовлена здатністю атомів вуглецю зв'язуватися один з одним у різноманітних прямих ланцюгах, розгалужених ланцюгах та кільцях та сусідніх атомів вуглецю, які з'єднуються одинарними, подвійними або потрійними зв'язками. Цю здатність склеювання можна проілюструвати найпростішим класом органічних хімічних речовин, вуглеводнів, що складаються тільки з водню і вуглецю. На малюнку 6.1 показані деякі вуглеводні в різних конфігураціях. Вуглеводні є основними інгредієнтами нафти і перекачуються з землі як сира нафта або видобуваються як природний газ. Вони мають два основних використання. Перший з них - горіння як джерело палива. Найбільш поширений вуглеводень в природному газі, метані, CH 4, спалюється в домашніх печах, електростанціях і навіть в двигуні транспортних засобів,
\[\ce{CH4 + 2O2 \rightarrow CO2 + 2H2O + heat energy}\]
для забезпечення енергією. Друге основне використання вуглеводнів - це сировина для виготовлення гуми, пластмас, полімерів та багатьох інших видів матеріалів. Враховуючи цінність вуглеводнів як матеріалу, прикро, що стільки видобутку вуглеводнів просто спалюється для забезпечення енергією, яка могла б генеруватися іншими способами.
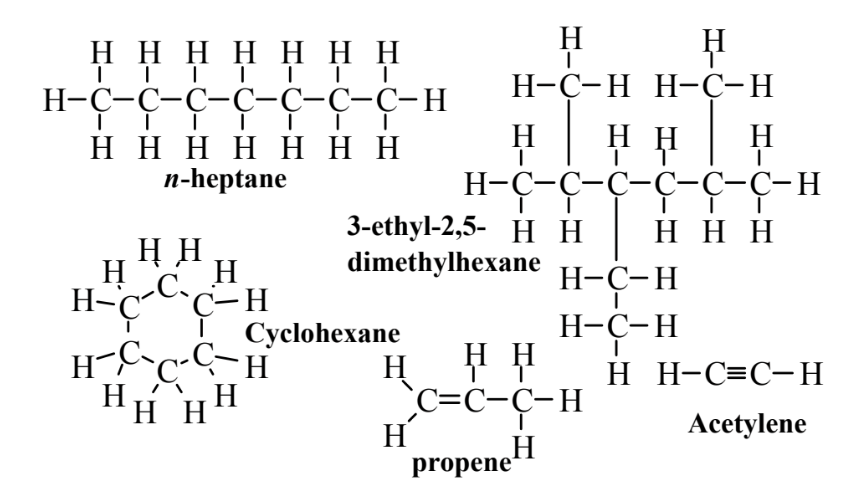
Існує кілька основних класів вуглеводнів, всі складаються тільки з водню і вуглецю. Алкани мають тільки поодинокі зв'язки між атомами вуглецю. Циклогексан, н-гептан та 3-етил-2,5-диметилгексан на малюнку 6.1 є алканами; циклогексан - циклічний вуглеводень. Алкени, такі як пропен, показаний на малюнку 6.1, мають принаймні один подвійний зв'язок, що складається з 4 спільних електронів між двома атомами вуглецю в молекулі. Алкіни мають принаймні один потрійний зв'язок між атомами вуглецю в молекулі, як показано для ацетилену на малюнку 6.1. Ацетилен є важливим паливом для зварювальних і ріжучих пальників; в іншому випадку алкіни мають відносно невелике значення і далі не будуть розглядатися. Четвертий клас вуглеводнів складається з ароматичних сполук, які мають кільця атомів вуглецю з особливими зв'язуючими властивостями, про що йдеться далі в цьому розділі.
Алкани
Молекулярними формулами нециклічних алканів є CnH2N+2. Підраховуючи числа атомів вуглецю та водню в молекулах алканів, показаних на малюнку 6.1, видно, що молекулярна формула n- гептану становить C 7 H 6, а 3-етил-2,5-диметилгексану - C 10 H 22, обидві з яких відповідають загальним формула, наведена вище. Загальна формула циклічних алканів - C n H 2n; що циклогексану, найпоширенішого циклічного алкану, - C 6 H 12. Ці формули є молекулярними формулами, які дають кількість атомів вуглецю і водню в кожній молекулі, але нічого не говорять про будову молекули. Формули, наведені на малюнку 6.1, є структурними формулами, які показують, як збирається молекула. Структура n- гептану - це структура прямого ланцюга атомів вуглецю; кожен атом вуглецю в середині ланцюга пов'язаний з атомами 2 Н, а 2 атоми вуглецю на кінцях ланцюга пов'язані з 3 атомами Н. Приставка геп в назві позначає 7 атомів вуглецю, а n- вказує на те, що з'єднання складається з однієї прямої ланцюга. Ця сполука може бути представлена конденсованою структурною формулою як CH 3 (CH 2) 5 CH 3, що представляє 7 атомів вуглецю в прямому ланцюзі. Крім згаданого раніше метану, нижні алкани включають наступне:
Етан: СН 3 СН 3 Пропан: СН 3 СН 2 СН 3 Бутан: СН 3 (СН 2) 2 СН 3 n- Пентан: СН 3 (СН 2) 3CH 3
Для алканів з 5 або більше атомами вуглецю префікс (ручка для 5, hex для 6, hept для 7, окт для 8, non для 9) показує загальну кількість атомів вуглецю в з'єднанні і n- може бути використаний для позначення алкану з прямим ланцюгом. Конденсовані структурні формули можуть бути використані для представлення розгалужених ланцюгових алканів, а також. Конденсована структурна формула 3-етил-2,5-диметилгексану становить
СН 3 СН (СН 3) СН (С 2 Н 5) СН 2 СН (СН 3) СН 3
У цій формулі атоми С та приєднані до них атоми Н, яких немає в дужках, показують вуглеці, які є частиною основного вуглеводневого ланцюга. (CH 3) після другого С в ланцюзі показує метильну групу, прикріплену до нього, (C 2 H 5) після третього атома вуглецю в ланцюзі показує прикріплену до нього етилову групу, а (CH 3) після п'ятого атома вуглецю в ланцюзі показує прикріплену до нього метильну групу .
Сполуки, які мають однакові молекулярні формули, але різні структурні формули, є структурними ізомерами. Наприклад, прямоланцюговий алкан з молекулярною формулою C 10 H 22 - n- декан
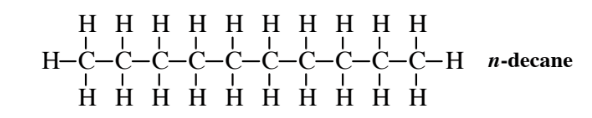
який є структурним ізомером 3-етил-2,5-диметилгексану.
Назви органічних сполук зазвичай базуються на структурі вуглеводню, з якого вони походять, використовуючи найдовший безперервний ланцюг атомів вуглецю в сполуці як основу назви. Наприклад, найдовша безперервна ланцюг атомів вуглецю в 3-етил-2,5-диметилгексані, показана на малюнку 6.1, - це 6 атомів вуглецю, тому назва заснована на hex ane. Назви гілок ланцюга також засновані на алканах, з яких вони походять. Як показано нижче,
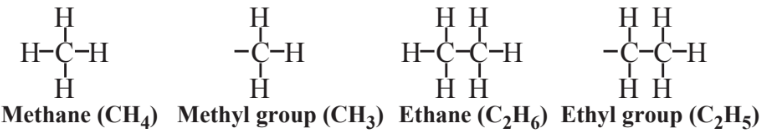
два алкани з коротким ланцюгом - метан з 1 атомом вуглецю і етан з 2 атомами вуглецю. Видалення 1 атомів Н з метану дає метильну групу, а видалення 1 атомів Н з етану дає етилову групу. Ці терміни використовуються в назві 3-етил-2,5-диметилгексан, щоб показати групи, прикріплені до основного ланцюга гексану. Атоми вуглецю в цьому ланцюжку нумеруються послідовно зліва направо. До 3-го атома вуглецю приєднується етилова група, що дає «3-етилову» частину назви, а метильні групи приєднуються до 2-го і 5-го атомів вуглецю, що дає «2,5-диметил» частину назви.
Назви, розглянуті вище, є систематичними назвами, які засновані на фактичних структурних формулах молекул. Крім того, існують загальні назви органічних сполук, які не вказують на структурні формули. Назви органічних сполук - складна тема, і тут не робиться ніяких спроб навчити читача. Однак з назв сполук, наведених у цьому та пізніших розділах, слід отримати деяку оцінку обґрунтування назв органічних сполук.
Крім спалювання їх для отримання енергії, основний вид реакції з алканами складається з реакцій заміщення, таких як,
\[\ce{C2H6 + 2Cl2 \rightarrow C2H4Cl2 + 2HCl}\]
в якому один або кілька атомів Н витісняються іншим видом атома. Зазвичай це перший крок у перетворенні алканів на сполуки, що містять інші елементи, крім вуглецю або водню, для використання в синтезі найрізноманітніших органічних сполук.
Алкени
Чотири загальних алкени показані на малюнку 6.2. Алкени мають принаймні один подвійний зв'язок C = C на молекулу і можуть мати більше. Перший з алкенів на малюнку 6.2, етилен, є дуже широко виробленим вуглеводнем, який використовується для синтезу поліетиленової пластмаси та інших органічних сполук. Щороку в США переробляється близько 25 мільярдів кілограмів (кг) етилену. Близько 14,5 млрд кг пропілену використовується в США щороку для виробництва поліпропіленової пластмаси та інших хімічних речовин. Дві 2-бутенові сполуки ілюструють важливий аспект алкенів, можливість цис-транс-ізомерії. Тоді як атоми вуглецю та групи, замінені на них, з'єднані одинарними зв'язками, можуть вільно обертатися відносно один одного так, ніби вони з'єднані одним валом, атоми вуглецю, з'єднані подвійним зв'язком, поводяться так, ніби вони прикріплені двома паралельними валами і не вільні обертатися. Отже, цис- 2-бутен, в якому дві кінцеві метильні (-СН3) групи знаходяться на одній стороні молекули, є відмінним з'єднанням від транс- 2-бутену, в якому вони знаходяться з протилежних сторін. Ці дві сполуки є цис-транс-ізомерами
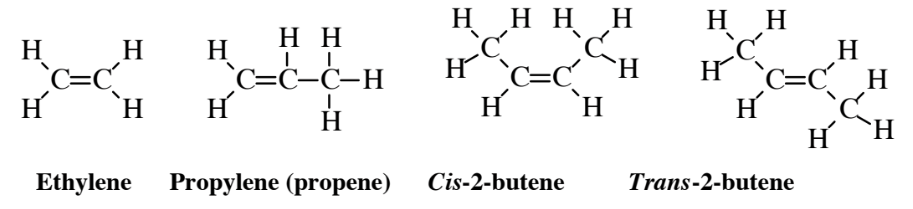
Алкени хімічно набагато активніше алканів. Це пов'язано з тим, що подвійний зв'язок ненасичений і має електрони, доступні для утворення додаткових зв'язків з іншими атомами. Це призводить до реакцій додавання, в яких молекула додається через подвійний зв'язок. Наприклад, додавання Н 2 О до етилену
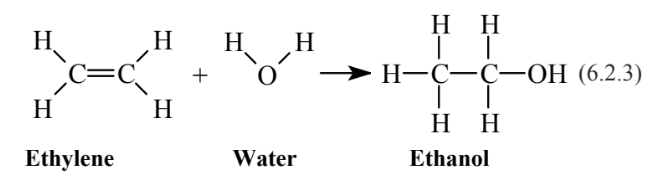
дає етанол, той самий вид алкоголю, який є в алкогольних напоях. На додаток до величезного додавання до хімічної універсальності алкенів, реакції додавання роблять їх досить реактивними в атмосфері під час утворення фотохімічного смогу. Наявність подвійних зв'язків також додає біохімічної і токсикологічної активності сполук в організмах.
Через свої подвійні зв'язки алкени можуть піддаватися реакціям полімеризації, в яких велика кількість окремих молекул додають один до одного, утворюючи великі молекули, звані полімерами (див. Розділ 6.5). Наприклад, 3 молекули етилену можуть складатися наступним чином:
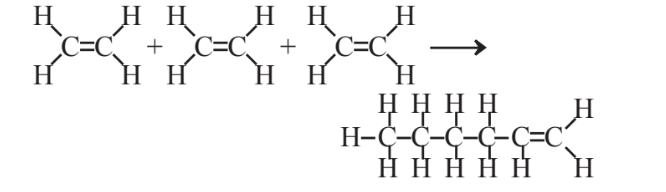
процес, який може тривати, утворюючи довші і довші ланцюги і в результаті утворення величезних молекул молекул поліетилену
Ароматичні вуглеводні
Особливий клас вуглеводнів складається з кілець атомів вуглецю, майже завжди містять атоми 6С, які можна розглядати як мають чергуються одно- і подвійні зв'язки, як показано нижче:
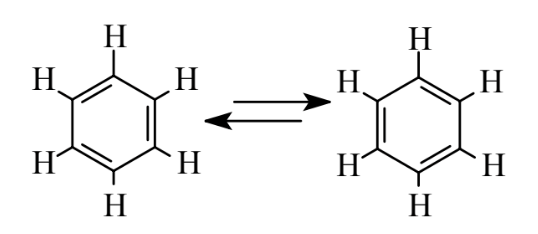
У цих структурах показаний найпростіший ароматичний вуглеводень, бензол, С6Н6. Хоча молекула бензолу представлена 3 подвійними зв'язками, хімічно вона сильно відрізняється від алкенів, наприклад, переживаючи реакції заміщення, а не реакції приєднання. Властивості ароматичних сполук - особливі властивості, які називаються ароматизмом. Дві структури, показані вище, є еквівалентними резонансними структурами, які можна розглядати як атоми, які залишаються в тих же місцях, але в яких зв'язки, що з'єднують атоми, можуть зміщувати позиції з рухом електронів, що складають зв'язки. Оскільки бензол має різні хімічні властивості від тих, що передбачені будь-якою з перерахованих вище структур, його зазвичай представляють у вигляді шестикутника з колом посередині:
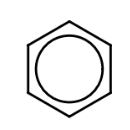
Багато ароматичні вуглеводні мають два і більше кілець. Найпростіший з них - нафталін,
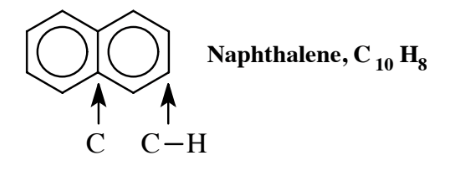
двокільцеве з'єднання, в якому два бензольних кільця поділяють атоми вуглецю, при якому вони з'єднані; ці два атоми вуглецю не мають приєднаних Н, кожен з інших атомів 8 C в сполуці має 1 Н приєднаний. Ароматичні вуглеводні з декількома кільцями, звані поліциклічними ароматичними вуглеводнями, ПАГ, поширені і часто виробляються як побічні продукти згоряння. Одним з найбільш вивчених з них є бензо (а) пірен,
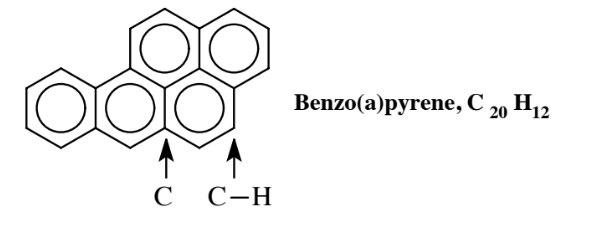
міститься в тютюновому димі, дизельному вихлопі та вугільному м'ясі. Ця сполука є токсикологічно значущою, оскільки частково окислюється ферментами в організмі для вироблення метаболіту, що викликає рак.
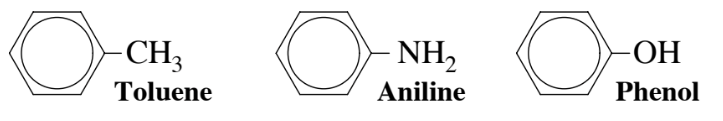
Наявність вуглеводневих груп і інших елементів, крім вуглецю і водню, пов'язаних з ароматичним вуглеводневим кільцем, дає різноманітні ароматичні сполуки. Три приклади поширених ароматичних сполук наведені нижче. Толуол широко використовується для хімічного синтезу і як розчинник. Практика зеленої хімії зараз вимагає заміни толуолу бензолом всюди, де це можливо, оскільки бензол підозрюється у спричиненні лейкемії, тоді як організм здатний метаболізувати толуол до нешкідливих метаболітів (див. Розділ 7). Близько 850 мільйонів кг аніліну виробляється в США щороку в якості проміжного продукту в синтезі барвників та інших органічних хімічних речовин. Фенол - відносно токсична ароматична сполука, що містить кисень, яка, незважаючи на свою токсичність для людини, була першим антисептиком, використовуваним у 1800-х роках.