4.5: Ковалентні зв'язки в сполуках
Розглянемо наступний приклад ковалентних зв'язків між атомами деяких більш легких елементів. Найкраще їх зрозуміти, посилаючись на малюнок 3.9, скорочений варіант періодичної таблиці, що показує символи Льюїса (зовнішня оболонка валентні електрони) перших 20 елементів. Як і у випадку з іонами, атоми, ковалентно пов'язані в молекулах, часто мають розташування електронів зовнішньої оболонки, як у благородного газу з атомним номером, найближчим до відповідного елемента. Тільки що було помічено, що ковалентно зв'язані атоми Н в молекулах H 2 мають 2 зовнішні оболонки електронів, як сусідній благородний газ гелій. Для атомів багатьох інших елементів тенденція полягає в придбанні 8 електронів зовнішньої оболонки - октет - при обміні електронів через ковалентні зв'язки. Ця тенденція лежить в основі правила октету, розглянутого в розділі 4.2. Ілюструючи застосування правила октета до ковалентного зв'язку, розділ 4.7 розглядає спочатку зв'язок атомів водню з атомами елементів з атомними номерами 6-9 у другому періоді таблиці Менделєєва.
Ці елементи близькі до благородного газового неону і, як правило, досягають «неоноподібного» октету електронів зовнішньої оболонки, коли вони утворюють ковалентно зв'язані молекули.
Ковалентні зв'язки характеризуються за кількома критеріями. Перший з них - це кількість задіяних електронів. Найпоширеніший тип ковалентного зв'язку складається з 2 спільних електронів і є єдиним зв'язком. Чотири спільні електрони, як показано для зв'язку, що з'єднує атом O з одним із атомів С у структурі ацетатного аніону вище, складають подвійний ковалентний зв'язок. І 6 спільних електронів, як показано для дуже стабільного ковалентного зв'язку, що з'єднує два атоми N в молекулі N 2, проілюстровані в главі 3, рис. 3.6, складають потрійний ковалентний зв'язок. Ці зв'язки умовно показані у вигляді ліній в структурних формулах молекул (велика кількість точок у формулі може трохи заплутатися). Отже, одиночний ковалентний зв'язок в Н 2 показаний як
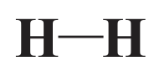
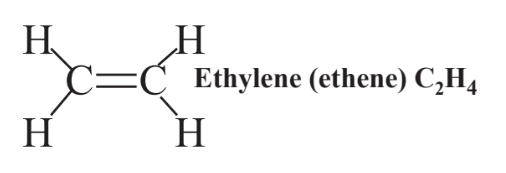
Подвійний зв'язок, що складається з 4 спільних електронів, що утримують два атоми вуглецю разом у C 2 H 4 (етилен, вуглеводень, який використовується для виготовлення поліетиленового пластику), показаний наступним чином:
А дуже міцні потрійні зв'язки, що з'єднують два атоми N в молекулі N 2, показані трьома рядками:

Ковалентні зв'язки мають характерну довжину зв'язку. Довжини зв'язків мають загальну величину розміру атомів, тому вони вимірюються в одиницях пікометрів (пм). H-H зв'язок в H 2 має довжину 75 вечора.
Третя важлива характеристика зв'язків - енергія зв'язку. Енергія зв'язку зазвичай виражається в кілоджоулі (кДж), необхідних для розриву моль (6.02 × 10 23) зв'язків. (Докладне визначення родимки див. Розділ 4.8.) Енергія зв'язку зв'язку H-H зв'язку в H 2 дорівнює 435 кДж/моль. Це означає, що кількість енергії, необхідної для розриву всіх зв'язків H-H в молі H 2 (2,0 г H 2, 6,02 × 10 23 молекул), становить дуже істотний 435 кДж.
