4.1: Хімічні зв'язки та утворення сполук
Хімічні сполуки складаються з молекул або агрегатів іонів, що складаються з двох або більше елементів, скріплених між собою хімічними зв'язками. Кілька прикладів хімічних сполук, включаючи воду (H 2 O), аміак (NH 3) та хлорид натрію (NaCl), були наведені в попередніх розділах. У цьому розділі розглядаються хімічні сполуки більш детально, включаючи аспекти їх зеленої хімії.
Важливий аспект хімічних сполук складається з видів зв'язків, які утримують їх разом. Як зазначалося раніше, це можуть бути ковалентні зв'язки, що складаються з спільних електронів або іонних зв'язків, що складаються з позитивно заряджених катіонів і негативно заряджених аніонів. Сильні сторони цих зв'язків варіюються і мають важливе значення при визначенні сполуки поведінки. Наприклад, хлорфторуглероди, такі як дихлордифторметан, Cl 2 CF 2, настільки стійкі, що зберігаються в атмосфері і не руйнуються до досягнення дуже великих висот в стратосфері, де виділення атомів хлору руйнує стратосферний озон. Надзвичайна стабільність хлорфторуглеродів обумовлена дуже високою міцністю зв'язків C-Cl і C-F, за допомогою яких хлор і фтор зв'язуються з центральним атомом вуглецю. Належна практика зеленої хімії вимагає, щоб речовини, які потрапляють у навколишнє середовище, легко руйнуються. Оскільки Cl 2 CF 2 настільки стабільний при попаданні в атмосферу, його не можна розглядати як дуже хорошу зелену хімічну речовину.
Ще одним важливим аспектом способу з'єднання хімічних сполук є молекулярна структура, яка відноситься до форми молекул. Розглянемо тільки що згадане з'єднання Cl 2 CF 2, в якому атоми Cl і F пов'язані з одним атомом вуглецю. Представляти цю молекулу як плоску структуру (нижче)
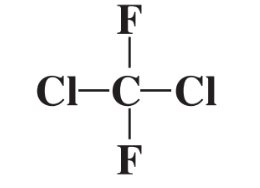
не є абсолютно правильним, тому що не всі 5 атомів у сполуці лежать в одній площині. Натомість атоми F і Cl можна візуалізувати як розподілені якомога далі один від одного в трьох вимірах навколо сфери, в центрі якої знаходиться атом С. Це можна представити як
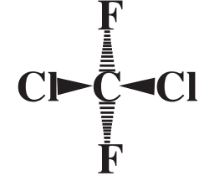
де два атоми Cl візуалізуються як знаходяться над площиною сторінки книги до читача, а два атоми F представлені як знаходяться нижче площини сторінки далеко від читача. Форма молекул дуже важлива при визначенні шляхів їх взаємодії з іншими молекулами. Наприклад, молекули ферментів, які дозволяють метаболізму відбуватися в живих організмах, розпізнають молекули субстрату, на які вони діють, за своїми взаємодоповнюючими формами.
Що таке зелений хімічних сполук?
Хімічні сполуки помітно різняться в тій мірі, в якій вони «зелені». дихлордифторметан, Cl 2 CF 2, хлорфторуглерод, розглянутий вище, безумовно, не зелений. Це не тому, що він токсичний - це одна з найменш токсичних синтетичних сполук, відомих - а тому, що вона настільки надзвичайно стабільна і стійка в атмосфері і може спричинити руйнування стратосферного озону. Сполуки, які його замінили, гідрофторуглеці та гідрохлорфторуглеці, набагато зеленіші, оскільки вони не тривають довго при виділенні в атмосферу або не містять хлору, що руйнує озон.
Існує кілька характеристик з'єднань, які відповідають критеріям бути зеленим. Це такі:
• Підготовка з відновлюваних або легкодоступних ресурсів екологічно чистими процесами
• Низька схильність до раптових, насильницьких, непередбачуваних реакцій, таких як вибухи, які можуть спричинити пошкодження, травмувати персонал або спричинити викид хімічних речовин та побічних продуктів у навколишнє середовище.
• Негорючий або погано горючий
• Низька токсичність
• Відсутність токсичних або екологічно небезпечних компонентів, особливо важких металів
• Легка деградабельність, особливо біологічне розкладання, в навколишньому середовищі.
• Низька схильність до біоакумуляції в харчових ланцюгах в навколишньому середовищі
Прикладом зеленого з'єднання є стеарат натрію, звичайне мило для рук. Це поширене речовина отримують шляхом взаємодії субпродукту тваринного жиру з гідроксидом натрію, який отримують шляхом пропускання електричного струму через морську воду. Промитий у стік, стеарат натрію реагує з кальцієм у воді, утворюючи твердий стеарат кальцію, білу тверду речовину, яка складається з «кільця для ванни». Це видаляє мило з води, а нетоксичний стеарат кальцію легко піддається біодеградації, так що він не зберігається в навколишньому середовищі.
