3.3: Шляхи та процеси, що визначають хімічну долю
- Page ID
- 18451
3.3. Шляхи і процеси, що визначають хімічну долю
Автори: Дік ван де Меент, Майкл Меттіс
Рецензент: Джон Парсонс
Цілі навчання:
Ви повинні вміти
- пояснити, як викиди хімічних речовин у навколишнє середовище призводить до впливу екосистем, популяцій та організмів, включаючи людину.
- зрозуміти, як кількісні знання кінетики процесів використовуються при математичному моделюванні долі навколишнього середовища
- розуміти поняття характеристики долевих процесів з точки зору констант швидкості і періоду напіврозпаду
- наведіть приклади відповідних долевих процесів і коротко опишіть їх
Ключові слова: процеси долі, деградація, транспорт, розділення
Характеризуючи «долю»
Хімічні речовини можуть виходити на всіх етапах свого життєвого циклу, наприклад, виготовлення, переробки, використання або утилізації. Вивільнення хімічних речовин у навколишнє середовище обов'язково призводить до впливу екосистем, популяцій та організмів, включаючи людину. Наука про оцінку впливу прагне проаналізувати, охарактеризувати, зрозуміти та (кількісно) описати шляхи та процеси, які пов'язують релізи з експозицією. Хімічні речовини в навколишньому середовищі зазнають різних процесів транспортування, перенесення та деградації, які можуть бути описані та кількісно визначені з точки зору коефіцієнтів втрат, тобто швидкості, з якою хімічні речовини втрачаються з екологічного відсіку, в яке вони викидаються або переносяться з сусідніх відсіків. Наука про оцінку впливу спрямована на захоплення «екологічної долі» хімічних речовин в описі процесів, які можуть бути використані при моделюванні балансу маси, використовуючи математичні вирази, запозичені з термодинамічних законів та кінетики хімічних реакцій (Trapp and Matthies, 1998).
«Доля» хімічної речовини в навколишньому середовищі може розглядатися як чистий результат набору процесів транспортування, перенесення та деградації (див. Розділ 3.4 про розподіл та розподіл констант, Розділ 3.6 про доступність та біодоступність, Розділ 3.7 про деградацію ), які починають діяти на хімічну речовину безпосередньо після його викиду (див. Розділ 3.2 про джерела викидів) та під час подальшого розподілу навколишнього середовища. Моделювання долі навколишнього середовища (див. Розділ 3.8 про мультимедійне моделювання балансу маси) спирається на ці знання, реалізуючи різні процеси деградації, перенесення та перенесення, отримані в науці про оцінку впливу, в математичних моделах, що імітують «долю хімічних речовин у навколишньому середовищі».
Кінетика першого порядку
У кінетиці хімічних реакцій кількість хімічної речовини в «системі» (наприклад, об'ємі поверхневих вод) описується рівняннями балансу маси такого роду:
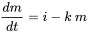 (ур. 1)
(ур. 1)
де 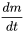 - швидкість зміни (кг.с -1) маси (кг) хімічної речовини в системі за час t (с), i - швидкість введення (кг.с -1) і k (s -1) - постійна швидкості реакції. Математично це рівняння є диференціальним рівнянням першого порядку в m, що означає, що швидкість втрат маси від системи пропорційна першій потужності m. Рівняння 1 широко застосовується в описі та характеристиці процесів долі навколишнього середовища: процеси долі навколишнього середовища, як правило, підкоряються кінетиці першого порядку і, як правило, можуть характеризуватися постійною швидкості реакції першого порядку k 1-го:
- швидкість зміни (кг.с -1) маси (кг) хімічної речовини в системі за час t (с), i - швидкість введення (кг.с -1) і k (s -1) - постійна швидкості реакції. Математично це рівняння є диференціальним рівнянням першого порядку в m, що означає, що швидкість втрат маси від системи пропорційна першій потужності m. Рівняння 1 широко застосовується в описі та характеристиці процесів долі навколишнього середовища: процеси долі навколишнього середовища, як правило, підкоряються кінетиці першого порядку і, як правило, можуть характеризуватися постійною швидкості реакції першого порядку k 1-го:
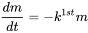 (ур. 2)
(ур. 2)
Такі рівняння номінальних втрат також можуть бути сформульовані в інтегральному форматі, який виходить шляхом інтеграції рівняння (2) з часом t з початковою масою m 0 = m (0):
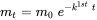 (ур. 3)
(ур. 3)
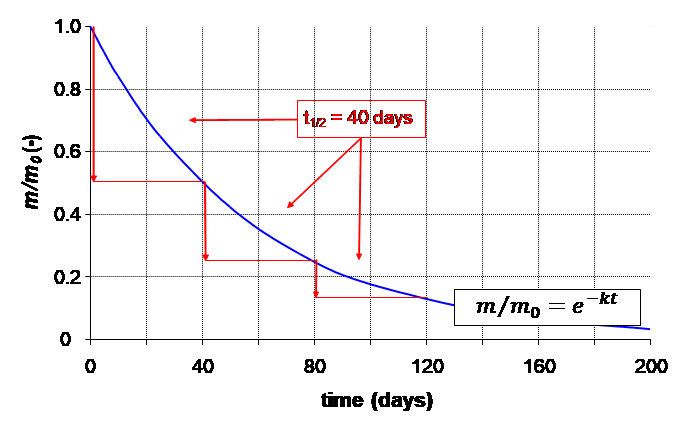
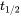 = 40 днів).
= 40 днів). Як показано на малюнку 1, очікується, що процеси втрат першого порядку призведуть до експоненціального зменшення маси, з якої концентрацію можна розрахувати діленням m на об'єм відсіку. Використовуючи значення 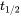 для t в рівнянні 3, прямо випливає, що величина
для t в рівнянні 3, прямо випливає, що величина  обернено пропорційна постійній швидкості втрат першого порядку
обернено пропорційна постійній швидкості втрат першого порядку 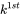 :
:
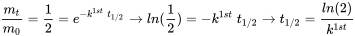 (ур. 4)
(ур. 4)
який показує, що час напіврозпаду постійний, тобто незалежний від концентрації розглянутого хімічного речовини. Це стосується всіх процесів втрати навколишнього середовища, які підкоряються кінетиці першого порядку. Тому процеси втрати першого порядку можуть бути достатньо охарактеризовані часом, необхідним для зникнення 50% від суми, спочатку присутньої.
Час зникнення DT50 часто використовується в екологічному регулюванні, але тільки ідентично з періодом напіврозпаду, якщо процес втрати першого порядку. Зверніть увагу, що мовчазне припущення про сталість періоду напіврозпаду означає, що розглянутий процес вважається підкорятися кінетиці першого порядку.
Абіотичні хімічні реакції
Виникнення істинної кінетики реакції першого порядку в хімії зустрічається рідко (див. Розділ 3.7 про деградацію). Вона виникає тільки тоді, коли речовини деградують мимовільно, без взаємодії з іншими хімічними речовинами. Хорошим прикладом є радіоактивний розпад елементів, зі швидкістю реакції, пропорційною (першій потужності) концентрації (маси) розпадається елемента, як у рівнянні 3.
Більшість хімічних реакцій між двома речовинами мають другий порядок:
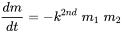 (ур. 5)
(ур. 5)
або, коли хімічна речовина реагує з собою:
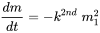 (ур. 6)
(ур. 6)
оскільки швидкість реакції пропорційна концентраціям (масам) обох реагентів. Це випливає безпосередньо з рівняння 2. Оскільки концентрації (маси) обох реагентів зменшуються в результаті протікає реакції, швидкість реакції зменшується під час реакції, швидше, тому при високих початкових концентраціях. Коли застосовується кінетика другого порядку, період напіврозпаду не є постійним, а збільшується при триваючій реакції, коли концентрації знижуються. В принципі, це стосується більшості хімічних реакцій, при яких розглядається хімічна речовина перетворюється в щось інше шляхом реакції з трансформуючим хімічним агентом.
У навколишньому середовищі доступність другого реагенту (трансформуючого агента) зазвичай надлишкова, так що його концентрація залишається майже не впливає на поточну реакцію трансформації. Це стосується окислення (реакції з киснем) і гідролізу (реакції з водою). У цих випадках швидкість реакції знижується зі зменшенням концентрації тільки першого хімічного речовини:
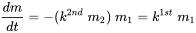 (ур. 7)
(ур. 7)
і кінетика реакції стає практично першого порядку: так звана псевдокінетика першого порядку. Псевдокінетика першого порядку процесів хімічного перетворення дуже поширена в навколишньому середовищі.
Біотична хімічна реакція
Хімічні реакції в біосфері часто каталізуються ферментами. Цей тип реакції є насиченим, і кінетика може бути описана кінетичною моделлю Міхаеля-Ментена для реакцій з одним субстратом. При низьких концентраціях відсутній ефект насичення ферменту і можна припустити, що реакція слідує (псевдо) кінетиці першого порядку. При концентраціях, досить високих для насичення ферменту, швидкість реакції не залежить від концентрацій (мас) реагентів, таким чином, постійна в часі під час реакції, і реакція підпорядковується кінетиці нульового порядку. Це справедливо для каталізу, де швидкість реакції залежить тільки від наявності каталізатора (зазвичай це площа реактивної поверхні):
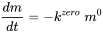 = постійна. (ур. 8)
= постійна. (ур. 8)
Можна сказати, що швидкість пропорційна нульовій потужності маси присутнього реагенту. У разі кінетики нульового порядку, час напіврозпаду довший для більшої початкової концентрації хімічної речовини.
Прикладом кінетики реакції нульового порядку є перетворення алкоголю (етанолу) в печінці. Теоретично і експериментально розроблено, що людська печінка виводить алкоголь з крові постійною швидкістю, незалежно від кількості випитого алкоголю.
Розпад мікробів
Мікробна деградація (часто її називають біодеградацією) є окремим випадком кінетики біотичних перетворень. Хоча це ферментативно каталізований процес, процес трансформації мікробів можна розглядати як результат зустрічі молекул хімічної речовини з мікробними клітинами, що повинно призвести до видимої кінетики другого порядку (першого порядку щодо кількості присутніх мікробних клітин, і першого порядку щодо маси присутніх хімічних речовин):
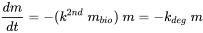 (ур. 9)
(ур. 9)
де m bio означає концентрацію (масу) активних бактерій, присутніх у природних поверхневих водах, а k град являє собою постійну швидкості деградації псевдопершого порядку.
Адвективний і дисперсійний транспорт
Хімічні речовини можуть переміщатися з однієї локальної точки в іншу вітровими і водними потоками. Адвекція означає транспорт уздовж осі струму, тоді як дисперсія - це процес турбулентного змішування у всіх напрямках. Адвективні процеси керуються зовнішніми силами, такими як швидкість вітру та води, або гравітація, така як падіння дощу та вилуговування в ґрунті. У більшості моделей експозиції ці процеси описуються спрощеним способом, наприклад, модель дисперсійного повітряного шлейфу. Прикладом процесу адвективного втрати першого порядку є відтік хімічної речовини з озера:
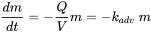 (ур. 10)
(ур. 10)
де Q позначає швидкість потоку озерної води [м³/с], а V - об'єм озера [м³]. Q/V відомий як постійна швидкість відновлення k adv транспортного середовища, тут вода. Більш складні гідрологічні, атмосферні або ґрунтові моделі вилуговування розглядають детальне просторове та часове дозвіл, що вимагає набагато більшої кількості даних та більших математичних обчислювальних зусиль (див. Розділи 3.1.2 та 3.8.2).
Перенесення і розбиття
Завдяки першому закону Фіка швидкість передачі через інтерфейс між двома середовищами (наприклад, водою та повітрям, або водою та осадом) пропорційна різниці концентрацій хімічної речовини в двох середовищах (див. Розділ 3.4 про розділення та Schwarzenbach et al., 2017 для подальшого читання). Поки концентрація в одному середовищі вище, ніж в іншому, тим більше молекул, ймовірно, пройде через інтерфейс. Прикладами є випаровування хімічних речовин з води (повітря) та поглинання газу з повітря (у воду або ґрунт), адсорбція з води (до відкладень, зважених твердих речовин та біоти) та десорбція з відкладень та інших твердих поверхонь.
Коли два середовища навколишнього середовища знаходяться в безпосередньому контакті, (першого порядку) передача може відбуватися у двох напрямках, у випадку води та повітря шляхом випаровування та поглинання газу: кожен зі швидкістю, пропорційною концентрації хімічної речовини в середовищі походження, і кожен з постійною швидкістю (першого порядку) характеристика фізичних властивостей хімічного і характеру розділу (площа, шорсткість). Це відоме як фізичне міжмедійне розділення (див. Розділ 3.4 про розділення), зазвичай представлений формулою хімічної реакції:
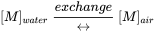 (ур. 11)
(ур. 11)
де [M] позначає (масову) концентрацію (одиницю маси на одиницю об'єму), а подвійна стрілка являє собою транспортування вперед і назад. Міжмедійне розбиття триває спонтанно, поки два середовища не прийшли до термодинамічної рівноваги. У стані рівноваги швидкості вперед і назад (тут: випаровування з води в повітря і поглинання газу з повітря у воду) стали рівними. При рівновазі загальна (вільна Гіббса) енергія системи досягла мінімуму: система прийшла в спокій, так що
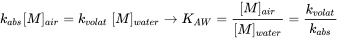 (ур. 12)
(ур. 12)
і співвідношення концентрацій хімічної речовини в двох середовищах досягло свого (термодинамічного) рівноваги значення, званого постійною рівноваги або коефіцієнтом поділу (див. Розділ 3.4 про поділ).
Виклик
Завдання екологічним хімікам полягає в описі та характеристиці різних процесів хімічної та мікробної деградації та трансформації, внутрішньосередовищних транспортних констант та швидкості передачі середніх середовищ та констант рівноваги з точки зору (i) фізичних та хімічних властивостей хімічних речовин розглянутих і (ii) властивостей екологічних середовищ.
Посилання
Шварценбах, Р.П., Гшвенд, П.М., Імбоден Д.М. Екологічна органічна хімія, третє видання, Wiley, ISBN 978-1-118-76723-8.
Трапп, С., Меттіс М. (1998). Хемодинаміка та моделювання навколишнього середовища. Вступ. Спрінгер, Гейдельберг, ISBN 3-540-63096-1.
Назвіть і поясніть своїми словами істотну екологічно важливу властивість (псевдо) кінетики першого порядку.
Наведіть приклади трансформаційних або транспортних процесів, які підкоряються кінетиці нульового порядку, першого порядку, другого порядку та псевдопершого порядку.
Чому корисно формулювати процеси долі навколишнього середовища з точки зору швидкості процесів і констант швидкості та констант рівноваги?
