15.4: Закони термодинаміки
- Page ID
- 20441
- Поясніть перший і другий закони термодинаміки
Термодинаміка відноситься до вивчення енергії та передачі енергії за участю фізичної речовини. Питання та її середовище, що мають відношення до конкретного випадку передачі енергії, класифікуються як система, і все, що знаходиться поза цією системою, називається оточенням. Наприклад, при нагріванні каструлі з водою на плиті система включає плиту, горщик та воду. Енергія передається всередині системи (між плитою, каструлею і водою). Існує два типи систем: відкрита і закрита. Відкрита система - це та, в якій енергія може передаватися між системою і її оточенням. Система плити відкрита, оскільки тепло може втрачатися в повітрі. Закрита система - це та, яка не може передавати енергію своєму оточенню.
Біологічні організми - це відкриті системи. Енергія обмінюється між ними та їх оточенням, оскільки вони споживають накопичують енергію молекули і виділяють енергію в навколишнє середовище, виконуючи роботу. Як і всі речі у фізичному світі, енергія підпорядковується законам фізики. Закони термодинаміки регулюють передачу енергії в і між усіма системами у Всесвіті.
Перший закон термодинаміки
Перший закон термодинаміки стосується загальної кількості енергії у Всесвіті. У ньому зазначено, що це загальна кількість енергії є постійним. Іншими словами, завжди було і буде, точно така ж кількість енергії у Всесвіті. Енергія існує в самих різних формах. Згідно з першим законом термодинаміки, енергія може передаватися з місця на місце або трансформуватися в різні форми, але вона не може бути створена або знищена. Перенесення і перетворення енергії відбуваються навколо нас весь час. Лампочки перетворюють електричну енергію в енергію світла. Газові плити перетворюють хімічну енергію з природного газу в теплову енергію. Рослини під час фотосинтезу виконують одне з найбільш біологічно корисних енергетичних перетворень на землі: перетворення енергії сонячного світла в хімічну енергію, що зберігається в органічних молекулах. Деякі приклади енергетичних перетворень наведені на малюнку\(\PageIndex{1}\).
Завдання для всіх живих організмів полягає в тому, щоб отримати енергію з оточення у формах, які вони можуть передавати або перетворювати в корисну енергію для виконання роботи. Живі клітини еволюціонували, щоб дуже добре відповісти на цю проблему. Хімічна енергія, що зберігається в органічних молекулах, таких як цукри та жири, перетворюється за допомогою серії клітинних хімічних реакцій в енергію всередині молекул АТФ (аденозинтрифосфату). Енергія в молекулах АТФ легко доступна для роботи. Приклади видів роботи, які повинні зробити клітини, включають побудову складних молекул, транспортування матеріалів, посилення руху вій або джгутиків, скорочення м'язових волокон для створення руху та розмноження.

Другий закон термодинаміки
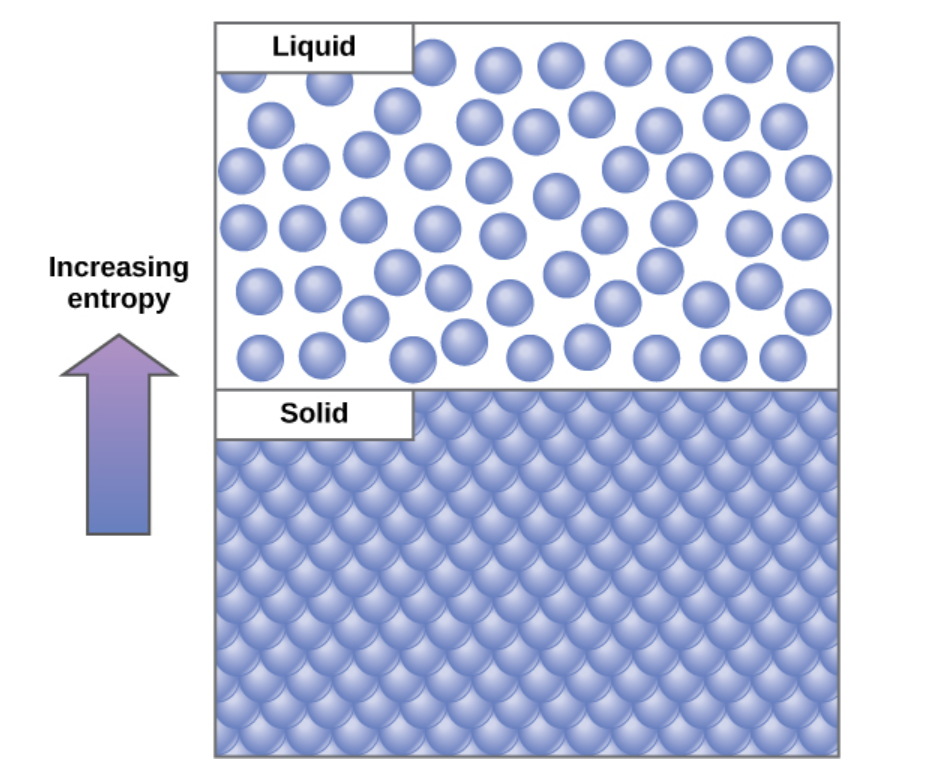
Важливою концепцією у фізичних системах є порядок і розлад (також відомий як випадковість). Чим більше енергії, яка втрачається системою до свого оточення, тим менш впорядкована і більш випадкова система. Вчені називають міру випадковості або розладу всередині системи як ентропію. Висока ентропія означає високий розлад і низьку енергію (рис.\(\PageIndex{2}\)). Щоб краще зрозуміти ентропію, подумайте про студентську спальню. Якби в нього не було вкладено ніякої енергії або роботи, приміщення швидко стане безладним. Він існував би в дуже невпорядкованому стані, одному з високої ентропії. Енергію потрібно вкласти в систему, у вигляді того, як студент виконує роботу і відкладає все подалі, щоб повернути кімнату в стан чистоти і порядку. Цей стан є одним з низької ентропії. Точно так само автомобіль або будинок необхідно постійно підтримувати з роботою, щоб тримати його в упорядкованому стані. Залишившись наодинці, ентропія будинку або автомобіля поступово збільшується через іржу та деградацію. Молекули та хімічні реакції також мають різну кількість ентропії. Наприклад, коли хімічні реакції досягають стану рівноваги, ентропія збільшується, а в міру того, як молекули при високій концентрації в одному місці дифузно і розтікаються, ентропія також збільшується.
Усі фізичні системи можна думати таким чином: Живі істоти дуже впорядковані, що вимагає постійного споживання енергії, щоб підтримувати в стані низької ентропії. Оскільки живі системи приймають молекули, що зберігають енергію, і перетворюють їх за допомогою хімічних реакцій, вони втрачають певну кількість корисної енергії в процесі, оскільки жодна реакція не є повністю ефективною. Вони також виробляють відходи та побічні продукти, які не є корисними джерелами енергії. Цей процес збільшує ентропію оточення системи. Оскільки всі передачі енергії призводять до втрати якоїсь корисної енергії, другий закон термодинаміки стверджує, що кожна передача або перетворення енергії збільшує ентропію Всесвіту. Незважаючи на те, що живі істоти високо впорядковані і підтримують стан низької ентропії, ентропія Всесвіту в цілому постійно збільшується через втрату корисної енергії з кожною передачею енергії, що відбувається. По суті, живі істоти перебувають у безперервній боротьбі з цим постійним збільшенням універсальної ентропії.
Резюме
- Перший закон стверджує, що загальна кількість енергії у Всесвіті постійна. Це означає, що енергія не може бути створена або знищена, тільки передана або перетворена.
- Другий закон термодинаміки стверджує, що кожна передача енергії передбачає деякі втрати енергії в непридатному вигляді, наприклад, теплової енергії, що призводить до більш невпорядкованої системи. Іншими словами, ніяка передача енергії не є повністю ефективною і прагне до розладу.