4.12: Форми та властивості - полярні та неполярні молекули
- Визначте, чи є молекула полярною або неполярною.
Молекулярна полярність
Щоб визначити, чи є молекула полярною чи неполярною, часто корисно подивитися на структури Льюїса. Неполярні сполуки будуть симетричними, тобто всі сторони навколо центрального атома ідентичні - пов'язані з одним і тим же елементом без нерозділених пар електронів. Зверніть увагу, що тетраедрична молекула,CCl4 така як неполярна Малюнок (4.12.1. Інша неполярна молекула, показана нижче, - трифторид бору, BF 3. BF 3 - тригональна планарна молекула і всі три периферичних атома однакові.



Полярні молекули асиметричні, або містять поодинокі пари електронів на центральному атомі, або мають атоми з різною електронегативністю, пов'язаними. Це працює досить добре - до тих пір, поки ви можете візуалізувати молекулярну геометрію. Це важка частина. Щоб знати, як орієнтовані зв'язки в просторі, ви повинні добре зрозуміти структури Льюїса та теорію VSEPR. Припускаючи, що ви це зробите, ви можете подивитися на структуру кожного з них і вирішити, полярна вона чи ні - чи знаєте ви окрему електронегативність атома. Це тому, що ви знаєте, що всі зв'язки між різнорідними елементами є полярними, і в цих конкретних прикладах не має значення, в якому напрямку вказують вектори дипольних моментів (назовні або в).
Полярна молекула - це молекула, в якій один кінець молекули трохи позитивний, а інший - трохи негативний. Двоатомна молекула, яка складається з полярного ковалентного зв'язку, наприкладHF, є полярною молекулою.
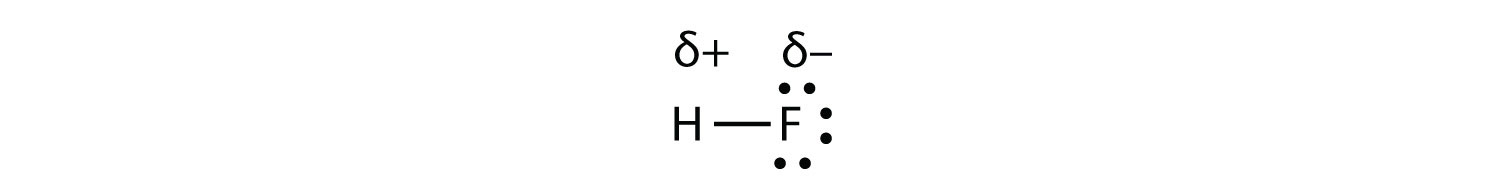
Як згадувалося в розділі 4.7, оскільки електрони в зв'язку знаходяться ближче до атома F, ця сторона молекули приймає частковий негативний заряд, який представлений Δ− (δ - це мала грецька буква дельта). Інша сторона молекули, атом Н, приймає частковий позитивний заряд, який представлений Δ+. Дві електрично заряджені області на будь-якому кінці молекули називаються полюсами, подібними до магніту, що має північний та південний полюси. Молекула з двома полюсами називається диполем (див. Малюнок нижче). Фтористий водень - диполь.

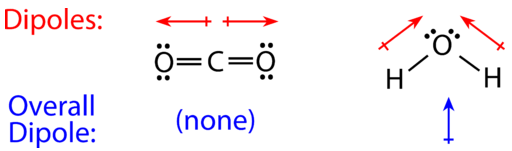
Для молекул, що мають більше двох атомів, молекулярна геометрія також повинна враховуватися при визначенні, чи є молекула полярною або неполярною. На малюнку нижче показано порівняння між вуглекислим газом і водою. Вуглекислий газ(CO2) - лінійна молекула. Атоми кисню більш електронегативні, ніж атом вуглецю, тому є два окремих диполя, що спрямовані назовні відC атома до кожногоO атома. Однак, оскільки диполі мають однакову міцність і орієнтовані таким чином, вони скасовують, а загальна молекулярна полярністьCO2 дорівнює нулю.
Вода - це зігнута молекула через двох одиноких пар на центральному атомі кисню. Окремі диполі вказують відH атомів доO атома. Через форму диполі не скасовують один одного, а молекула води полярна. На малюнку нижче чистий диполь показаний синім кольором і вказує вгору.
Три інші полярні молекули показані нижче зі стрілками, що вказують на більш щільні атоми електронів. Так само, як молекула води, жоден момент зв'язку не скасовується.

Підсумовуючи, щоб бути полярною, молекула повинна:
- Містять щонайменше одну полярну ковалентну зв'язок.
- Мають молекулярну структуру таку, що сума векторів кожного дипольного моменту зв'язку не скасовується.
- Намалюйте структуру Льюїса
- З'ясувати геометрію (використовуючи теорію VSEPR)
- Візуалізувати або намалювати геометрію
- Знайдіть чистий дипольний момент (вам не потрібно насправді робити розрахунки, якщо ви можете його візуалізувати)
- Якщо чистий дипольний момент дорівнює нулю, він неполярний. В іншому випадку вона полярна.
Позначте кожне з наступного як полярне або неполярне.
- Вода, Н 2 О:
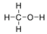
- Метанол, СН 3 ОН:
- Ціаністий водень, HCN:
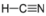
- Кисень, O 2:
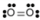
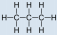
- Пропан, С 3 Н 8:
Рішення
- Вода полярна. Будь-яка молекула з одинокими парами електронів навколо центрального атома є полярною.
- Метанол полярний. Це не симетрична молекула. −OHСторона відрізняється від інших 3−H сторін.
- Ціаністий водень полярний. Молекула не симетрична. Азот і водень мають різну електронегативність, створюючи нерівномірну тягу на електрони.
- Кисень неполярний. Молекула симетрична. Два атоми кисню тягнуть електрони точно на однакову кількість.
- Пропан неполярний, тому що він симетричний, зH атомами, пов'язаними з кожною стороною навколо центральних атомів, і не мають спільних пар електронів.
Позначте кожне з наступного як полярне або неполярне.
а. SO 3
б. NH 3- Відповідь на
-
неполярний
- Відповідь б
-
полярний
Резюме
- Неполярні молекули симетричні, без нерозділених електронів.
- Полярні молекули асиметричні, або містять поодинокі пари електронів на центральному атомі, або мають атоми з різною електронегативністю, пов'язаними.
Автори та атрибуція
- Template:ContribCK12
- StackExchange (thomij).
- Template:ContribAgnewM
- Template:ContribAgnewH