4.10: Правила написання формул Льюїса
- Напишіть структури Льюїса для молекул і іонів.
- Знайте винятки з правила октету.
Наступна процедура може бути використана для побудови електронних структур Льюїса для більш складних молекул та іонів:
1. Визначте загальну кількість валентних електронів в молекулі або іоні.
- Складіть разом валентні електрони від кожного атома. (Нагадаємо, що кількість валентних електронів позначається положенням елемента в таблиці Менделєєва.)
- Якщо вид є багатоатомним іоном, не забудьте додати або відняти кількість електронів, необхідних для отримання загального заряду на іон.
Наприклад, для CO 3 2 − ми додаємо два електрони до загальної кількості через заряд −2.
2. Впорядкуйте атоми, щоб показати конкретні зв'язки.
- Коли є центральний атом, він зазвичай є найменш електронегативним елементом у з'єднанні. Хіміки зазвичай перераховують цей центральний атом першим у хімічній формулі (як у cCl 4 та CO 3 2 -, які обидва мають C як центральний атом), що є ще однією підказкою до структури сполуки.
- Водень і галогени майже завжди пов'язані лише з одним іншим атомом, тому вони, як правило, термінальні, а не центральні.
3. Помістіть зв'язкову пару електронів між кожною парою сусідніх атомів, щоб дати єдиний зв'язок.
- У Н 2 О, наприклад, є сполучна пара електронів між киснем і кожним воднем.
4. Починаючи з кінцевих атомів, додайте достатньо електронів до кожного атома, щоб дати кожному атому октет (два для водню).
- Ці електрони зазвичай будуть одинокими парами.
5. Якщо якісь електрони залишилися, помістіть їх на центральний атом.
- Пізніше ми пояснимо, що деякі атоми здатні вмістити більше восьми електронів.
6. Якщо центральний атом має менше електронів, ніж октет, використовуйте одинокі пари з кінцевих атомів, щоб сформувати множинні (подвійні або потрійні) зв'язки з центральним атомом для досягнення октету.
- Це не змінить кількість електронів на кінцевих атомах.
7. Фінальна перевірка
- Завжди переконайтеся, що всі валентні електрони враховуються, і кожен атом має октет електронів, крім водню (з двома електронами).
Центральний атом, як правило, є найменш електронегативним елементом в молекулі або іоні; водень і галогени, як правило, кінцеві.
Тепер застосуємо цю процедуру до деяких конкретних складів, починаючи з того, який ми вже обговорювали.
Напишіть структуру Льюїса для H 2 O.
Рішення
| Кроки для написання структур Льюїса | Приклад4.10.1: |
|---|---|
| 1. Визначте загальну кількість валентних електронів в молекулі або іоні. | \ (\ pageIndex {1}\):» style="vertical-align:middle; ">Кожен атом H (група 1) має 1 валентний електрон, а атом O (група 16) має 6 валентних електронів, загалом 8 валентних електронів. |
| 2. Впорядкуйте атоми, щоб показати конкретні зв'язки. | \ (\ індекс сторінки {1}\):» style="вертикальне вирівнювання: середина; ">
Ч О ЧОскільки атоми H майже завжди кінцеві, розташування всередині молекули повинно бути HOH. |
|
3. Помістіть зв'язкову пару електронів між кожною парою сусідніх атомів, щоб дати єдиний зв'язок. 4. Починаючи з кінцевих атомів, додайте достатньо електронів до кожного атома, щоб дати кожному атому октет (два для водню). |
\ (\ індекс сторінки {1}\):» style="вертикальне вирівнювання: середина; ">
Розміщення однієї сполучної пари електронів між атомом O і кожним атомом H дає Ч -О- Чз 4 електронами, що залишилися. Кожен атом Н має повну валентну оболонку з 2 електронів. |
| 5. Якщо якісь електрони залишилися, помістіть їх на центральний атом. | \ (\ індекс сторінки {1}\):» style="вертикальне вирівнювання: середина; ">
Додавання решти 4 електронів до кисню (у вигляді двох одиноких пар) дає наступну структуру:
|
| 6. Якщо центральний атом має менше електронів, ніж октет, використовуйте одинокі пари з кінцевих атомів, щоб сформувати множинні (подвійні або потрійні) зв'язки з центральним атомом для досягнення октету. | \ (\ PageIndex {1}\):» style="вертикальне вирівнювання: middle; "> Не потрібно |
| 7. Фінальна перевірка | \ (\ pageIndex {1}\):» style="vertical-align:middle; ">Структура Льюїса дає кисень октет і кожному водню два електрони, |
Напишіть структуру Льюїса дляCH2O молекули
Рішення
| Кроки для написання структур Льюїса | Приклад4.10.2 |
|---|---|
| 1. Визначте загальну кількість валентних електронів в молекулі або іоні. | \ (\ pageIndex {2}\) ">Кожен атом водню (група 1) має один валентний електрон, вуглець (група 14) має 4 валентних електронів, а кисень (група 16) має 6 валентних електронів, загалом [(2) (1) + 4 + 6] = 12 валентних електронів. |
| 2. Впорядкуйте атоми, щоб показати конкретні зв'язки. | \ (\ індекс сторінки {2}\) ">
Оскільки вуглець менш електронегативний, ніж кисень, а водень, як правило, термінальний, С повинен бути центральним атомом. |
| 3. Помістіть зв'язкову пару електронів між кожною парою сусідніх атомів, щоб дати єдиний зв'язок. | \ (\ індекс сторінки {2}\) ">
Розміщення зв'язкової пари електронів між кожною парою зв'язаних атомів дає наступне: 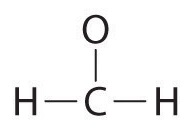 |
Використовується шість електронів, а 6 залишаються.
4. Починаючи з кінцевих атомів, додайте достатньо електронів до кожного атома, щоб дати кожному атому октет (два для водню). \ (\ індекс сторінки {2}\) ">Додавання всіх 6 електронів, що залишилися до кисню (як три одинокі пари) дає наступне:

Хоча кисень зараз має октет і кожен водень має 2 електрони, вуглець має лише 6 електронів.
5. Якщо якісь електрони залишилися, помістіть їх на центральний атом. \ (\ індекс сторінки {2}\) ">Не потрібно
На центральному атомі не залишилося електронів.
6. Якщо центральний атом має менше електронів, ніж октет, використовуйте одинокі пари з кінцевих атомів, щоб сформувати множинні (подвійні або потрійні) зв'язки з центральним атомом для досягнення октету. \ (\ індекс сторінки {2}\) ">Щоб дати вуглецю октет електронів, ми використовуємо одну з одиноких пар електронів на кисні, щоб утворити подвійний зв'язок вуглець-кисень:
Напишіть електронні структури Льюїса для CO 2 і ScL 2, пахне ворсом, нестійкої червоної рідини, яка використовується при виготовленні гуми.
- Відповідь СО 2
-
.


- Відповідь на SCL 2
-
.
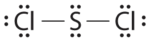
Верховний суд Сполучених Штатів має незавидне завдання вирішити, що таке закон. Ця відповідальність може стати серйозним викликом, коли немає чіткого принципу або коли існує нова ситуація, з якою раніше не стикалися. Хімія стикається з тією ж проблемою в розширенні основних понять, щоб відповідати новій ситуації. Малювання структур Льюїса для багатоатомних іонів використовує той же підхід, але трохи підлаштовує процес, щоб відповідати дещо іншому набору обставин.
Структура Льюїса для багатоатомних іонів
Нагадаємо, що багатоатомний іон - це група атомів, ковалентно пов'язаних між собою і які несуть загальний електричний заряд. Іон амонію утворюєтьсяNH+4, коли іон водню(H+) приєднується до єдиної пари(NH3) молекули аміаку в координатно-ковалентному зв'язку.
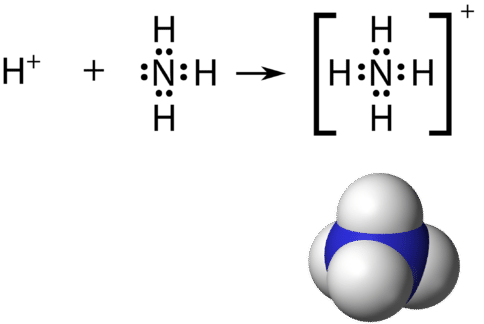
При малюванні структури Льюїса багатоатомного іона заряд іона відбивається в кількості сумарних валентних електронів в структурі. У випадку з іоном амонію:
1Nатомні=5 валентні електрони
4Hатоми=4×1=4 валентних електронів
відняти 1 електрон для1+ заряду іона
всього 8 валентних електронів в іоні
Структура Льюїса багатоатомного іона прийнято ставити у великий набір дужок, при цьому заряд іона у вигляді верхнього індексу поза дужками.
Намалюйте електронну точкову структуру Льюїса для сульфатного іона.
- Відповідь

Винятки з правила октету
Настільки ж важливим і корисним, як правило октета при хімічному зв'язуванні, є деякі відомі порушення. Це не означає, що правило октету марне - зовсім навпаки. Як і у багатьох правилах, є винятки, або порушення.
Існує три порушення правила октета. Молекули непарних електронів являють собою перше порушення правила октета. Хоча їх небагато, деякі стабільні сполуки мають непарну кількість електронів в своїх валентних оболонках. При непарній кількості електронів хоча б одному атому в молекулі доведеться порушувати правило октета. Прикладами стабільних непарних електронів молекул є NO, NO 2 та ClO 2. Електронна точкова діаграма Льюїса для NO виглядає наступним чином:

Хоча атом O має октет електронів, атом N має лише сім електронів у своїй валентній оболонці. Хоча NO є стабільною сполукою, вона дуже хімічно реактивна, як і більшість інших сполук непарних електронів.
Електрон-дефіцитні молекули являють собою друге порушення октетного правила. Ці стабільні сполуки мають менше восьми електронів навколо атома в молекулі. Найбільш поширеними прикладами є ковалентні сполуки берилію і бору. Наприклад, берилій може утворювати дві ковалентні зв'язку, в результаті чого в його валентній оболонці утворюється всього чотири електрона:

Бор зазвичай робить лише три ковалентні зв'язки, в результаті чого навколо атома В утворюється лише шість валентних електронів. Відомий приклад - BF 3:

Третє порушення октетного правила виявляється в тих сполуках з більш ніж вісьмома електронами, присвоєними їх валентної оболонці. Вони називаються молекулами розширеної валентної оболонки. Такі сполуки утворюються тільки центральними атомами в третьому ряду таблиці Менделєєва або за його межами, які мають в своїх валентних оболонках порожні d орбіталі, які можуть брати участь в ковалентному зв'язку. Одним з таких з'єднань є ПФ 5. Єдина розумна електронна точкова діаграма Льюїса для цієї сполуки має атом P, що утворює п'ять ковалентних зв'язків:

Формально атом Р має в своїй валентній оболонці 10 електронів.
Визначте кожне порушення правила октету, намалювавши електронну точкову діаграму Льюїса.
- КЛО
- СФ 6
Рішення
а. з одним атомом Cl і одним атомом O ця молекула має 6 + 7 = 13 валентних електронів, тому це непарна електронна молекула. Електронна точкова діаграма Льюїса для цієї молекули виглядає наступним чином:
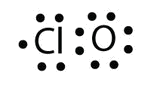
b У SF 6 центральний атом S робить шість ковалентних зв'язків з шістьма оточуючими атомами F, тому це розширена молекула валентної оболонки. Його електронна точкова діаграма Льюїса виглядає наступним чином:

Визначте порушення правила октету в XeF 2, намалювавши електронну точкову діаграму Льюїса.
- Відповідь:
-

Атом Xe має розширену валентну оболонку з більш ніж вісьмома електронами навколо нього.
Резюме
- Точкові символи Льюїса (структури Льюїса) забезпечують просту раціоналізацію того, чому елементи утворюють сполуки із спостережуваними стехіометріями.
- В електронних структурах Льюїса ми стикаємося з парами зв'язку, які поділяються двома атомами, і одинокими парами, які не поділяються між атомами.
- Структури Льюїса для багатоатомних іонів дотримуються тих же правил, що і для інших ковалентних сполук.
- Існує три порушення правила октету: непарні електронні молекули, молекули з дефіцитом електронів та молекули розширеної валентної оболонки

