4.8: багатоатомні молекули - вода, аміак та метан
- Page ID
- 20521
- Визначте кількість зв'язків, утворених загальними неметалевими елементами.
- Проілюструйте утворення ковалентних зв'язків за допомогою електронних точкових діаграм Льюї
Більше двох атомів можуть брати участь у ковалентному зв'язку, хоча будь-який даний ковалентний зв'язок буде лише між двома атомами. Вода, аміак, метан - поширені приклади, які будуть детально розглянуті нижче. Вуглець унікальний тим, наскільки він утворює одинарні, подвійні та потрійні зв'язки з собою та іншими елементами. Кількість зв'язків, утворених атомом в його ковалентних сполуках, не є довільним. Водень, кисень, азот і вуглець мають дуже сильні тенденції до утворення речовин, в яких вони мають один, два, три і чотири зв'язку з іншими атомами відповідно (табл.\(\PageIndex{1}\)).
| Атом | Кількість облігацій |
|---|---|
| H (група 1) | 1 |
| O (група 16) | 2 |
| N (група 15) | 3 |
| C (група 14) | 4 |
Вода
Розглянемо атоми H і O:

Атоми H і O можуть ділити електрон, утворюючи ковалентний зв'язок:

Атом Н має повну валентну оболонку. Однак атом О має всього сім електронів навколо нього, що не є повним октетом. Ми фіксуємо це, включивши другий атом H, чий одиночний електрон зробить другий ковалентний зв'язок з атомом O:

(Неважливо, на якій стороні розташований другий атом Н.) Тепер атом О має повний октет навколо себе, і кожен атом Н має два електрони, що заповнюють свою валентну оболонку. Так утворюється молекула води H 2 O.
Аміак
Атом N має наступну електронну точкову діаграму Льюїса:
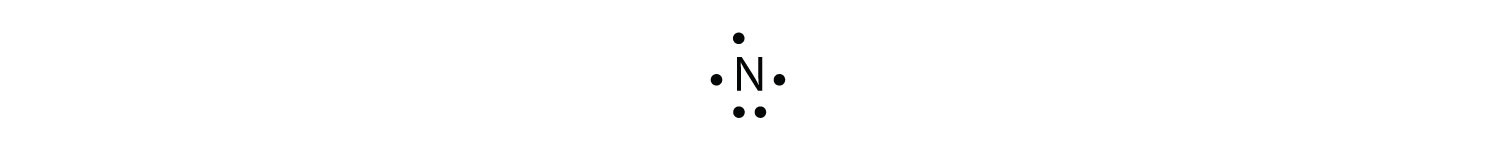
Він має три непарних електронів, кожен з яких може створити ковалентний зв'язок, ділившись електронами з атомом Н. Електронна точкова діаграма NH 3 виглядає наступним чином:

Метан
Атом С має наступну електронну точкову діаграму Льюїса:

Він має чотири непарних електронів, кожен з яких може створити ковалентний зв'язок, ділившись електронами з атомом Н. Електронна точкова діаграма СН 4 виглядає наступним чином:

Резюме
У багатоатомних молекулах існує картина ковалентних зв'язків, які можуть утворювати різні атоми.
Автори та атрибуція
- TextMap: Beginning Chemistry (Ball et al.)
- Template:ContribAgnewM