4.7: Нерівний розподіл - полярні ковалентні облігації
- Визначте електронегативність
- Визначте полярність ковалентного зв'язку.
Електронегативність
Здатність атома в молекулі притягувати спільні електрони називається електронегативністю. Коли два атоми об'єднуються, різниця між їх електронегативністю є вказівкою на тип зв'язку, який буде утворюватися. Якщо різниця між електронегативністю двох атомів невелика, жоден атом не може повністю відвести спільні електрони від іншого атома, і зв'язок буде ковалентним. Якщо різниця між електронегативністю велика, тим більше електронегативний атом відведе зв'язкові електрони повністю від іншого атома (відбудеться перенесення електронів), і зв'язок буде іонною. Ось чому метали (низька електронегативність), пов'язані з неметалами (висока електронегативність) зазвичай виробляють іонні сполуки.
Зв'язок може бути настільки полярним, що електрон фактично переходить від одного атома до іншого, утворюючи справжній іонний зв'язок. Як ми оцінюємо ступінь полярності? Вчені розробили шкалу під назвою електронегативність, шкалу для оцінки того, наскільки атоми будь-якого елемента притягують електрони. Електронегативність - це безодиничне число; чим більше число, тим більше атом притягує електронів. Загальна шкала електронегативності показана на малюнку4.7.1.
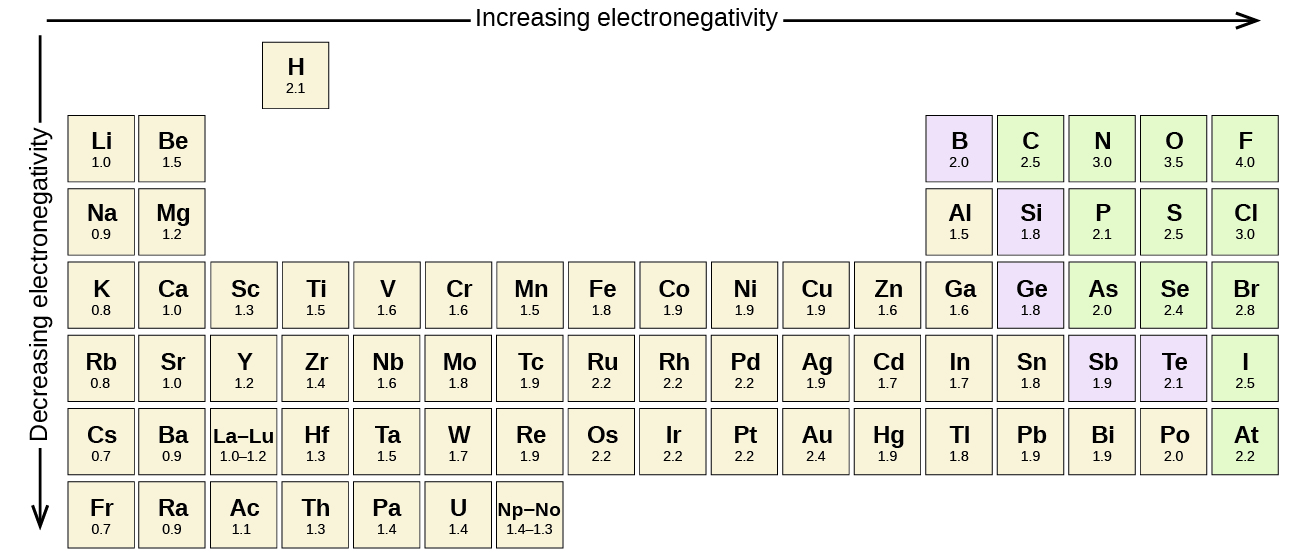
Полярність облігацій
Про полярність ковалентного зв'язку можна судити, визначаючи різницю електронегативностей двох атомів, що беруть участь в ковалентному зв'язку, як це підсумовано в наступній таблиці:
| Різниця електронегативності | Тип облігації |
|---|---|
| 0 | неполярний ковалентний |
| 0-0,4 | злегка полярний ковалентний |
| 0,5—2,0 | виразно полярний ковалентний |
| >2.0 | ймовірно, іонний |
Неполярні ковалентні зв'язки
Зв'язок, в якій різниця електронегативності менше 1,9, вважається здебільшого ковалентною за характером. Однак на даний момент нам потрібно розрізняти два загальних типи ковалентних зв'язків. Неполярний ковалентний зв'язок - це ковалентний зв'язок, в якій електрони зв'язку поділяються порівну між двома атомами. У неполярному ковалентному зв'язку розподіл електричного заряду збалансований між двома атомами.
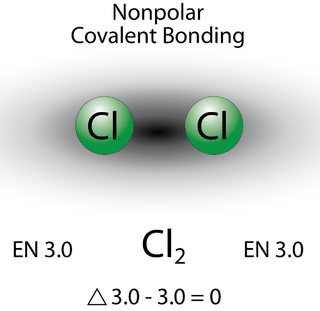
Два атоми хлору поділяють пару електронів в одному ковалентному зв'язку однаково, а електронна щільність, що оточуєCl2 молекулу, симетрична. Також зверніть увагу, що молекули, в яких різниця електронегативності дуже мала (<0,5), також вважаються неполярними ковалентними. Прикладом може бути зв'язок між хлором і бромом (ΔEN=3.0−2.8=0.2).
Полярні ковалентні зв'язки
Зв'язок, в якій різниця електронегативності між атомами становить від 0,5 до 2,0, називається полярним ковалентним зв'язком. Полярний ковалентний зв'язок - це ковалентний зв'язок, в якій атоми мають нерівне тяжіння для електронів, і тому поділ нерівний. У полярному ковалентному зв'язку, іноді просто званому полярним зв'язком, розподіл електронів навколо молекули вже не симетричний.
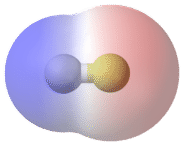
Простий спосіб проілюструвати нерівномірний розподіл електронів у полярному ковалентному зв'язку - використовувати грецьку букву дельта(δ).

Атом з більшою електронегативністю набуває частковий негативний заряд, в той час як атом з меншою електронегативністю набуває частковий позитивний заряд. Символ дельта використовується для позначення того, що кількість заряду менше одиниці. Схрещена стрілка також може використовуватися для позначення напрямку більшої електронної щільності.
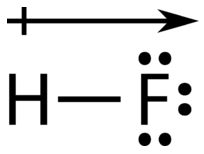
Електронегативні відмінності в склеюванні за допомогою шкали Паулінга. Використання відмінностей в електронегативності для класифікації зв'язків як ковалентних, полярних ковалентних або іонних.
Яка полярність кожного зв'язку?
- С—Ч
- О—Ч
Рішення
Використовуючи малюнок4.7.1, ми можемо обчислити різницю електронегативності атомів, що беруть участь в зв'язку.
- Для зв'язку С—Н різниця в електронегативності становить 2,5 − 2,1 = 0,4. Таким чином, ми прогнозуємо, що цей зв'язок буде неполярним ковалентним.
- Для зв'язку O—H різниця в електронегативності становить 3,5 − 2,1 = 1,4, тому ми прогнозуємо, що цей зв'язок буде однозначно полярним ковалентним.
Яка полярність кожного зв'язку?
- Rb—F
- P—Cl
- Відповідь на
-
ймовірно, іонний
- Відповідь б
-
полярний ковалентний
Резюме
- Тип зв'язку (полярний ковалентний, неполярний ковалентний або іонний) між двома атомами визначається відмінностями в електронегативності.
- Для атомів, що розділяють полярну ковалентну зв'язок, атом з більшою електронегативністю набуває частковий негативний заряд, в той час як атом з меншою електронегативністю набуває частковий позитивний заряд.
Автори та атрибуція
- Template:ContribCK12
- StackExchange (thomij).
- Template:ContribAgnewM
- Template:ContribAgnewH
