4.6: Ковалентні зв'язки - спільні електронні пари
- Визначте ковалентний зв'язок.
- Проілюструйте утворення ковалентних зв'язків за допомогою електронних точкових діаграм Льюї
Іонне з'єднання зазвичай відбувається, коли одному атому легко втратити один або кілька електронів, а інший атом - отримати один або кілька електронів. Однак деякі атоми не здаватимуться або набирають електрони легко. І все ж вони все ще беруть участь у формуванні з'єднання. Як? Існує ще один механізм отримання повної валентної оболонки: спільне використання електронів. Коли електрони діляться між двома атомами, вони утворюють зв'язок, який називається ковалентним зв'язком.
Хіміки часто використовують діаграми Льюїса для представлення ковалентного зв'язку в молекулярних речовині. Наприклад, діаграми Льюїса двох окремих атомів водню такі:

Діаграма Льюїса двох атомів водню, що діляться електронами, виглядає так:

Ми можемо використовувати кола, щоб показати, що кожен атом H має два електрони навколо ядра, повністю заповнюючи валентну оболонку кожного атома:
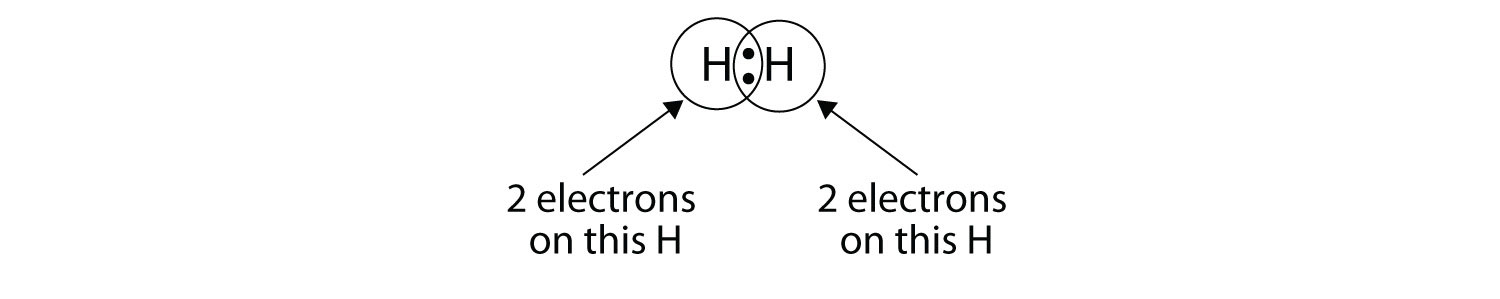
Оскільки кожен атом Н має заповнену валентну оболонку, цей зв'язок стабільний, і ми створили двоатомну молекулу водню. (Це пояснює, чому водень є одним з двоатомних елементів.) Заради простоти, незвично представляти ковалентний зв'язок тире, а не двома крапками:
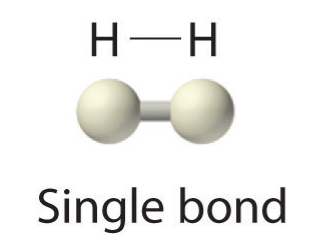
Оскільки два атоми поділяють одну пару електронів, цей ковалентний зв'язок називається єдиним зв'язком. Як інший приклад розглянемо фтор. Атоми F мають сім електронів в валентній оболонці:
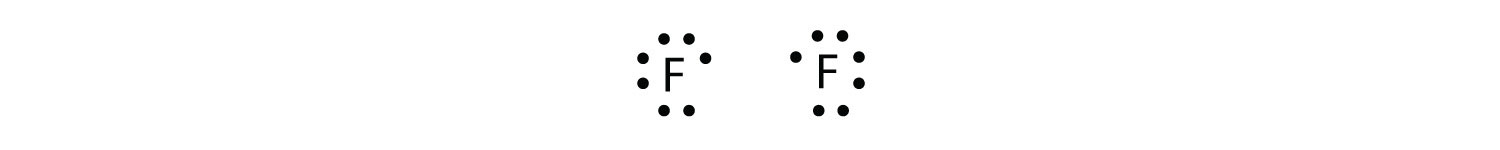
Ці два атоми можуть робити те саме, що і атоми Н; вони поділяють свої непарні електрони, щоб створити ковалентний зв'язок.

Зверніть увагу, що кожен атом F має повний октет навколо нього зараз:
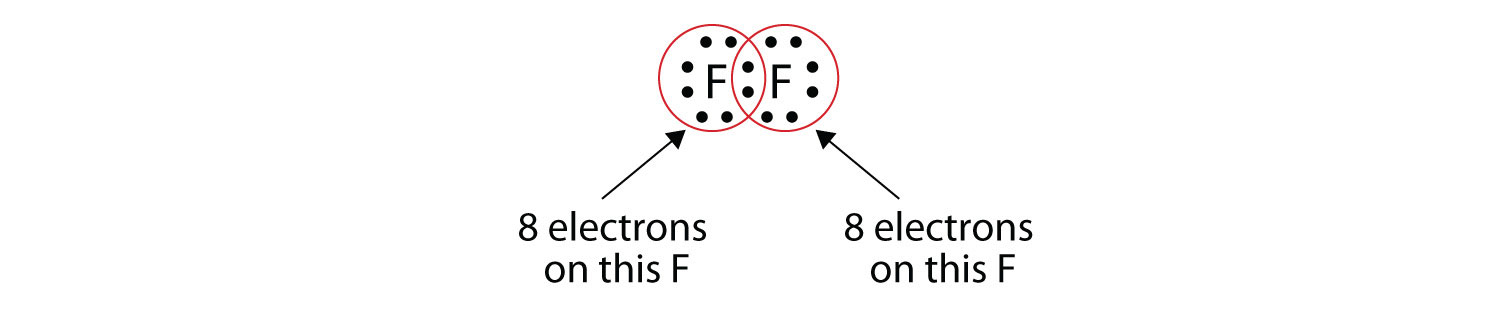
Ми також можемо написати це за допомогою тире для представлення спільної електронної пари:
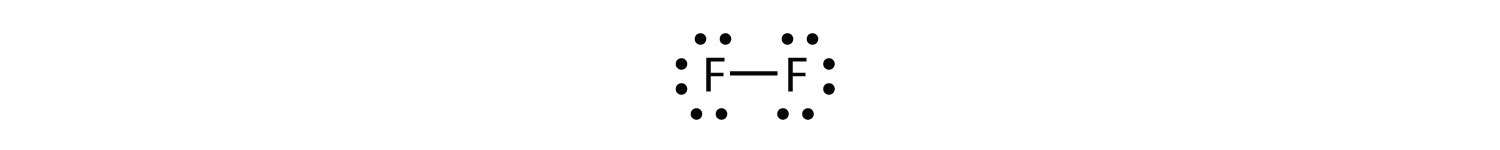
У двоатомній молекулі фтору є два різних типи електронів. Зв'язуюча електронна пара робить ковалентний зв'язок. Кожен атом F має три інші пари електронів, які не беруть участі в зв'язку; вони називаються одинокими парними електронами. Кожен атом F має одну сполучну пару і три одинокі пари електронів.
Ковалентні зв'язки можуть бути зроблені між різними елементами, а також. Одним із прикладів є HF. Кожен атом починається з непарної кількості електронів у своїй валентній оболонці:

Два атоми можуть ділитися своїми непарними електронами, щоб створити ковалентний зв'язок:

У цій молекулі атом водню не має незв'язних електронів, тоді як атом фтору має шість незв'язних електронів (три одинокі електронні пари). Кола показують, як заповнюються валентні електронні оболонки для обох атомів.
Використовуйте електронні точкові діаграми Льюїса, щоб проілюструвати утворення ковалентних зв'язків у HBr.
Рішення
HBr дуже схожий на HF, за винятком того, що він має Br замість F. Атоми такі:

Два атоми можуть ділитися своїм непарним електроном:

Використовуйте електронні точкові діаграми Льюїса, щоб проілюструвати утворення ковалентних зв'язків у Cl 2.
- Відповідь:
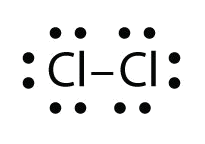
При роботі з ковалентними структурами іноді здається, що у вас залишилися електрони. Ви застосовуєте правила, які ви вивчили до цих пір, і все ще є деякі електрони, що висять там без прив'язки. Ви не можете просто залишити їх там. Так куди ж ви їх поклали?
Множинні ковалентні облігації
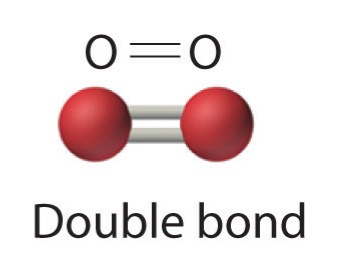
Спільне використання пари електронів являє собою єдиний ковалентний зв'язок, який зазвичай просто називають єдиним зв'язком. Однак у багатьох молекулах атоми досягають повних октетів, розділяючи між ними більше однієї пари електронів:
- Дві електронні пари розділили подвійний зв'язок
- Три пари електронів розділили потрійний зв'язок
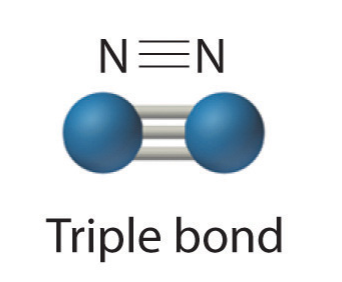
Оскільки кожен азот містить 5 валентних електронів, їм потрібно розділити 3 пари, щоб кожен досягти валентного октету. N 2 досить інертний, завдяки міцному потрійному зв'язку між двома атомами азоту.
Резюме
- Ковалентні зв'язки утворюються, коли атоми поділяють електрони.
- Електронні точкові діаграми Льюїса можуть бути намальовані для ілюстрації утворення ковалентного зв'язку.
- Подвійні зв'язки або потрійні зв'язки між атомами можуть знадобитися для правильної ілюстрації зв'язку в деяких молекулах.