4.5: Формули та назви бінарних іонних сполук
- Page ID
- 20488
- Скористайтеся правилами іменування іонних сполук.
- Напишіть правильну формулу для іонного з'єднання.
Назви бінарних іонних сполук
Дізнавшись ще кілька подробиць про назви окремих іонів, ви будете в кроці від знання того, як назвати іонні сполуки. У цьому розділі починається формальне вивчення номенклатури, систематичне найменування хімічних сполук.
Іони іменування
Назва одноатомного катіона - це просто назва елемента, за яким слідує слово іон. Таким чином, Na + - іон натрію, Al 3 + - іон алюмінію, Ca 2 + - іон кальцію тощо.
Ми бачили, що деякі елементи втрачають різну кількість електронів, виробляючи іони різних зарядів (рис. 4.4.1). Залізо, наприклад, може утворювати два катіони, кожен з яких при поєднанні з одним і тим же аніоном утворює різну сполуку з унікальними фізико-хімічними властивостями. Таким чином, нам потрібна інша назва для кожного іона заліза, щоб відрізнити Fe 2 + від Fe 3 +. Таке ж питання виникає і для інших іонів з більш ніж одним можливим зарядом.
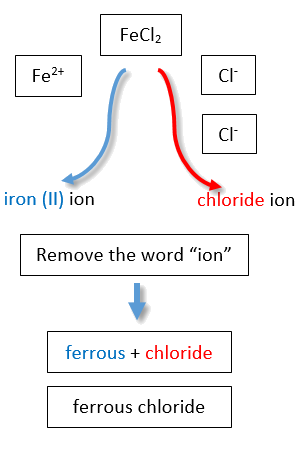
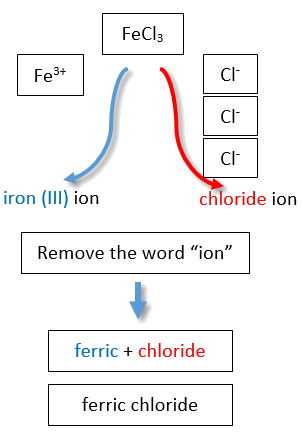
Існує два способи зробити це розмежування. У простішому, більш сучасному підході, званому системою Stock (Таблиця\(\PageIndex{1}\)), позитивний заряд іона позначається римською цифрою в дужках після назви елемента, за якою слідує слово ion. Таким чином, Fe 2 + називається іоном заліза (II), тоді як Fe 3 + називається іоном заліза (III). Ця система використовується тільки для елементів, які утворюють більше одного загального позитивного іона. Ми не називаємо іон Na + іоном натрію (I), оскільки (I) є непотрібним. Натрій утворює лише 1+ іон, тому неоднозначності щодо назви іона натрію немає.
| Елемент | Стебло | Заряджати |
Сучасна назва (Фондова система) |
Загальна назва |
|---|---|---|---|---|
| залізо | Ферр- | 2+ | іон заліза (II) | іон заліза |
| 3+ | іон заліза (III) | іон заліза | ||
| мідь | купр- | 1+ | іон міді (I) | мідний іон |
| 2+ | іон міді (II) | іон міді | ||
| олово | станн- | 2+ | олово (II) іон | олов'яний іон |
| 4+ | олово (IV) іон | олов'яний іон | ||
| свинець | схил- | 2+ | іон свинцю (II) | сантехнічний іон |
| 4+ | іон свинцю (IV) | слюсарний іон | ||
| хром | хром- | 2+ | іон хрому (II) | хромований іон |
| 3+ | іон хрому (III) | хром-іон | ||
| золото | аур- | 1+ | золото (I) іон | ауровий іон |
| 3+ | золото (III) іон | вушна іона |
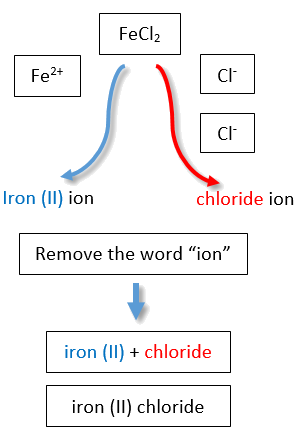
Друга система, яка називається загальною системою, не є звичайною, але все ще поширена і використовується в медичних науках. Ця система визнає, що багато металів мають два загальних катіона. Загальна система використовує два суфікси (- ic і - ous), які додаються до стебла імені елемента. Суфікс -ic представляє більший з двох катіонних зарядів, а -ous суфікс представляє нижній. У багатьох випадках стебло назви елемента походить від латинської назви елемента. У таблиці\(\PageIndex{1}\) перераховані елементи, які використовують загальну систему, а також їх відповідні імена катіонів.
| Іон | Ім'я |
|---|---|
| F − | іон фтору |
| Cl − | хлорид-іон |
| Br − | іон броміду |
| Я − | йодид іон |
| O 2− | оксид-іон |
| S 2− | сульфід-іон |
| P 3− | фосфід-іон |
| N 3− | нітрид-іон |
Назва одноатомного аніона складається з стебла назви елемента, суфікса - язь, а потім слова іон. Таким чином, як ми вже бачили, Cl − це «хлор-» + «-іон», або хлорид-іон. Аналогічно, O 2− це іон оксиду, Se 2 − іон селеніду тощо. У таблиці\(\PageIndex{2}\) наведено назви деяких поширених одноатомних іонів.
Назвіть кожен іон.
- Са 2 +
- S 2−
- Cu +
Рішення
- іон кальцію
- сульфідний іон
- іон міді (I) або іон міді
Назвіть кожен іон.
- Фе 2 +
- Фе 3 +
- Ба 2 +
- Відповідь a:
- іон заліза (II)
- Відповідь б:
- іон заліза (III)
- Відповідь c:
- іон барію
Напишіть формулу для кожного іона.
- іон броміду
- іон міді
- іон магнію
Рішення
- Br −
- Cu 2 +
- Мг 2 +
Напишіть формулу для кожного іона.
- іон фтору
- олов'яний іон
- іон калію
- Відповідь a:
- F -
- Відповідь б:
- Нд 2+
- Відповідь c:
- К +
Іменування бінарних іонних сполук з металом, який утворює лише один тип катіону
Тепер, коли ми знаємо, як називати іони, ми готові назвати іонні сполуки. Бінарна іонна сполука - це сполука, що складається з одноатомного катіона металу та одноатомного неметалічного аніону. Спочатку названий катіон металу, а потім неметалевий аніон, як показано на малюнку\(\PageIndex{1}\) для з'єднання BaCl 2. Слово іон скидається з обох частин.
Індекси в формулі не впливають на назву.
Назвіть кожне іонне з'єднання.
- CaCl 2
- ЛаФ 3
- KCl
Рішення
- Використовуючи назви іонів, це іонне з'єднання називається хлоридом кальцію.
- Назва цього іонного з'єднання - фторид алюмінію.
- Назва цього іонного з'єднання - хлорид калію.
Назвіть кожне іонне з'єднання.
- AGI
- MgO
- Каб 3 П 2
- Відповідь a:
- йодид срібла
- Відповідь б:
- оксид магнію
- Відповідь c:
- фосфід кальцію
Іменування бінарних іонних сполук з металом, який утворює більше одного типу катіонів
Якщо вам дана формула іонного з'єднання, катіон якого може мати більше одного можливого заряду, необхідно спочатку визначити заряд на катіоні, перш ніж визначити його правильну назву. Для прикладу розглянемо FeCl 2 і FeCl 3. У першій сполуці іон заліза має заряд 2+, оскільки у формулі є два іони Cl − (1− заряд на кожному хлоридному іоні). У другій сполуці іон заліза має заряд 3+, про що вказують три іони Cl − у формулі. Це два різних сполуки, які потребують двох різних назв. За системою Stock назви - хлорид заліза (II) і хлорид заліза (III) (рис.\(\PageIndex{2}\)).
| Назва катіону (метал) + (Римська цифра в дужках) + Базова назва аніону (неметалу) та -ide | |
|---|---|
 |
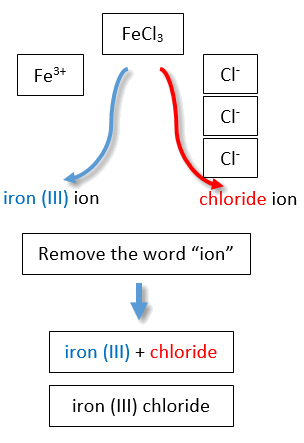 |
Якби ми використовували стебла і суфікси загальної системи, назви були б хлорид заліза і хлорид заліза відповідно (рис.\(\PageIndex{3}\)).
| «Стара» базова назва катіону (металу) та -ic або -ous + Базова назва аніону (неметалу) та -ide | |
|---|---|
|
-ous (для іонів з меншим зарядом)
|
-ic (для іонів з більш високим зарядом)
|
Назвіть кожне іонне з'єднання.
- СО 2 О 3
- FeCl 2
Рішення
| Іонна сполука | Пояснення | Відповідь |
|---|---|---|
| СО 2 О 3 |
Ми знаємо, що кобальт може мати більше одного можливого заряду; нам просто потрібно визначити, що це таке.
|
оксид кобальту (III) |
| FeCl 2 |
Залізо також може мати більше одного можливого заряду.
|
хлорид заліза (II) |
Назвіть кожне іонне з'єднання.
- AUCl 3
- ПБО 2
- КуО
- Відповідь a:
- хлорид золота (III)
- Відповідь б:
- оксид свинцю (IV)
- Відповідь c:
- оксид міді (II)
Малюнок\(\PageIndex{4}\) являє собою конспект того, як назвати прості іонні сполуки.

Назвіть кожне іонне з'єднання.
- ЗнБр 2
- Всі 2 з 3
- АуФ 3
- АГФ
- Відповідь a:
- бромід цинку
- Відповідь б:
- оксид алюмінію
- Відповідь c:
- фторид золота (III) або фторид аури
- Відповідь d:
- фторид срібла
Написання формул іонних сполук
Іонні сполуки не існують як молекули. У твердому стані іонні сполуки знаходяться в кристалічній решітці, що містить багато іонів кожен з катіонів і аніону. Іонна формула, як\(\ce{NaCl}\), є емпіричною формулою. Ця формула лише вказує на те, що хлорид натрію виготовлений з рівної кількості іонів натрію і хлориду. Сульфід натрію, інша іонна сполука, має формулу\(\ce{Na_2S}\). Ця формула вказує на те, що ця сполука складається з удвічі більшої кількості іонів натрію, ніж іони сульфіду. Цей розділ навчить вас знаходити правильне співвідношення іонів, щоб ви могли написати правильну формулу.
Якщо ви знаєте назву бінарного іонного з'єднання, можна написати його хімічну формулу. Почніть з запису іона металу з його зарядом, а потім неметалевий іон з його зарядом. Оскільки загальна сполука повинна бути електрично нейтральною, вирішіть, скільки кожного іона потрібно для того, щоб позитивний і негативний заряд скасував один одного.
Напишіть формулу нітриду алюмінію і оксиду літію.
Рішення
| Кроки для вирішення проблем | Напишіть формулу нітриду алюмінію | Напишіть формулу для оксиду літію |
|---|---|---|
| 1. Напишіть символ і заряд катіона (металу) першого і аніона (неметалічного) другого. | \(\ce{Al^{3+}} \: \: \: \: \: \ce{N^{3-}}\) | \(\ce{Li^+} \: \: \: \: \: \ce{O^{2-}}\) |
| 2. Використовуйте множник, щоб загальний заряд катіонів і аніонів дорівнював один одному. |
загальний заряд катіонів = загальний заряд аніонів 1 (3+) = 1 (3-) +3 = -3 |
загальний заряд катіонів = загальний заряд аніонів 2 (1+) = 1 (2-) +2 = -2 |
| 3. Використовуйте мультиплікатори як індекс для кожного іона. | \(\ce{Al_1N_1}\) | \(\ce{Li_2O_1}\) |
| 4. Напишіть остаточну формулу. Залиште всі збори та всі індекси, які є 1. | \(\ce{AlN}\) | \(\ce{Li_2O}\) |
Альтернативним способом написання правильної формули для іонного з'єднання є використання перехресного методу. У цьому методі числове значення кожного із зарядів іонів перетинається, щоб стати індексом іншого іона. Ознаки звинувачення скинуті.
Напишіть формулу для оксиду свинцю (IV).
Рішення
| Метод перехресного хреста | Приклад: Напишіть формулу для оксиду свинцю (IV) |
|---|---|
| 1. Напишіть символ і заряд катіона (металу) першого і аніона (неметалічного) другого. | \(\ce{Pb^{4+}} \: \: \: \: \: \ce{O^{2-}}\) |
| 2. Транспонуйте лише число позитивного заряду, щоб стати індексом аніону, і номер лише негативного заряду, щоб стати індексом катіону. | 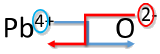 |
| 3. Зменшити до найнижчого співвідношення. | \(\ce{Pb_2O_4}\) |
| 4. Напишіть остаточну формулу. Залиште всі індекси, які є 1. | \(\ce{PbO_2}\) |
Напишіть хімічну формулу для іонної сполуки, що складається з кожної пари іонів.
- іон кальцію та іон кисню
- іон міді 2+ та іон сірки
- іон міді 1+ та іон сірки
- Відповідь a:
- СаО
- Відповідь б:
- CU
- Відповідь c:
- Куб 2 S
Майте на увазі, що іонні сполуки є емпіричними формулами, і тому повинні бути записані як найнижче співвідношення іонів.
Напишіть формулу натрію в поєднанні з сіркою.
Рішення
| Метод перехресного хреста | Напишіть формулу натрію в поєднанні з сіркою |
|---|---|
| 1. Напишіть символ і заряд катіона (металу) першого і аніона (неметалічного) другого. | \(\ce{Na^{+}} \: \: \: \: \: \ce{S^{2-}}\) |
| 2. Транспонуйте лише число позитивного заряду, щоб стати індексом аніону, і номер лише негативного заряду, щоб стати індексом катіону. | 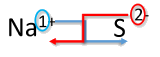 |
| 3. Зменшити до найнижчого співвідношення. | Цей крок необов'язковий. |
| 4. Напишіть остаточну формулу. Залиште всі індекси, які є 1. | \(\ce{Na_2S}\) |
Напишіть формулу для кожного іонного з'єднання.
- бромід натрію
- хлорид літію
- оксид магнію
- Відповідь a:
- NaBr
- Відповідь б:
- LicL
- Відповідь c:
- MgO
Розпізнавання іонних сполук
Існує два способи розпізнавання іонних сполук. По-перше, з'єднання між металевими і неметалевими елементами зазвичай є іонними. Наприклад, CaBR 2 містить металевий елемент (кальцій, метал 2 групи (або 2А)) і неметалічний елемент (бром, група 17 (або 7А) неметал). Тому це, швидше за все, іонне з'єднання. (Насправді він іонний.) На відміну від цього, з'єднання NO 2 містить два елементи, які є одночасно неметалами (азот, з групи 15 (або 5А), і кисень, з групи 16 (або 6А). Це не іонна сполука; вона відноситься до категорії ковалентних сполук, обговорюваних в інших місцях. Також зверніть увагу, що ця комбінація азоту та кисню не має електричного заряду, тому це не іон нітриту.
По-друге, якщо розпізнати формулу багатоатомного іона в з'єднанні, з'єднання є іонним. Наприклад, якщо ви бачите формулу Ba (NO 3) 2, ви можете розпізнати частину «NO 3» як нітратний іон, NO 3 −. (Пам'ятайте, що умовність написання формул для іонних сполук полягає не в тому, щоб включати іонний заряд.) Це підказка, що інша частина формули, Ba, насправді є іоном Ba 2 +, а заряд 2+ врівноважує загальний 2− заряд від двох нітратних іонів. Таким чином, це з'єднання також є іонним.
Визначте кожну сполуку як іонну чи не іонну.
- Na 2 О
- пКл 3
- З 2
Рішення
| Пояснення | Відповідь |
|---|---|
| а Натрій - метал, а кисень - неметал. Тому очікується, що Na 2 O буде іонним. | \(Na_2O\), іонні |
| б І фосфор, і хлор є неметалами. Тому pCl 3 не є іонним. | \(PCl_3\), не іонні |
| c І кисень, і фтор є неметалами. Тому ОФ 2 не є іонним. | \(OF_2\), іонні |
Визначте кожну сполуку як іонну чи не іонну.
- N 2 О
- FeCl 3
- Відповідь a:
- не іонні
- Відповідь б:
- іонний
Резюме
- Іонні сполуки називаються, вказавши спочатку катіон, а потім аніон.
- Позитивні і негативні заряди повинні балансувати.
- Деякі аніони мають кілька форм і названі відповідно з використанням римських цифр в дужках.
- Формули для іонних сполук містять символи та кількість кожного атома, присутнього в з'єднанні, в найменшому цілому співвідношенні чисел.