4.2: Символи Льюїса (Електронно-крапка)
- Page ID
- 20510
- Намалюйте електронну точкову діаграму Льюїса для атома.
- Знайте важливість точки Льюїса в склеюванні.
На початку 20-го століття американський фізичний хімік Г.Н. Льюїс (1875—1946) розробив систему символів, які тепер називаються електронними крапковими символами Льюїса (часто скорочені до символів точки Льюїса), які можуть бути використані для прогнозування кількості зв'язків, утворених більшістю елементів. в їх з'єднаннях.

- зручне подання валентних електронів
- дозволяє вченим відстежувати валентні електрони при утворенні зв'язків
- складається з атомного символу елемента плюс точка для кожного валентного електрона
Щоб написати символ точки Льюїса елемента, ми розміщуємо точки, що представляють його валентні електрони, по одному, навколо хімічного символу елемента. Вгорі, знизу, ліворуч і праворуч від символу розміщуються до чотирьох точок (в будь-якому порядку, доки елементи з чотирма або меншими валентними електронами мають не більше однієї точки в кожній позиції). Наступні точки, для елементів з більш ніж чотирма валентними електронами, знову розподіляються по одній, кожна в парі з одним з перших чотирьох. Наприклад, елемент сірка має шість валентних електронів (зверніть увагу на римську цифру над групою в таблиці Менделєєва), а його символ Льюїса буде:
Фтор, наприклад, має сім валентних електронів, тому його символ точки Льюїса будується наступним чином:
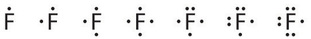
Зрештою Льюїс опублікував свою теорію хімічного зв'язку в 1916. Освіта хімічних зв'язків для завершення потреби восьми електронів для атома стає природною тенденцією. Для ілюстрації цього моменту тут наведені точкові символи Льюїса перших двох періодів. По суті, вся група (стовпець) елементів мають однакові точечні символи Льюїса, тому що вони мають однакову кількість валентних електронів.
Пройшовши періодичну таблицю, ми бачимо, що електронні точечні символи атомів Льюїса ніколи не матимуть більше восьми точок навколо атомного символу див\(\PageIndex{1}\). Таблицю.
| \(\ce{H\cdot}\) | \(\textrm{He:}\) | ||||||
|---|---|---|---|---|---|---|---|
\(\underset{\:}{\ce{Li\cdot}}\) |
\(\underset{\:}{\ce{\cdot Be \cdot}}\) |
\ (\ ce { \ c точка\ нижня {\:} {\ витіс {\ Large {\ cdot}} {B}}\ cdot} \ cdot}\) |
\ (\ ce { \ cdot \ нижній {\ великий {\ cdot}} {\ витіс {\ великий {\ cdot}} {C}\ cdot} \ cdot}\) |
\ ( \ нижня {\ Large {\ dot\,}} {\ витіс {\ Large {\ cdot}} {\ textrm {:N}\ cdot} \) |
\ ( \ нижня {\ Large {\ dot\ dot\,}} {\ витіс {\ Large {\ cdot}} {\ textrm {:O}\ dot} \) |
\ ( \ нижня {\ Large {\ dot\ dot}} {\ витіс {\ великий {\ dot\ dot}} {\ textrm {:F}\ cdot} \) |
\ ( \ нижня {\ Large {\ dot\ dot}} {\ витіс {\ Великий {\ dot\ dot}} {\ textrm {:Ne:}} \) |
| \(\ce{Na}\) \(\ce{K}\) \(\ce{Rb}\) \(\ce{Cs}\) |
\(\ce{Mg}\) \(\ce{Ca}\) \(\ce{Sr}\) \(\ce{Ba}\) |
\(\ce{Al}\) \(\ce{Ga}\) \(\ce{In}\) \(\ce{Tl}\) |
\(\ce{Si}\) \(\ce{Ge}\) \(\ce{Sn}\) \(\ce{Pb}\) |
\(\ce{P}\) \(\ce{As}\) \(\ce{Sb}\) \(\ce{Bi}\) |
\(\ce{S}\) \(\ce{Se}\) \(\ce{Te}\) \(\ce{Po}\) |
\(\ce{Cl}\) \(\ce{Br}\) \(\ce{I}\) \(\ce{At}\) |
\(\ce{Ar}\) \(\ce{Kr}\) \(\ce{At}\) \(\ce{Rn}\) |
Що таке електронна точкова діаграма Льюїса для кожного елемента?
- алюміній
- селену
Рішення
- Валентна електронна конфігурація для алюмінію становить 3 s 2 3 p 1. Таким чином, він матиме три точки навколо символу для алюмінію, дві з них спарені, щоб представляти 3 s електронів:
\[\dot{Al:} \nonumber \]
- Валентна електронна конфігурація для селену становить 4 s 2 4 p 4. У оболонці з найвищим номером, оболонці n = 4, знаходиться шість електронів. Його електронна точкова діаграма виглядає наступним чином:
\[\mathbf{\cdot }\mathbf{\dot{\underset{.\: .}Se}}\mathbf{:} \nonumber \]
Що таке електронна точкова діаграма Льюїса для кожного елемента?
- фосфор
- аргон
- Відповідь
-
\[\mathbf{\cdot }\mathbf{\dot{\underset{.}P}}\mathbf{:} \nonumber \]
- Відповідь б
-
\[\mathbf{:}\mathbf{\ddot{\underset{.\, .}Ar}}\mathbf{:} \nonumber \]
Резюме
- Електронні точкові діаграми Льюїса використовують точки для представлення валентних електронів навколо атомного символу.
- Символи точки Льюїса можуть бути використані для прогнозування кількості зв'язків, утворених елементами в з'єднанні.