4.1: Мистецтво дедукції - стабільні електронні конфігурації
- Визначте правило октету.
Правило октету - це хімічне правило, яке відображає спостереження за тим, що елементи мають тенденцію зв'язуватися таким чином, що кожен атом має вісім електронів у своїй валентній оболонці, надаючи йому ту саму електронну конфігурацію, що і благородний газ.
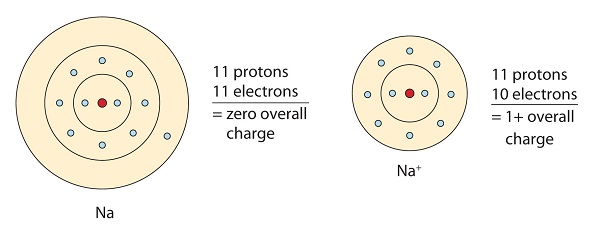
Посилаючись на правило октета, атоми намагаються отримати електронну конфігурацію благородного газу, яка становить вісім валентних електронів. Метали мають мало електронів у своїх крайніх орбіталах. Втрачаючи ці електрони, ці метали можуть досягти конфігурації благородного газу і задовольнити правило октету. Натрій має один валентний електрон, тому відмова від нього призведе до тієї ж конфігурації електронів, що і неон. Внаслідок втрати електрона утворюється позитивно заряджений катіон (Na +), званий іоном натрію.
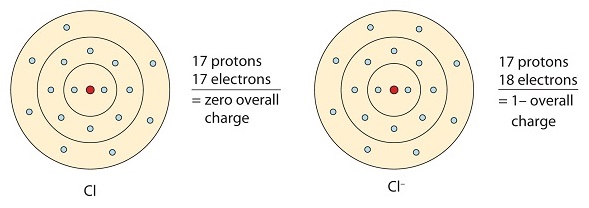
Аналогічно, неметали, які мають близько 8 електронів у своїх валентних оболонках, як правило, легко приймають електрони для досягнення конфігурації благородного газу. Хлор має сім валентних електронів, тому, якщо він візьме один, він матиме вісім (октет). Хлор має електронну конфігурацію аргону, коли він отримує електрон. Отриманий іон (Cl -) називається хлорид-іоном.
Правило октету могло б бути задоволено, якби хлор відмовився від усіх семи своїх валентних електронів і натрій забрав їх. У такому випадку обидва матимуть електронні конфігурації благородних газів з повною валентною оболонкою. Однак їх звинувачення були б набагато вище. Це був би Na 7 - і Cl 7 +, який набагато менш стійкий, ніж Na + і Cl -. Атоми більш стабільні, коли у них немає заряду, або невеликого заряду.
Резюме
Правило октету посилається на тенденцію атомів віддавати перевагу мати вісім електронів у валентній оболонці.
Дописувач
Органічна хімія Додаткова модулі_Модулі_ (Органіка_Хімія) /Фундаменталі/Іонічні_і_ковалент_Облігації