3.6: Розташування електронів - модель Бора (орбіти)
- Знати властивості різних видів електромагнітного випромінювання.
- Визначте рівень енергії з точки зору моделі Бора.
- Обговоріть, як модель Бора може бути використана для пояснення атомних спектрів.
- Опишіть розташування електронів за допомогою моделі оболонки.
Електромагнітні хвилі мають надзвичайно широкий діапазон довжин хвиль, частот та енергій. Найвищою енергетичною формою електромагнітних хвиль є гамма (γ) промені, а найнижча енергетична форма - радіохвилі.
На малюнку нижче показаний електромагнітний спектр, який представляє собою всі форми електромагнітного випромінювання. На крайньому лівому куті малюнка\PageIndex{1} розташовані електромагнітні хвилі найвищої енергії. Вони називаються гамма-променями і можуть бути досить небезпечними, у великій кількості, для живих систем. Наступна нижча енергетична форма електромагнітних хвиль називається рентгенівськими променями. Більшості з вас знайомі здібності проникнення цих хвиль. Вони також можуть бути небезпечні для живих систем. Людям рекомендується максимально обмежити кількість медичних рентгенівських променів, які вони мають на рік. Далі нижче, за енергією, знаходяться ультрафіолетові промені. Ці промені є частиною сонячного світла, і верхній кінець ультрафіолетового діапазону може спричинити сонячні опіки і, можливо, рак шкіри. Крихітний розділ поруч у спектрі - це видимий діапазон світла... цей розділ був значно розширений у нижній половині малюнка, щоб його можна було обговорити більш детально. Видимий діапазон електромагнітного випромінювання - це частоти, на які реагує людське око. Нижче в спектрі знаходяться інфрачервоні промені і радіохвилі.
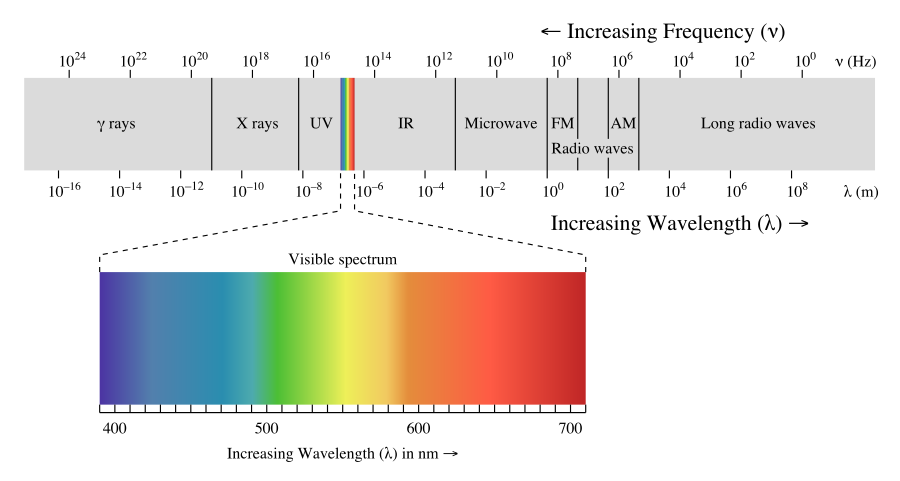
Енергії світла, які знаходяться у видимому діапазоні, - це електромагнітні хвилі, які змушують людське око реагувати, коли ці частоти потрапляють в око. Око посилає сигнал в мозок і індивід «бачить» різні кольори. Найвищі енергетичні хвилі у видимій області змушують мозок бачити фіолетовий, і коли енергія зменшується, кольори змінюються на синій, зелений, жовтий, помаранчевий та червоний. Коли енергія хвилі знаходиться вище або нижче видимого діапазону, око не реагує на них. Коли око отримує кілька різних частот одночасно, кольори змішуються мозком. Якщо всі частоти світла вдаряють в око разом, мозок бачить білий колір і якщо немає видимих частот, що вражають око, мозок бачить чорний колір. Предмети, які ви бачите навколо себе, є поглиначами світла - тобто хімічні речовини на поверхні об'єкта будуть поглинати певні частоти, а не інші. Ваші очі виявляють частоти, які потрапляють в очі. Тому, якщо ваш друг носить червону сорочку, це означає, що барвник у цій сорочці поглинає кожну частоту, крім червоного, а червоні частоти відображаються. Якби вашим єдиним джерелом світла була одна точна частота синього світла, і ви сяяли його на сорочці, яка була червоною при сонячному світлі, сорочка виглядала б чорною, тому що жодне світло не відбивалося б. Світло від люмінесцентних типів вогнів не містить усіх частот сонячного світла, тому одяг всередині магазину може здатися дещо іншим кольором, ніж коли ви отримуєте їх додому.
Безперервні та лінійні спектри
Електричні лампочки містять в собі дуже тонкий провід, який випромінює світло при нагріванні. Провід називається ниткою розжарювання. Особливий провід, який використовується в лампочках, виготовлений з вольфраму. Дріт з будь-якого металу буде випромінювати світло за цих обставин, але вольфрам був обраний, оскільки світло, яке він випромінює, містить практично кожну частоту, і, отже, світло, що випромінюється вольфрамом, виглядає білим. Дріт, виготовлений з якогось іншого елемента, випромінював би світло якогось кольору, який не був зручним для нашого використання. Кожен елемент випромінює світло під напругою нагрівання або пропускання через нього електричного струму. Елементи в твердому вигляді починають світитися при достатньому нагріванні і елементи в газоподібному вигляді випромінюють світло при проходженні через них електрики. Це джерело світла, що випромінюється неоновими вивісками, а також є джерелом світла в пожежі.

Кожен елемент має унікальний спектр
Світлові частоти, випромінювані атомами, змішуються нашими очима, так що ми бачимо змішаний колір. Кілька фізиків, включаючи Ангстрема в 1868 році та Бальмера в 1875 році, передали світло від атомів під напругою через скляні призми таким чином, що світло поширювалося, щоб вони могли бачити окремі частоти, що складають світло. Спектр випромінювання (або атомний спектр) хімічного елемента - це унікальна картина світла, що отримується, коли елемент піддається впливу тепла або електрики.

Коли водневий газ поміщають в трубку і пропускають через неї електричний струм, колір випромінюваного світла - рожевий. Але коли колір поширюється, ми бачимо, що водневий спектр складається з чотирьох окремих частот. Рожевий колір трубки є результатом того, що наші очі змішують чотири кольори. Кожен атом має свій характерний спектр; немає двох атомних спектрів однакових. На зображенні нижче показаний спектр випромінювання заліза. Оскільки кожен елемент має унікальний спектр випромінювання, елементи можуть бути визначені за допомогою них.
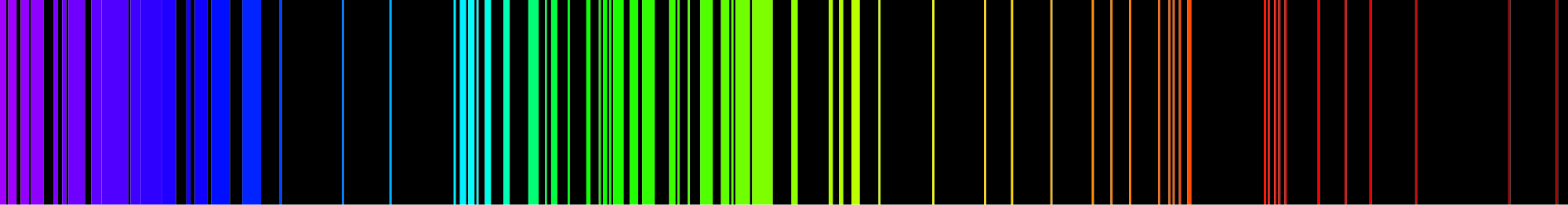
Можливо, ви чули або читали про вчених, які обговорювали, які елементи присутні на сонці або якомусь більш далекому зорі, і почувши це, замислювалися, як вчені могли знати, які елементи присутні в місці, де ніхто ніколи не був. Вчені визначають, які елементи присутні в далеких зірках, аналізуючи світло, що надходить від зірок, і знаходячи атомний спектр елементів у цьому світлі. Якщо точні чотири лінії, що складають атомний спектр водню, присутні у світлі, що випромінюється зіркою, цей елемент містить водень.
Пояснення Бора лінійних спектрів
У 1913 році датський фізик Нільс Бор запропонував модель електронної хмари атома, в якій електрони обертаються навколо ядра і змогли виробляти атомні спектри. Розуміння моделі Бора вимагає певних знань про електромагнітне випромінювання (або світло). Ключова ідея Бора в його моделі атома полягає в тому, що електрони займають певні орбіталі, які вимагають від електрона певної кількості енергії. Для того щоб електрон опинився в електронній хмарі атома, він повинен знаходитися в

одна з допустимих орбіталей, і вона повинна мати точну енергію, необхідну для цієї орбіти. Орбіти ближче до ядра потребують меншої кількості енергії для електрона, а орбіти далі від ядра вимагатимуть від електронів більшої кількості енергії. Можливі орбіти відомі як енергетичні рівні (n). Однією з слабких сторін моделі Бора було те, що він не міг запропонувати причину, чому допускалися лише певні енергетичні рівні або орбіти.
Ілюстрація\PageIndex{5}: Нільс Бор з Альбертом Ейнштейном у будинку Поля Еренфеста в Лейдені (грудень 1925).

Бор висував гіпотезу, що єдиним способом електрони можуть отримати або втратити енергію, буде перехід від одного енергетичного рівня до іншого, таким чином отримуючи або втрачаючи точну кількість енергії. Рівні енергії квантуються, що означає, що можливі лише конкретні кількості. Вона була б схожа на сходи, які мали сходинки тільки на певній висоті. Єдиний спосіб, яким ви можете бути на цій драбині, - це бути на одній із ступенів, і єдиний спосіб, яким ви могли б рухатися вгору або вниз, - це перейти до однієї з інших ступенів. Припустимо, у нас була така сходи з 10 ступенями. Інші правила для сходів полягають у тому, що тільки одна людина може перебувати на сходинці в нормальному стані, а мешканці сходів повинні знаходитися на найнижчій доступній щаблі. Якби сходи мали на ній п'ять чоловік, вони були б на найнижчих п'яти ступенях. У цій ситуації жодна людина не могла зрушити вниз, оскільки всі нижні ступені заповнені. Бор розробив правила для максимальної кількості електронів, які могли бути на кожному енергетичному рівні в своїй моделі, і вимагав, щоб атом у своєму нормальному стані (наземному стані) мав усі електрони в найнижчих енергетичних рівнях. За цих обставин жоден електрон не міг втратити енергію, оскільки жоден електрон не міг рухатися вниз до нижчого рівня енергії. Таким чином модель Бора пояснювала, чому електрони, що кружляють ядро, не випромінюють енергію і спіраль в ядро.
\PageIndex{6}Малюнок Рівні енергії (n= 1,2,3...) електронів можна розглядати як сходинки на сходах.
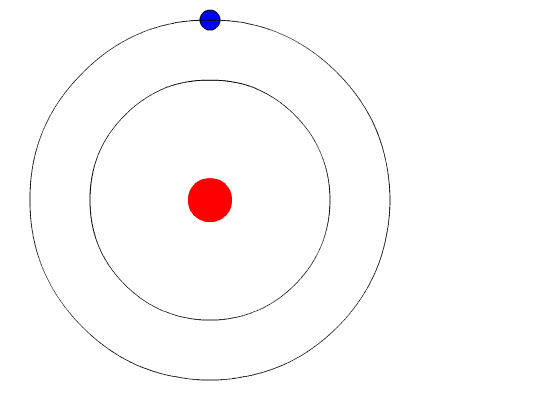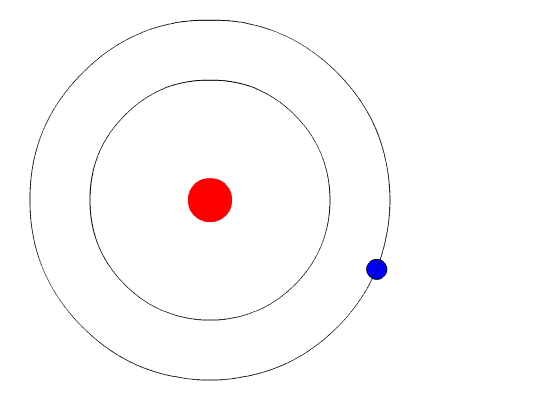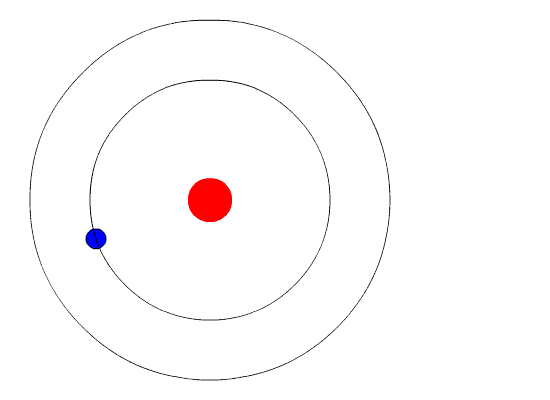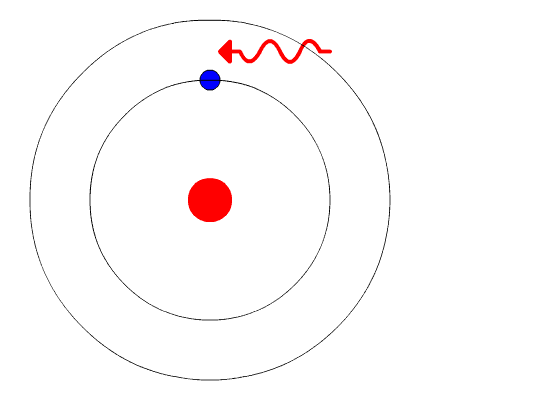
Докази, що використовуються для підтримки моделі Бора, надходили з атомних спектрів. Він припустив, що атомний спектр утворюється електронами в атомі, що рухаються енергетичними рівнями.
Наземні держави та збуджені держави
Електрони, як правило, мають найменшу можливу енергію, звану наземним станом. Якщо електронам дається енергія (через тепло, електрику, світло тощо), електрони в атомі можуть поглинати енергію, переходячи на більш високий енергетичний рівень або збуджений стан. Потім електрони виділяють енергію у вигляді шматочка світла, званого фотоном, вони поглинулися, щоб повернутися до нижчого енергетичного рівня. Енергія, що випромінюється електронами, що падають назад до нижчих рівнів енергії, завжди була б точною кількістю енергії, оскільки відмінності в рівнях енергії були точними. Це пояснює, чому ви бачите конкретні лінії світла, дивлячись на атомний спектр - кожна лінія світла відповідає певному «кроку вниз», який електрон може прийняти в цьому атомі. Це також пояснює, чому кожен елемент виробляє різний атомний спектр. Оскільки кожен елемент має різні прийнятні енергетичні рівні для своїх електронів, можливі кроки, які можуть приймати електрони кожного елемента, відрізняються від усіх інших елементів.
Виходячи з довжин хвиль спектральних ліній, Бор зміг обчислити енергії, які матиме електрон водню в кожному з дозволених енергетичних рівнів. Потім він математично показав, які переходи енергетичного рівня відповідають спектральним лініям в спектрі атомного випромінювання (див. Нижче).
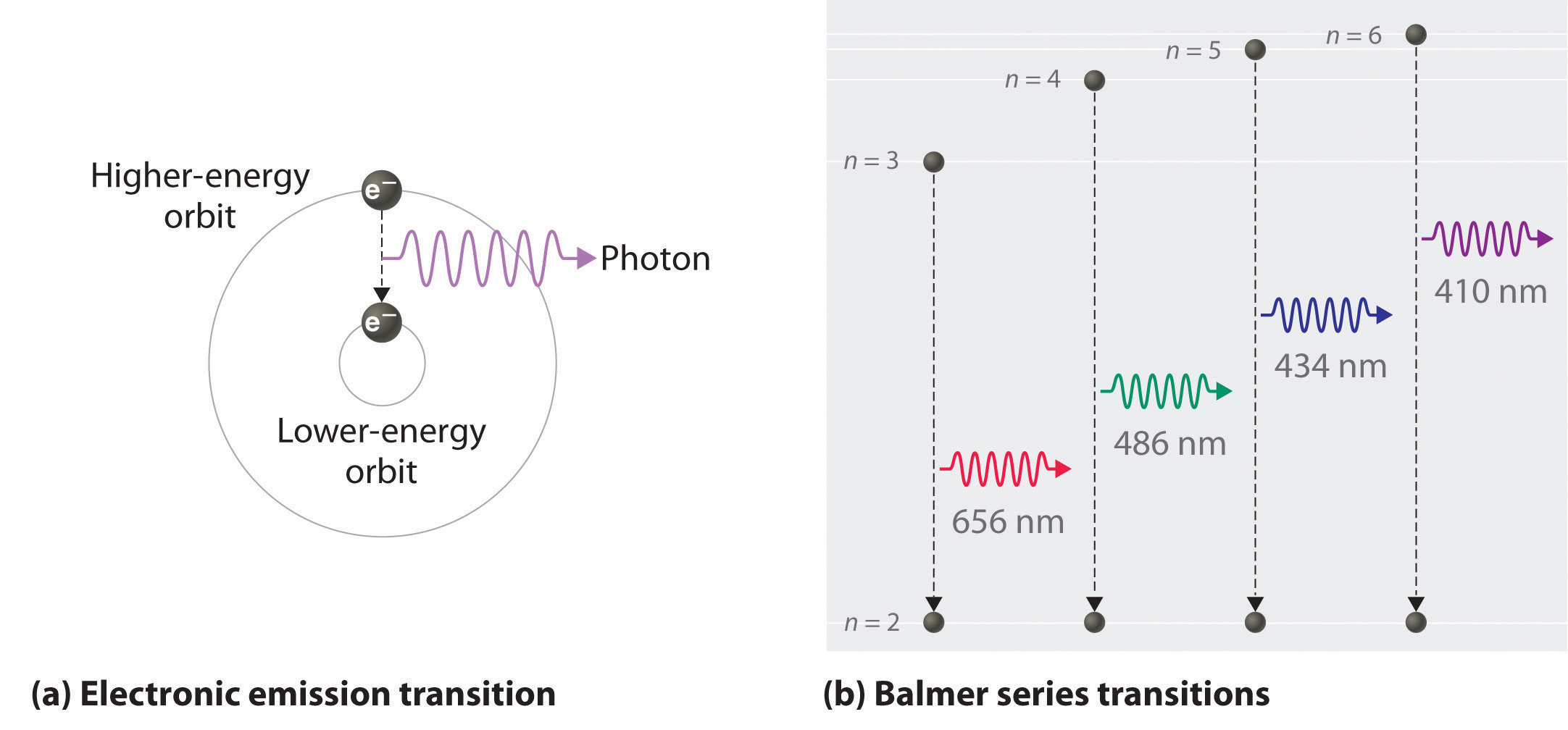
Він виявив, що чотири видимі спектральні лінії відповідають переходам від вищих енергетичних рівнів до другого енергетичного рівня\left( n=2 \right). Це називається серією Бальмера (рис.\PageIndex{8} ). Переходи, що закінчуються в основному стані,\left( n=1 \right) називаються рядами Лимана, але виділяються енергії настільки великі, що спектральні лінії все знаходяться в ультрафіолетовій області спектра. Переходи, які називаються серіями Пашена та серіями Брекетта, призводять до спектральних ліній в інфрачервоній області, оскільки енергії занадто малі.
Модель Бора мала величезний успіх у поясненні спектра атома водню. На жаль, коли математика моделі застосовувалася до атомів з більш ніж одним електроном, вона не змогла правильно передбачити частоти спектральних ліній. Хоча модель Бора представляла собою великий прогрес в атомній моделі, і концепція електронних переходів між енергетичними рівнями є дійсною, необхідні були вдосконалення для того, щоб повністю зрозуміти всі атоми та їх хімічну поведінку.
Різні металеві електрони випромінюють різні довжини хвиль світла, щоб повернутися до відповідних наземних станів, тому кольори полум'я різноманітні. Ці полум'я можуть бути використані для отримання спектрів атомних викидів спалених елементів. Використовуючи відомі значення спектрів випромінювання, можна провести випробування полум'я на невідомому речовині, зібрати з нього спектр випромінювання і визначити, які елементи знаходяться в невідомій речовині.
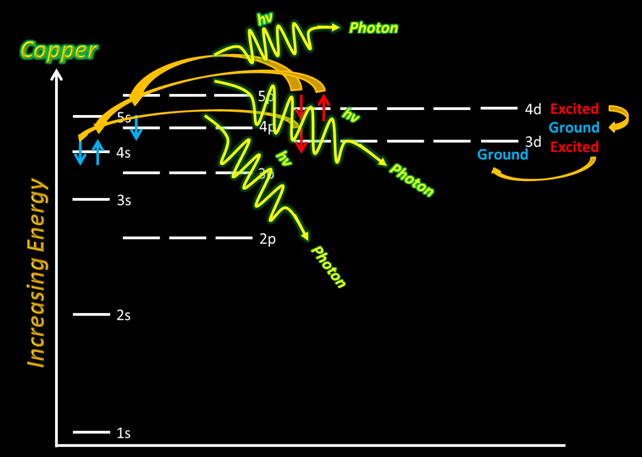
Наприклад, у випадку з іоном міді існує кілька різних «шляхів», за якими можуть слідувати збуджені електрони, щоб випромінювати фотон певної дискретної енергії. Це створює кілька спектральних ліній, оскільки кожна різниця дискретних енергетичних рівнів дасть певну довжину хвилі світла, яка визначає колір.

Будівельні атоми: основні оболонки
Електронна оболонка - це зовнішня частина атома навколо атомного ядра. Це група атомних орбіталей з однаковим значенням основного квантового числаn. Електронні оболонки мають одну або кілька електронних підоболонок, або підрівнів. Назва електронних оболонок походить від моделі Бора, в якій групи електронів, як вважалося, обходять ядро на певних відстанях, так що їх орбіти утворювали «оболонки».
Електронна оболонка може розглядатися як орбіта, за якою слідують електрони навколо атомного ядра. Оскільки кожна оболонка може містити лише фіксовану кількість електронів, кожна оболонка пов'язана з певним діапазоном енергії електронів, і, таким чином, кожна оболонка повинна заповнити повністю, перш ніж електрони можуть бути додані до зовнішньої оболонки. Електрони в зовнішній оболонці визначають хімічні властивості атома (див. Валентна оболонка). Пояснення того, чому електрони існують в цих оболонках, див. Електронна конфігурація.

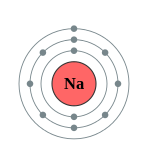
\PageIndex{10}Рисунок Діаграма оболонки літію (зліва) та натрію (праворуч)
Електронні оболонки позначені K, L, M, N, O, P і Q; або 1, 2, 3, 4, 5, 6 і 7; йдуть від самої внутрішньої оболонки назовні. Електрони в зовнішніх оболонках мають вищу середню енергію і рухаються далі від ядра, ніж у внутрішніх оболонках. Це робить їх більш важливими при визначенні того, як атом реагує хімічно і поводиться як провідник, оскільки тяга ядра атома на них слабкіше і легше порушується. Таким чином, реакційна здатність даного елемента сильно залежить від його електронної конфігурації.
Відео \PageIndex{1}Як намалювати модель раковини для сірки.
Примітка: Кількість електронів, які можуть займати кожен енергетичний рівень: 2 (перший рівень), 8 (2-й рівень), 18 (3-й рівень) і 32 (4-й рівень) на основі формули: # електронів = 2 (n) 2, де n = принциповий енергетичний рівень.
Таблиця\PageIndex{1} показує кількість електронів, які заповнюють кожну оболонку для нейтральних атомів декількох елементів. Як вже говорилося раніше, спочатку заповнюється сама внутрішня оболонка (відповідна найнижчій енергії) і в кожній оболонці допускається тільки фіксована кількість електронів. Єдиний електрон у водні (Z = 1) йде до першої оболонки. В атомі літію (Z = 3) два електрони заповнюють першу оболонку, а третій електрон переходить до другої оболонки. Атом аргону (Z = 18) має 18 електронів. 10 електронів заповнюють першу і другу оболонки, а решта 8 електронів йдуть в третю оболонку. Конфігурація електронів для елементів прохідного аргону більш детально розглядається в розділі 3.7.
|
Елемент Символ |
Атомний номер* (З) |
Перша оболонка н=1 (Дозволено 2 електрони) |
Друга оболонка н=2 (Дозволено 8 електронів) |
Третя оболонка н=3 (18 електронів дозволено) |
|---|---|---|---|---|
| Ч | 1 | 1 | ||
| Він | 2 | 2 | ||
| C | 6 | 2 | 4 | |
| П | 7 | 2 | 5 | |
| Na | 11 | 2 | 8 | 1 |
| Мг | 12 | 2 | 8 | 2 |
| Cl | 17 | 2 | 8 | 7 |
| Ар | 18 | 2 | 8 | 8 |
Примітка: * У нейтральному атомі кількість протонів дорівнює кількості електронів.
Резюме
- Електромагнітне випромінювання має широкий спектр, включаючи гамма-промені, рентгенівські промені, УФ-промені, видиме світло, ІЧ-випромінювання, мікрохвильові хвилі та радіохвилі.
- Різні кольори світла відрізняються за своїми частотами (або довжинами хвиль).
- Модель Бора передбачає, що кожен атом має набір незмінних енергетичних рівнів, а електрони в електронній хмарі цього атома повинні знаходитися на одному з цих енергетичних рівнів.
- Модель Бора передбачає, що атомні спектри атомів виробляються електронами, які отримують енергію з якогось джерела, підстрибуючи до більш високого енергетичного рівня, а потім негайно опускаються назад до нижчого рівня енергії і випромінюють енергію, різну між двома енергетичними рівнями.
- Існування атомних спектрів є підтримкою моделі атома Бора.
- Модель Бора була успішною лише при розрахунку енергетичних рівнів для атома водню.
- Модель оболонки є хорошим відображенням розташування електронів лише для елементів 1-18.
Дописувачі та атрибуція
- Template:ContribBodner
- Connections (John Hutchinson)
- Wikipedia
- Template:ContribAgnewM
- Template:ContribAgnewH
