11.2: Природа окислення та відновлення
- Page ID
- 23076
Результати навчання
- Визначте окислення та відновлення з точки зору посилення або втрати атомів кисню або водню.
- Визначте окислення та зменшення з точки зору посилення або втрати електронів.
- Визначте речовини, які беруть участь в окисленні і відновленні реакції.
- Визначте окислювачі та відновники в окислювально-відновній реакції.
- Напишіть послідовність окислення або відновлення для молекули (спирт, альдегід/кетон, карбонова кислота)
Кисень - елемент, який відомий століттями. У чистому елементарному вигляді кисень є високоактивним, і він легко робить сполуки з більшістю інших елементів. Це також найпоширеніший елемент за масою в земній корі. Клас реакцій, званих окисленням і відновленням, спочатку визначався щодо елемента кисню.
Роль кисню в реакціях
Багато елементів просто поєднуються з киснем, утворюючи оксид цього елемента. Нагрівання магнію в повітрі дозволяє йому поєднуватися з киснем, утворюючи оксид магнію.
\[2 \ce{Mg} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{MgO} \left( s \right)\]
Багато сполук реагують з киснем, а також, часто в дуже екзотермічних процесах, які зазвичай називають реакціями горіння. Наприклад, при згорянні метану утворюється вуглекислий газ і вода.
\[\ce{CH_4} \left( g \right) + 2 \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + 2 \ce{H_2O} \left( g \right)\]
Вуглекислий газ - це оксид вуглецю, тоді як вода - оксид водню. Ранні вчені розглядали окислення як процес, при якому речовина вступала в реакцію з киснем з отриманням одного або декількох оксидів. У попередніх прикладах відбувається окислення магній і метан.
Окислення не обов'язково вимагає нагрівання. Залізо, яке піддається впливу повітря і води, повільно окислюється в процесі, широко відомому як іржавіння. Відбілювачі містять різні сполуки, такі як гіпохлорит натрію\(\left( \ce{NaClO} \right)\), які можуть окислювати плями шляхом перенесення атомів кисню, роблячи молекули в плямах більш водорозчинними і, отже, легше змиваються. Перекис водню\(\left( \ce{H_2O_2} \right)\) виділяє кисень у міру того, як він мимовільно розкладається. Він також діє як відбілювач і використовується як антисептик, який вбиває бактерії, окислюючи їх.
Протилежність окисленню називається відновленням. Оскільки окислення спочатку визначалося як додавання кисню, відновлення було, таким чином, видаленням кисню з речовини. Багато природних металевих руд присутні у вигляді оксидів. Чисті метали можуть бути витягнуті шляхом відновлення. Наприклад, чисте залізо отримують з оксиду заліза (III) шляхом взаємодії його з вуглецем при високих температурах.
\[2 \ce{Fe_2O_3} \left( s \right) + 3 \ce{C} \left( s \right) \rightarrow 4 \ce{Fe} \left( s \right) + 3 \ce{CO_2} \left( g \right)\]
Видалення кисню з\(\ce{Fe_2O_3}\) молекули означає, що вона зводиться до\(\ce{Fe}\). Зверніть увагу, що процес окислення також відбувається одночасно в цій реакції; вуглецевий реагент окислюється до\(\ce{CO_2}\). Це важливе поняття. Розглядаючи органічні сполуки, ми можемо описати окислення та зменшення з точки зору втрати або посилення кисню або втрати або посилення водню.
Якщо ми подивимось на окислення етанолу (\(\ce{CH_3CH_2OH}\)спирту) з утворенням етанолу (\(\ce{CH_3CH_2CHO}\)альдегіду), ми побачимо, що кількість зв'язків з киснем зросла, а кількість атомів водню зменшилася з шести до чотирьох. Або обидва з них вказують на те, що відбулося окислення.

Для зменшення ми шукаємо видалення кисню або зв'язків з киснем або додавання або атомів водню. У наступній реакції ми бачимо, що етанова кислота (\(\ce{CH_3COOH}\)карбонова кислота) відновлюється до етанолу (\(\ce{CH_3CH_2CHO}\)альдегіду). Відзначимо, що кількість атомів кисню зменшується з двох до одного. Кількість атомів водню не змінюється, але обидві зміни не повинні відбуватися для доказів окислення або відновлення.

Якщо ми бачимо докази окислення або відновлення, ми знаємо, що інше, мабуть, сталося також. Окислення і відновлення повинні відбуватися разом. Жоден не може статися поодинці в реакції.
Електрон в окисно-відновних реакціях
Визначення окислення та відновлення були в кінцевому підсумку розширені, включивши подібні типи реакцій, які не обов'язково включають кисень. Кисень більш електронегативний, ніж будь-який елемент, крім фтору. Тому, коли кисень пов'язаний з будь-яким елементом, крім фтору, електрони від іншого атома зміщуються від цього атома і до атома кисню. Окислювально-відновна реакція (іноді скорочено - окислювально-відновна реакція) - це реакція, яка передбачає повне або часткове перенесення електронів від одного реагенту до іншого. Окислення передбачає повну або часткову втрату електронів, тоді як зменшення передбачає повне або часткове посилення електронів.
Легка приказка для запам'ятовування визначень окислення та відновлення - «ЛЕО лев говорить GER» (див. Малюнок нижче)! LEO позначає Втрата електронів є окислення, тоді як GER розшифровується як отримання електронів є зменшення.

Окислювально-відновні реакції та іонні сполуки
В ході хімічної реакції між металом і неметалом електрони передаються від атомів металу до неметалевих атомів. Наприклад, при нагріванні металу цинку в присутності сірки утворюється з'єднання сульфіду цинку (див. Малюнок нижче). Два валентних електрона від кожного атома цинку передаються кожному атому сірки.
Оскільки цинк втрачає електрони під час цієї реакції, він окислюється. Сірка набирає електрони, тому її відновлюють. Кожен з цих процесів можна показати в окремому рівнянні, званому напівреакцією. Половинна реакція - це рівняння, яке показує або окислення, або реакцію відновлення, яка виникає під час окислювально-відновної реакції.
\[\begin{align} &\text{Oxidation:} \: \: \ce{Zn} \rightarrow \ce{Zn^{2+}} + 2 \ce{e^-} \\ &\text{Reduction:} \: \: \ce{S} + 2 \ce{e^-} \rightarrow \ce{S^{2-}} \end{align}\]
Важливо пам'ятати, що дві напівреакції відбуваються одночасно. Утворені іони потім притягуються один до одного, утворюючи іонний зв'язок.
Окислювально-відновні реакції також зазвичай описуються з точки зору окислювачів та відновників. У реакції вище цинк окислюється, втрачаючи електрони. Однак ізольована іонізація була б дуже високоенергетичним процесом, тому повинна бути присутня інша речовина, щоб отримати ці втрачені електрони. При цьому електрони набираються сіркою. Іншими словами, сірка викликає окислення цинку. Отже, сірку відносять до окислювача. І навпаки, цинк змушує сірку набирати електрони і зменшуватися, тому цинк є відновником. Окислювач - це речовина, яка викликає окислення, приймаючи електрони, а відновник - речовина, яка викликає зменшення, втрачаючи електрони. Сказаний іншим способом, окислювач - це речовина, яке відновлюється, в той час як відновником є речовина, яке окислюється.
Приклад\(\PageIndex{1}\)
Коли хлорний газ барботируют в розчин броміду натрію, відбувається реакція, яка виробляє водний хлорид натрію і елементарний бром.
- Визначте, що окислюється, а що відновлюється.
- Визначте окислювачі та відновники.
Рішення
Спочатку подивіться на кожен елемент в реакції і призначте кожному елементу номери окислення.
\[\ce{Cl_2} \left( g \right) + 2 \ce{NaBr} \left( aq \right) \rightarrow 2 \ce{NaCl} \left( aq \right) + \ce{Br_2} \left( l \right)\]
Хлор в\(\ce{Cl_2}\) і бром в\(\ce{Br_2}\) обох мають окислювальні числа 0. \(\ce{NaBr}\)і\(\ce{NaCl}\) є іонними сполуками, тому їх іонні заряди будуть їх окислювальними числами.
\[\overset{0}{\ce{Cl_2}} \left( g \right) + 2 \overset{+1}{\ce{Na}} \overset{-1}{\ce{Br}} \left( aq \right) \rightarrow 2 \overset{+1}{\ce{Na}} \overset{-1}{\ce{Cl}} \left( aq \right) + \overset{0}{\ce{Br_2}} \left( l \right)\]
а Ступінь окислення хлору переходить від 0 до,\(-1\) тому він набирає електрон і зменшується. Ступінь окислення брому переходить від 0\(-1\) до 0, тому він втрачає електрон і окислюється. Ступінь окислення натрію не змінюється, тому він не бере участі ні в окисленні, ні в відновленні.
б.\(\ce{Cl_2}\) відновлюється і є окислювачем. The\(\ce{Br^-}\) окислюється і є відновником.

Окислювально-відновні реакції та молекулярні сполуки
Втрату або посилення електронів легко помітити в реакції, в якій утворюються іони. Однак у багатьох реакціях електрони передаються не повністю. Нагадаємо, що в молекулярній сполуці електрони діляться між атомами в типі зв'язку, який називається ковалентним зв'язком. Незважаючи на те, що електрони не повністю переносяться між атомами, все ще часто реакції, що включають молекулярні сполуки, класифікуються як окислювально-відновні реакції.
Наприклад, коли водневий газ вступає у реакцію з газом кисню, як продукт утворюється вода.
\[2 \ce{H_2} \left( g \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{H_2O} \left( l \right)\]
Присвоюємо числа окислення, щоб визначити, які види набирають і втрачають електрони. Пам'ятайте, що числа окислення говорять нам, яким був би заряд, якби електрони були передані повністю, навіть якщо вони поділяються, а не передані, в ковалентних зв'язках. Для синтезу води числа окислення вільних елементів (водню і кисню) дорівнюють нулю. Для води кисень має\(-2\) окислювальне число, тоді як водень має\(+1\).
\[2 \overset{0}{\ce{H_2}} \left( g \right) + \overset{0}{\ce{O_2}} \left( g \right) \rightarrow 2 \overset{+1}{\ce{H_2}} \overset{-2}{\ce{O}} \left( l \right)\]
Ступінь окислення від водню йде від 0 до\(+1\), що свідчить про окислення. Ступінь окислення кисню йде від 0 до\(-2\), що свідчить про відновлення. Тому водень окислюється і є відновником. Кисень знижується і є окислювачем.
Приріст або втрата водню та кисню
Окислення також можна визначити як додавання кисню до молекули або видалення водню. Таким чином, зменшення - це додавання водню або видалення кисню. Кілька класів органічних сполук пов'язані один з одним реакціями окислення і відновлення. Алкани, алкени та алкіни представляють різні рівні окислення вуглеводню. Коли алкан нагрівається в присутності відповідного каталізатора, він може окислюватися до відповідного алкену в реакції, яка називається реакцією дегідрування. У процесі видаляються два атома водню. Алкен може бути додатково окислений до алкіну шляхом видалення ще двох атомів водню. Це також вважається окисленням за сучасним визначенням, оскільки число окислення кожного атома вуглецю йде від\(-3\)\(-2\) до\(-1\).
\[\text{oxidation:} \: \: \ce{CH_3CH_3} \overset{\ce{-H_2}}{\rightarrow} \ce{CH_2=CH_2} \overset{\ce{-H_2}}{\rightarrow} \ce{CH \equiv CH}\]
Реакції оборотні, тому алкін може бути зведений спочатку до алкену, а потім до алкану. Це реакції на додавання, як видно в попередньому розділі.
\[\text{reduction:} \: \: \ce{CH \equiv CH} \overset{\ce{+H_2}}{\rightarrow} \ce{CH_2=CH_2} \overset{\ce{+H_2}}{\rightarrow} \ce{CH_3CH_3}\]
Алкан є найбільш відновленою формою вуглеводню, тоді як алкін - найбільш окислена форма.
Нижче наведено зміни електронів, кількості окислення, кількості атомів кисню та кількості атомів водню для реакцій окислення та відновлення.
Реакції окислення в органічній хімії часто передбачають додавання кисню до з'єднання (або збільшення кількості зв'язків з киснем), що змінює присутню функціональну групу. Наступна послідовність показує, як метан може окислюватися спочатку до метанолу (спирту), потім до метану (альдегіду), потім до метанової кислоти (карбонової кислоти) і, нарешті, до вуглекислого газу. Кожен етап процесу - це або посилення кисню, або втрата водню. Кожен крок також представляє енергію, що пояснює, чому повне згоряння алканів до вуглекислого газу є надзвичайно екзотермічною реакцією.
\[\begin{array}{ccccccccc} \ce{CH_4} & \overset{\text{gain of oxygen}}{\rightarrow} & \ce{CH_3OH} & \overset{\text{loss of hydrogen}}{\rightarrow} & \ce{CH_2O} & \overset{\text{gain of oxygen}}{\rightarrow} & \ce{HCOOH} & \overset{\text{loss of hydrogen}}{\rightarrow} & \ce{CO_2} \\ \text{alkane} & & \text{alcohol} & & \text{aldehyde} & & \text{carboxylic acid} & & \text{carbon dioxide} \end{array}\]
Протилежним процесом є відновлення карбонової кислоти до алкану, що передбачає втрату кисню та посилення водню.
\[\begin{array}{ccccccc} \ce{CH_4} & \overset{\text{loss of oxygen}}{\leftarrow} & \ce{CH_3OH} & \overset{\text{gain of hydrogen}}{\leftarrow} & \ce{CH_2O} & \overset{\text{loss of oxygen}}{\leftarrow} & \ce{HCOOH} \\ \text{alkane} & & \text{alcohol} & & \text{aldehyde} & & \text{carboxylic acid} \end{array}\]
Окислення спирту може виробляти або альдегід, або кетон. Первинний спирт окислюється з утворенням альдегіду.
\[\ce{CH_3CH_2OH} \underset{\ce{H^+}}{\overset{\ce{Cr_2O_7^{2-}}}{\rightarrow}} \ce{CH_3CHO}\]
Вторинний спирт окислюється до кетону, а не альдегіду. При окисленні найпростішого вторинного спирту, 2-пропанолу, виходить пропанон.
\[\ce{CH_3CHOHCH_3} \underset{\ce{H^+}}{\overset{\ce{Cr_2O_7^{2-}}}{\rightarrow}} \ce{CH_3COCH_3}\]
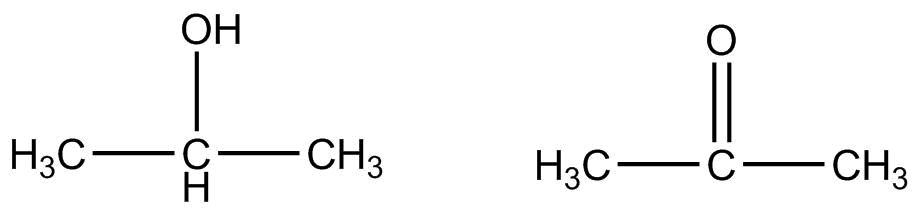
Третинні спирти не можуть окислюватися таким чином, оскільки вуглець, до якого приєднана гідроксильна група, не має іншого атома водню, приєднаного до нього і не може піддаватися окисленню.
Коли первинний спирт окислюється до альдегіду в присутності води, реакцію може бути важко зупинити, оскільки альдегід може бути додатково окислений до відповідної карбонової кислоти. Наприклад, при окисленні етанолу утворюється етановая (оцтова) кислота. Етанол містять напої, такі як вино, сприйнятливі до такого окислення, якщо їх зберігати протягом тривалого періоду часу після відкриття та впливу повітря. Окислене вино матиме неприємний оцтовий смак через вироблення оцтової кислоти. На відміну від альдегідів, кетони стійкі до подальшого окислення, оскільки карбонільна група знаходиться в середині вуглецевого ланцюга, тому кетон не може бути перетворений у карбонову кислоту.
\[\ce{CH_3CHO} \underset{\ce{H^+}}{\overset{\ce{Cr_2O_7^{2-}}}{\rightarrow}} \ce{CH_3COOH}\]
| Процес | Зміни електронів (завжди) | Зміна числа окислення (завжди) | Зміна кисню (деякі реакції) | Зміна водню (деякі реакції) |
|---|---|---|---|---|
| Окислення | втрачати | збільшувати | виграш | втрачати |
| Зменшення | виграш | зменшення | втрачати | виграш |



