7.5: Водні розчини
- Page ID
- 22774
Результати навчання
- Визначте рішення та опишіть частини рішення.
- Опишіть, як утворюється водний розчин як з іонних сполук, так і з молекулярних сполук.
- Визнайте, що деякі сполуки нерозчинні у воді.
- Опишіть відмінності між сильними електролітами, слабкими електролітами та неелектролітами.
Формування рішення
Коли одна речовина розчиняється в іншому, утворюється розчин. Розчин являє собою однорідну суміш, що складається з розчиненої в розчиннику розчиненої речовини. Розчинна речовина - це речовина, яка розчиняється, тоді як розчинник - середовище, що розчиняється. Розчини можуть утворюватися з безліччю різних типів і форм розчинників і розчинників. У цьому розділі ми зупинимося на розчині, де розчинником є вода. Водний розчин - це вода, яка містить одне або кілька розчинених речовин. Розчиненими речовинами у водному розчині можуть бути тверді речовини, гази або інші рідини.
Для того щоб вийшло справжнє рішення, суміш повинна бути стійкою. Коли цукор повністю розчиниться у воді, він може простояти невизначену кількість часу, і цукор не осяде з розчину. Далі, якщо цукрово-водний розчин пропустити через фільтр, він залишиться з водою. Це пояснюється тим, що розчинені частинки в розчині дуже малі, зазвичай менше, ніж\(1 \: \text{nm}\) в діаметрі. Розчинені частинки можуть бути атомами, іонами або молекулами, залежно від типу речовини, яка була розчинена.

Процес розчинення
Вода зазвичай розчиняє більшість іонних сполук і полярних молекул. Неполярні молекули, такі як ті, що містяться в жирі або олії, не розчиняються у воді. Спочатку ми розглянемо процес, який відбувається, коли іонна сполука, наприклад кухонна сіль (хлорид натрію), розчиняється у воді.
Молекули води рухаються приблизно безперервно за рахунок своєї кінетичної енергії. Коли кристал хлориду натрію поміщається в воду, молекули води стикаються з кристалічною решіткою. Нагадаємо, що кристалічна решітка складається з чергуються позитивних і негативних іонів. Воду приваблює кристал хлориду натрію, оскільки вода полярна; вона має як позитивний, так і негативний кінець. Позитивно заряджені іони натрію в кристалі притягують кисневий кінець молекул води, оскільки вони частково негативні. Негативно заряджені іони хлориду в кристалі притягують водневий кінець молекул води, оскільки вони частково позитивні. Дія полярних молекул води розбирає кристалічну решітку (див. Малюнок нижче).
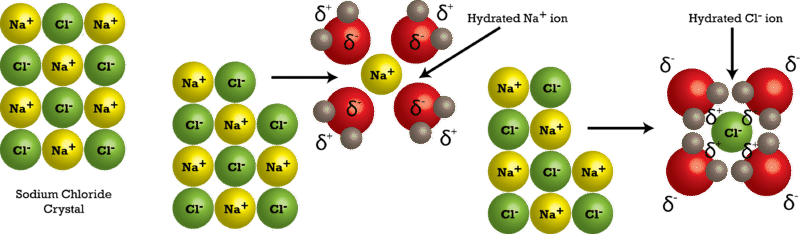
Після виходу з кристала окремі іони потім оточені частинками розчинника в процесі, який називається сольвацією. Зверніть увагу на малюнку вище, що окремі\(\ce{Na^+}\) іони оточені молекулами води з атомом кисню, орієнтованим поблизу позитивного іона. Так само іони хлориду оточені молекулами води з протилежною орієнтацією. Гідратація - це процес розчинених частинок, оточених молекулами води, розташованими певним чином. Гідратація допомагає стабілізувати водні розчини, запобігаючи поверненню позитивних і негативних іонів і утворюючи осад.
Столовий цукор виготовляється з молекулярної сполуки сахарози\(\left( \ce{C_{12}H_{22}O_{11}} \right)\). Твердий цукор складається з окремих молекул цукру, скріплених між собою міжмолекулярними силами притягання. Коли вода розчиняє цукор, вона відокремлює окремі молекули цукру, порушуючи сили притягання, але не порушує ковалентні зв'язки між атомами вуглецю, водню та кисню. Розчинені молекули цукру також гідратовані. Гідратаційна оболонка навколо молекули сахарози влаштована так, що її частково негативні атоми кисню знаходяться поблизу частково позитивних атомів водню в розчиннику, і навпаки.
нерозчинні сполуки
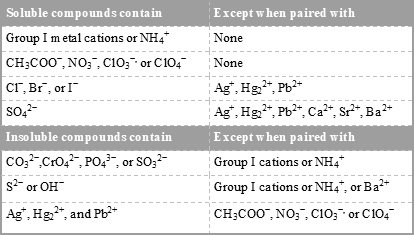
Не всі склади добре розчиняються у воді. Деякі іонні сполуки, такі як карбонат кальцію\(\left( \ce{CaCO_3} \right)\) та хлорид срібла\(\left( \ce{AgCl} \right)\), майже не розчиняються. Це пов'язано з тим, що атракціони між іонами в кристалічній решітці сильніші, ніж тяжіння, яке молекули води мають для іонів. В результаті кристал залишається цілим. Розчинність іонних сполук можна передбачити, використовуючи правила розчинності, наведені в табл\(\PageIndex{1}\).
Таблиця\(\PageIndex{1}\): Правила розчинності іонних сполук у воді.
Неполярні сполуки також не розчиняються у воді. Привабливі сили, що діють між частинками в неполярному з'єднанні, є слабкими силами дисперсії. Для того, щоб неполярна молекула розчинялася у воді, їй потрібно було б розірвати частину водневих зв'язків між сусідніми молекулами води. У випадку з іонною речовиною ці сприятливі взаємодії замінюються іншими привабливими взаємодіями між іонами та частковими зарядами на воді. Однак взаємодія між неполярними молекулами і водою менш сприятливі, ніж взаємодії, які вода здійснює з собою. Коли неполярна рідина, така як олія, змішується з водою, утворюються два окремих шари, оскільки рідини не будуть розчинятися один в одного (див. Малюнок нижче). Коли така полярна рідина, як етанол, змішується з водою, вони повністю змішуються і розчиняються один в одному. Рідини, які розчиняються одна в одній у всіх пропорціях, кажуть, що змішуються. Рідини, які не розчиняються одна в одній, називаються незмішуваними. Загальне правило для прийняття рішення про те, чи здатна одна речовина розчиняти інше, - це «як розчиняється, як», де властивість порівнюється - загальна полярність речовини. Наприклад, неполярна тверда речовина, така як йод, розчиняється в неполярній запальничці рідини, але не розчиняється в полярній воді.

Електроліти та неелектроліти
Електроліт - це з'єднання, яке проводить електричний струм при його розчиненні у воді або розплавленні. Для того щоб провести струм, речовина повинна містити рухливі іони, які можуть переміщатися від одного електрода до іншого. Всі іонні сполуки є електролітами. Коли іонні сполуки розчиняються, вони розпадаються на іони, які потім здатні проводити струм. Навіть нерозчинні іонні сполуки\(\ce{CaCO_3}\), такі як, вважаються електролітами, оскільки вони можуть проводити струм в розплавленому (розплавленому) стані.

Неелектроліт - це з'єднання, яке не проводить електричний струм ні в водному розчині, ні в розплавленому стані. Багато молекулярні сполуки, такі як цукор або етанол, є неелектролітами. Коли ці сполуки розчиняються у воді, вони не виробляють іонів. Нижче проілюстрована різниця між електролітом і неелектролітом.
дисоціація
Раніше ви бачили, як іонна кристалічна решітка розпадається, коли її розчиняють у воді. Дисоціація - це поділ іонів, що виникає при розчиненні твердого іонного з'єднання. Просто скасуйте перехресний метод, який ви дізналися під час написання хімічних формул для іонних сполук, і вам залишаються компоненти рівняння іонної дисоціації. Індекси для іонів у хімічних формулах стають коефіцієнтами відповідних іонів на стороні добутку рівнянь. Нижче наведені рівняння дисоціації для\(\ce{NaCl}\),\(\ce{Ca(NO_3)_2}\), і\(\ce{(NH_4)_3PO_4}\).
\[\begin{align} &\ce{NaCl} \left( s \right) \rightarrow \ce{Na^+} \left( aq \right) + \ce{Cl^-} \left( aq \right) \\ &\ce{Ca(NO_3)_2} \left( s \right) \rightarrow \ce{Ca^{2+}} \left( aq \right) + 2 \ce{NO_3^-} \left( aq \right) \\ &\ce{(NH_4)_3PO_4} \left( s \right) \rightarrow 3 \ce{NH_4^+} \left( aq \right) + \ce{PO_4^{3-}} \left( aq \right) \end{align}\]
Одна формульна одиниця хлориду натрію дисоціює на один іон натрію і один хлорид-іон. Одиниця формули нітрату кальцію дисоціює на один іон кальцію і два нітратних іона, оскільки\(2+\) заряд кожного іона кальцію вимагає двох нітратних іонів (кожен із зарядом\(1-\)) для утворення електрично нейтральної сполуки. Блок формули фосфату амонію дисоціює на три іони амонію та один фосфатний іон.
Не плутайте індекси атомів всередині багатоатомного іона для індексів, що виникають внаслідок перехрещення зарядів, які роблять вихідну сполуку нейтральною. 3-й індекс нітратного іона і індекс 4 іона амонію є частиною багатоатомного іона і залишаються частиною іонної формули після дисоціації з'єднання. Зверніть увагу, що сполуки - це тверді речовини\(\left( s \right)\), які стають іонами при розчиненні у воді, утворюючи водний розчин\(\left( aq \right)\).

Неелектроліти не дисоціюють при утворенні водного розчину. Ще можна записати рівняння, яке просто показує тверде тіло, що йде в розв'язок. Наприклад, процес розчинення сахарози у воді можна записати так:
\[\ce{C_{12}H_{22}O_{11}} \left( s \right) \rightarrow \ce{C_{12}H_{22}O_{11}} \left( aq \right)\]
Сильні і слабкі електроліти
Деякі полярні молекулярні сполуки є неелектролітами, коли вони знаходяться в чистому стані, але стають електролітами, коли вони розчиняються у воді. Хлористий водень\(\left( \ce{HCl} \right)\) є газом в чистому молекулярному стані і є неелектролітом. Однак при\(\ce{HCl}\) розчиненні у воді він добре проводить струм, оскільки\(\ce{HCl}\) молекула іонізується в іони водню та хлориду.
\[\ce{HCl} \left( g \right) \rightarrow \ce{H^+} \left( aq \right) + \ce{Cl^-} \left( aq \right)\]
При\(\ce{HCl}\) розчиненні у воді його називають соляною кислотою. Іонні сполуки і деякі полярні сполуки повністю розбиваються на іони і таким чином проводять струм дуже добре. Сильний електроліт - це розчин, в якому практично вся розчинена речовина існує у вигляді іонів.
Деякі інші полярні молекулярні сполуки стають електролітами після розчинення у воді, але не іонізуються в дуже великій мірі. Наприклад, азотна кислота\(\left( \ce{HNO_2} \right)\) лише частково іонізується в іони водню і нітритні іони при розчиненні у воді. Водна азотна кислота складається тільки з близько\(5\%\) іонів і\(95\%\) неушкоджених молекул азотної кислоти. Слабкий електроліт - це розчин, в якому у вигляді іонів існує лише мала частка розчиненого розчиненого речовини. Рівняння, що показує іонізацію слабкого електроліту, використовує стрілку рівноваги, що вказує на рівновагу між реагентами та продуктами.
\[\ce{HNO_2} \left( aq \right) \rightleftharpoons \ce{H^+} \left( aq \right) + \ce{NO_2^-} \left( aq \right)\]