7.3: Кінетико-молекулярна теорія
- Page ID
- 22800
Результати навчання
- Визначте тиск і опишіть, як гази чинять тиск.
- Перетворення між одиницями тиску газу (\(\text{atm}\),\(\text{mm} \ce{Hg}\),\(\text{torr}\), і\(\text{Pa}\)).
- Віднесіть температуру до середньої кінетичної енергії.
- Віднесіть масу до молекулярної швидкості.
- Опишіть поведінку ідеального газу.
Кінетико-молекулярна теорія - це теорія, яка пояснює стани речовини і базується на ідеї, що матерія складається з крихітних частинок, які завжди знаходяться в русі. Теорія допомагає пояснити спостережувані властивості та поведінку твердих речовин, рідин та газів. Однак теорію найлегше зрозуміти, оскільки вона відноситься до газів. Теорія застосовується саме до моделі газу, яка називається ідеальним газом. Ідеальний газ - уявний газ, поведінка якого ідеально відповідає всім припущенням кінетико-молекулярної теорії. Насправді гази не є ідеальними, але вони дуже близькі до того, щоб бути такими в більшості повсякденних умов.
Кінетико-молекулярна теорія, як це стосується газів, має п'ять основних припущень.
- Гази складаються з дуже великої кількості крихітних сферичних частинок, які знаходяться далеко один від одного в порівнянні з їх розмірами. Частинки газу можуть бути або атомами, або молекулами. Відстань між частинками газу набагато, набагато більше, ніж відстані між частинками рідини або твердої речовини. Отже, більша частина обсягу газу складається з порожнього простору між частинками. Насправді обсяг самих частинок вважається незначним в порівнянні з обсягом порожнього простору.
- Частинки газу знаходяться в постійному швидкому русі у випадкових напрямках. Швидкий рух частинок газу дає їм відносно велику кількість кінетичної енергії. Нагадаємо, що кінетична енергія - це енергія, якою володіє об'єкт через його руху. Частинки газу рухаються по прямій лінії, поки не зіткнуться з іншою частинкою або з однією зі стінок своєї ємності (див. Малюнок нижче).
- Зіткнення між частинками газу і між частинками і стінками контейнера є пружними зіткненнями. Пружне зіткнення - це таке, при якому немає загальної втрати кінетичної енергії. Кінетична енергія може передаватися від однієї частинки до іншої під час пружного зіткнення, але зміни загальної енергії стикаються частинок не відбувається.
- Між частинками газу немає сил тяжіння або відштовхування. Привабливі сили відповідають за частинки реального газу, що конденсуються разом, утворюючи рідину. Передбачається, що частинки ідеального газу не мають таких привабливих сил. Рух кожної частинки повністю не залежить від руху всіх інших частинок.
- Середня кінетична енергія газових частинок залежить від температури газу. Зі збільшенням температури газу частинки його складових починають рухатися швидше, що призводить до збільшення їх кінетичних енергій. Не всі частинки в даному зразку мають однакову швидкість, тому зразок буде містити частинки з діапазоном різних кінетичних енергій. Однак середня кінетична енергія частинок у зразку пропорційна його температурі.

Тиск газу
Тиск визначається як сила на одиницю площі на поверхні.
\[\text{Pressure} = \frac{\text{force}}{\text{area}}\]
Коли людина стоїть на підлозі, його ступні чинять тиск на поверхню. Цей тиск пов'язаний як з масою людини, так і з поверхнею його ніг. Якби людина тримала важкий предмет, тиск збільшувався б через більшої сили. Як варіант, якщо людина стоїть на пальцях ніг, тиск також збільшується через зменшення площі поверхні.
Молекули газу також чинять тиск. Атмосфера Землі чинить тиск, оскільки гравітація діє на величезну кількість газових частинок, що містяться в атмосфері, утримуючи її на місці. Тиск також надають невеликі зразки газу, такі як зовнішній тиск, що чиниться газом всередині балона. Тиск газу - це тиск, який виникає в результаті зіткнень частинок газу з об'єктом. Усередині балона частинки газу стикаються з внутрішніми стінками балона. Саме ті зіткнення тримають повітряну кулю надутим. Якби частинки газу раптово перестали рухатися, балон миттєво спущений. На малюнку нижче наведено ілюстрацію газових частинок, що чинить тиск всередині контейнера.
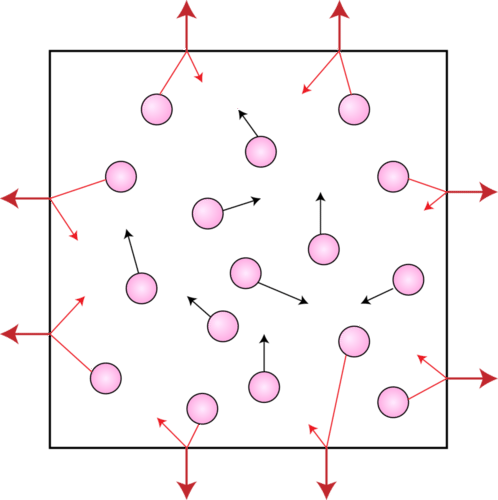
Вимірювання тиску
Атмосферний тиск - це тиск, який чинять частинки газу в атмосфері Землі, коли ці частинки стикаються з предметами. Барометр - це прилад, який використовується для вимірювання атмосферного тиску. Традиційний ртутний барометр складається з евакуйованої трубки, зануреної в ємність з ртуттю. Молекули повітря з атмосфери штовхають вниз на зовнішню поверхню ртуті, але, оскільки всередині трубки знаходиться вакуум, немає відповідного вниз поштовху на ртуть в трубці. В результаті ртуть піднімається всередині трубки. Висота, на яку піднімається ртуть, залежить від зовнішнього тиску повітря.
На рівні моря ртутний стовп підніметься на відстань\(760 \: \text{mm}\). Це атмосферний тиск повідомляється як\(760 \: \text{mm} \: \ce{Hg}\) (міліметри ртутного стовпа). На більших висотах атмосферний тиск нижче, тому стовп ртуті підніметься не так високо. Наприклад, на вершині гори. Еверест (на висоті\(8848 \: \text{m}\)), тиск повітря -\(253 \: \text{mm} \: \ce{Hg}\). Атмосферний тиск також трохи залежить від погодних умов.
Більш зручний барометр, званий анероїдним барометром, вимірює тиск шляхом розширення і стиснення невеликої пружини всередині евакуйованої металевої капсули.
Одиниці тиску газу
А барометри вимірюють тиск газу висотою стовпа ртуті. Однією одиницею тиску газу є міліметр ртутного стовпа\(\left( \text{mm} \: \ce{Hg} \right)\). Еквівалентна одиниця\(\text{mm} \: \ce{Hg}\) називається торр, на честь винахідника барометра Євангелісти Торрічеллі. Паскаль\(\left( \text{Pa} \right)\) - стандартна одиниця тиску. Паскаль - це дуже мала кількість тиску, тому більш корисною одиницею для повсякденного тиску газу є кілопаскаль\(\left( \text{kPa} \right)\). Кілопаскаль дорівнює 1000 паскалям. Ще однією часто використовуваною одиницею тиску є атмосфера\(\left( \text{atm} \right)\). Стандартний атмосферний тиск називається\(1 \: \text{atm}\) тиском і дорівнює\(760 \: \text{mm} \: \ce{Hg}\) і\(101.3 \: \text{kPa}\). Співвідношення між найбільш поширеними одиницями тиску наведені нижче.
\[1 \: \text{atm} = 760 \: \text{mm} \: \ce{Hg} = 760 \: \text{torr} = 101.3 \: \text{kPa}\]
Приклад\(\PageIndex{1}\)
Атмосферний тиск в гірському місці вимірюється бути\(613 \: \text{mm} \: \ce{Hg}\). Що це за тиск в\(\text{atm}\) і в\(\text{kPa}\)?
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- Дано:\(613 \: \text{mm} \: \ce{Hg}\)
- \(1 \: \text{atm} = 760 \: \text{mm} \: \ce{Hg}\)
- \(101.3 \: \text{kPa} = 760 \: \text{mm} \: \ce{Hg}\)
Невідомий
- Тиск\(= ? \: \text{atm}\)
- Тиск\( = ? \: \text{kPa}\)
Використовуйте коефіцієнти перетворення з еквівалентних одиниць тиску для перетворення з\(\text{mm} \: \ce{Hg}\) в\(\text{atm}\) і з\(\text{mm} \: \ce{Hg}\) на\(\text{kPa}\).
Крок 2: Вирішіть.
\[613 \: \text{mm} \: \ce{Hg} \times \frac{1 \: \text{atm}}{760 \: \text{mm} \: \ce{Hg}} = 0.807 \: \text{atm} \nonumber\]
\[613 \: \text{mm} \: \ce{Hg} \times \frac{101.3 \: \text{kPa}}{760 \: \text{mm} \: \ce{Hg}} = 81.7 \: \text{kPa} \nonumber\]
Крок 3: Подумайте про свій результат.
Тиск повітря становить приблизно\(80\%\) стандартний атмосферний тиск на рівні моря. Стандартним тиском\(760 \: \text{mm} \: \ce{Hg}\) можна вважати три значущі цифри.
Кінетична енергія і температура
Як зазначено в кінетико-молекулярній теорії, температура речовини пов'язана із середньою кінетичною енергією частинок цієї речовини. Коли речовина нагрівається, частина поглиненої енергії зберігається всередині частинок, тоді як частина енергії збільшує швидкість, з якою частинки рухаються. Це спостерігається як підвищення температури речовини.
Середня кінетична енергія
При будь-якій заданій температурі не всі частинки в зразку речовини мають однакову кінетичну енергію. Натомість частинки відображають широкий діапазон кінетичних енергій. Більшість частинок мають кінетичну енергію поблизу середини діапазону. Однак деякі частинки мають кінетичні енергії набагато нижчі або значно вищі за середню (див. Малюнок нижче).

Показана синя крива (див. Малюнок вище) призначений для зразка речовини при відносно низькій температурі, тоді як червона крива - для зразка при відносно високій температурі. В обох випадках більшість частинок мають проміжні кінетичні енергії, близькі до середньої. Зверніть увагу, що зі збільшенням температури діапазон кінетичних енергій збільшується і крива розподілу «згладжується».
При заданій температурі частинки будь-якої речовини мають однакову середню кінетичну енергію. При кімнатній температурі молекули в зразку рідкої води мають таку ж середню кінетичну енергію, як молекули в зразку газу кисню або іони в зразку хлориду натрію.
Абсолютний нуль
Оскільки зразок речовини постійно охолоджується, середня кінетична енергія її частинок зменшується. Врешті-решт, можна було б очікувати, що частинки повністю перестануть рухатися. Абсолютний нуль - це температура, при якій рух частинок теоретично припиняється. Абсолютний нуль ніколи не був досягнутий в лабораторії, але температури на порядку\(1 \times 10^{-10} \: \text{K}\) були досягнуті. Температурна шкала Кельвіна заснована на цій теоретичній межі, тому абсолютний нуль дорівнює\(0 \: \text{K}\). Температура Кельвіна речовини прямо пропорційна середній кінетичної енергії частинок речовини. Наприклад, частинки у зразку водневого газу при\(200 \: \text{K}\) мають удвічі більшу середню кінетичну енергію, ніж частинки у зразку водню при\(100 \: \text{K}\).