6.1: Тепловий потік
Результати навчання
- Опишіть, як хімічна потенційна енергія відноситься до тепла і роботи.
- Використовуйте питоме рівняння теплоємності для виконання розрахунків, які стосуються маси, питомої теплоти, зміни температури та кількості поглиненого або виділеного тепла.
- Перетворіть серед джоуля, калорій та калорій.
- Визначають ендотермічні та екзотермічні.
- Поясніть різницю між тепловою і питомою теплоємністю.
Хімічні реакції супроводжуються перенесеннями енергії. Відстеження теплових потоків та енергетичних потреб важливо для повного розуміння хімічних процесів. Енергія - це здатність виконувати роботу або подавати тепло. Коли ви заправляєте свій автомобіль бензином, ви забезпечуєте його потенційною енергією. Хімічна потенційна енергія - це енергія, що зберігається в хімічних зв'язках речовини. Різні хімічні речовини в бензині містять велику кількість хімічної потенційної енергії, яка виділяється при спалюванні бензину контрольованим способом в двигуні автомобіля. Вивільнення цієї енергії робить дві речі. Частина потенційної енергії трансформується в роботу, яка використовується для переміщення автомобіля (див. Малюнок нижче). При цьому частина потенційної енергії перетворюється в тепло, роблячи двигун автомобіля дуже гарячим. Енергетичні зміни системи відбуваються як тепло або робота, або якесь поєднання обох.

Тепло - це енергія, яка передається від одного предмета або речовини до іншого через різницю температур між ними. Тепло завжди надходить від об'єкта при більш високій температурі до об'єкта при більш низькій температурі (див. Малюнок нижче). Потік тепла буде тривати до тих пір, поки два об'єкти не будуть при однаковій температурі.

Термохімія - це дослідження енергетичних змін, що відбуваються під час хімічних реакцій і під час зміни стану. Коли відбуваються хімічні реакції, деякі хімічні зв'язки розриваються, в той час як утворюються нові хімічні зв'язки. В результаті перестановки атомів загальна хімічна потенційна енергія системи або збільшується, або зменшується.
Екзотермічні та ендотермічні процеси
Коли відбуваються фізичні або хімічні зміни, вони, як правило, супроводжуються передачею енергії. Закон збереження енергії говорить, що в будь-якому фізичному або хімічному процесі енергія не створюється і не руйнується. Іншими словами, вся енергія у Всесвіті зберігається. Для того, щоб краще зрозуміти енергетичні зміни, що відбуваються під час реакції, нам потрібно визначити дві частини Всесвіту, які називаються системою і оточенням. Система - це конкретна частина речовини в даному просторі, яка вивчається під час експерименту або спостереження. Оточення - це все у Всесвіті, що не є частиною системи. У практичному плані для лабораторного хіміка система, як правило, є реакцією, що досліджується, тоді як оточення включає в себе безпосередню близькість у приміщенні. Під час більшості процесів відбувається обмін енергією між системою і навколишнім середовищем. Якщо система втрачає певну кількість енергії, то таку ж кількість енергії отримує оточення. Якщо система отримує певну кількість енергії, ця енергія постачається навколишнім середовищем.
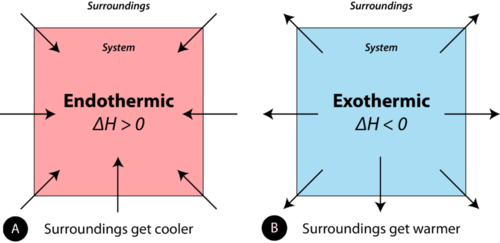
При вивченні термохімічних процесів речі розглядаються з точки зору системи. Хімічна реакція або фізичні зміни є ендотермічними, якщо тепло поглинається системою з навколишнього середовища. В ході ендотермічного процесу система отримує тепло від навколишнього середовища, тому температура навколишнього середовища знижується. Кількість тепла для процесу представлена буквоюq. Ознакаq для ендотермічного процесу є позитивним, оскільки система набирає тепло. Хімічна реакція або фізичні зміни є екзотермічними, якщо тепло виділяється системою в навколишнє середовище. Оскільки оточення набирає тепло від системи, температура оточення збільшується. Ознакаq для екзотермічного процесу негативний, оскільки система втрачає тепло. Різниця між ендотермічною реакцією і екзотермічною реакцією проілюстрована нижче (див. Малюнок нижче).
Одиниці теплопостачання
Тепловий потік вимірюється в одній з двох загальних одиниць: калорійність і джоуль. Джоуль(J) - одиниця СІ енергії. Калорійність знайома, оскільки вона зазвичай використовується при зверненні до кількості енергії, що міститься в їжі. Калорійність(cal) - це кількість тепла, необхідне для підвищення температури 1 грама води на1oC. Наприклад, підвищення температури води100g від20oC до22oC зажадає100×2=200cal.
Калорії, що містяться в їжі, насправді є кілокалоріями(kcal). Іншими словами, якщо певна закуска містить 85 калорій їжі, вона насправді містить85kcal або85,000cal. Для того, щоб зробити різницю, дієтична калорія пишеться з великої літери С.
1kilocalorie=1Calorie=1000calories
Сказати, що закуска «містить» 85 калорій означає, що85kcal енергія виділяється, коли ця закуска обробляється вашим організмом.
Теплові зміни в хімічних реакціях зазвичай вимірюються в джоулів, а не в калоріях. Перетворення між джоулем і калорією показано нижче.
1J=0.2390calor1cal=4.184J
Приклад6.1.1
Скільки джоулів енергії виділяється при 400. Калорійність гамбургера перетравлюється?
Рішення
Використовуйте співвідношення між калоріями та калоріями, що становить 1000 калорій= 1 Калорія та коефіцієнт перетворення джоулів в калорії, щоб знайти значення в джоулі. Зверніть увагу, що всі одиниці скасовуються, крім джоулів, про що запитують у питанні.
400Cal(1000cal1Cal)(4.184J1cal)=1.67×106J
Теплоємність і питома теплоємність
Якби басейн і відро, обидва наповнені водою з однаковою температурою, піддавалися однаковому введенню теплової енергії, відро води, безумовно, підніметься температура швидше, ніж басейн. Теплоємність - це кількість тепла, необхідне для підвищення температури об'єкта на1oC. Теплоємність об'єкта залежить як від його маси, так і від хімічного складу. Через свою набагато більшої маси басейн з водою має більшу теплоємність, ніж відро з водою.
Різні речовини реагують на тепло по-різному. Якщо металевий стілець сидить на яскравому сонці в спекотний день, він може стати досить гарячим на дотик. Рівна маса води на одному сонці не стане майже такою ж гарячою. Вода дуже стійка до перепадів температури, в той час як метали взагалі немає. Питома теплоємність речовини - це кількість енергії, необхідної для підвищення температури 1 грама речовини на1oC. У таблиці нижче перерахована питома теплоємність деяких поширених речовин. Символ питомої теплоти єCp, при цьомуp індекс посилається на те, що питомі теплоти вимірюються при постійному тиску. Одиниці для питомої теплоти можуть бути або джоулі на грам на градус(J/g⋅oC), або калорії на грам на градус(cal/g⋅oC). Цей текст буде використовуватисяJ/g⋅oC для питомої теплоти. Зверніть увагу, що питома теплоємність речовини залежить не тільки від його ідентичності, але і його стану. Наприклад, лід, рідка вода та пара мають різні питомі теплові значення.
Таблиця6.1.1: Питома теплота деяких поширених речовин
| Речовина | Питома теплоємність(J/g⋅oC) |
| Вода(l) | 4.18 |
| Вода(s) | 2.06 |
| Вода(g) | 1.87 |
| Аміак(g) | 2.09 |
| Етанол(l) | 2.44 |
| Алюміній(s) | 0,897 |
| Вуглець, графіт(s) | 0.709 |
| Мідь(s) | 0,385 |
| Золотий(s) | 0.129 |
| Залізо(s) | 0,449 |
| Свинець(s) | 0.129 |
| Меркурій(l) | 0.140 |
| Срібло(s) | 0,233 |
Зверніть увагу, що вода має дуже високу питому теплоту в порівнянні з більшістю інших речовин. Вода зазвичай використовується в якості теплоносія для машин, оскільки вона здатна поглинати велику кількість тепла (див. Малюнок нижче). Прибережний клімат набагато помірніший, ніж внутрішній клімат через наявність океану. Вода в озерах або океанах поглинає тепло з повітря в спекотні дні і випускає його назад в повітря в прохолодні дні.

Розрахунки питомої теплоти
Питома теплоємність речовини може бути використана для розрахунку зміни температури, яку зазнає дана речовина при нагріванні або охолодженні. Рівняння, яке пов'язує(q) теплоту з питомою(m) теплотою(Cp), масою та(ΔT) зміною температури, показано нижче.
q=m×Cp×ΔT
Тепло, яке або поглинається, або виділяється, вимірюється в джоулі. Маса вимірюється в грамах. Зміна температури задається тимΔT=Tf−Ti, деTf кінцева температура іTi початкова температура.
Приклад6.1.2
15.0gШматок кадмієвого металу поглинає134J тепло при підвищенні його температури від24.0oC до62.7oC. Розрахуйте питому теплоємність кадмію.
Рішення
Крок 1: Перерахуйте відомі величини та плануйте проблему.
Відомий
- Тепло=q=134J
- Маса=m=15.0g
- ΔT=62.7oC−24.0oC=38.7oC
Невідомий
- Cpкадмію=?J/g⋅oC
Питоме рівняння теплоємності можна переставити для вирішення для питомої теплоти.
Крок 2: Вирішіть.
Cp=qm×ΔT=134J15.0g×38.7oC=0.231J/g⋅oC
Крок 3: Подумайте про свій результат.
Питома теплоємність кадмію, металу, досить близька до питомих нагрівань інших металів в таблиці вище. Результат має три значущі цифри.
Оскільки більшість питомих нагрівань відомі, їх можна використовувати для визначення кінцевої температури, досягнутої речовиною при його нагріванні або охолодженні. Припустимо, що60.0g проба води при23.52oC охолоджувалася813J відведенням тепла. Зміна температури можна обчислити за допомогою питомого рівняння тепловіддачі.
ΔT=qCp×m=−813J4.18J/g⋅oC×60.0g=−3.24oC
Так як вода охолоджувалася, з системи відводиться тепло. Томуq негативний, і температура знижується. Кінцева температура становить:
Tf=23.52oC−3.24oC=20.28oC
Додаткові ресурси
- Енергія в хімічних реакціях: http://www.wisc-online.com/Objects/V...spx? ІДЕНТИФІКАТОР = ГЧ8705