5.5: Властивості сполук (вправи)
- Page ID
- 22773
Це домашні вправи для супроводу глави 5 Університету Кентуккі LibreText для CHE 103 - Хімія для здоров'я союзників. Рішення доступні нижче питань.
Питання
(натисніть тут для вирішення)
Q5.1.1
Визначте ізомер.
Q5.1.2
Обведіть хіральні вуглеці в кожній структурі.
| а. |  |
| б. |  |
| c. |  |
| д. |  |
| е. |  |
| ф. |  |
| г. |  |
| ч. |  |
| я. |  |
| Дж. |  |
Q5.1.3
Визначте, чи може кожна молекула мати геометричний ізомер.
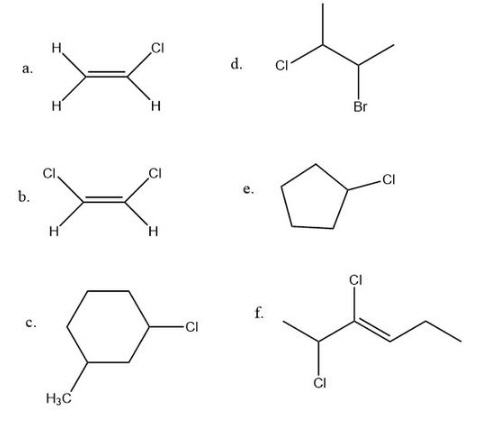
Q5.1.4
Для кожної пари визначте, чи є вони ізомерами. Якщо вони ізомери, визначте тип.
| а. |  |
 |
| б. |  |
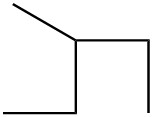 |
| c. | 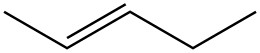 |
 |
| д. |  |
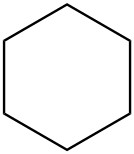 |
| е. | 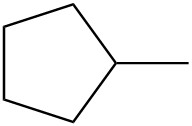 |
 |
| ф. | 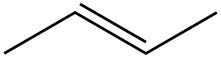 |
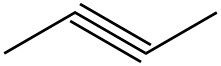 |
| г. | 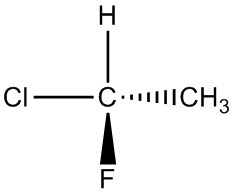 |
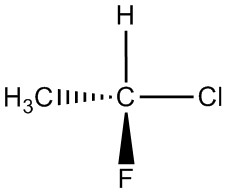 |
| ч. | 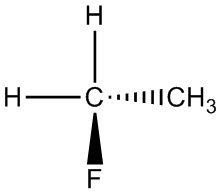 |
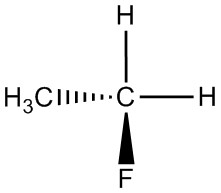 |
Q5.1.5
Намалюйте два ізомери за формулою C 2 H 6 O
(натисніть тут для вирішення)
Q5.2.1
Моносахарид має 4 атома вуглецю. Яка його хімічна формула?
Q5.2.2
Які відмінності між моносахаридами, дисахаридами, олігосахаридами та полісахаридами?
Q5.2.3
Порівняйте і контрастуйте прості і складні вуглеводи.
Q5.2.4
Намалюйте кожну з наступних структур.
- альдогептоза
- кетопентоза
- альдотріоз
- кетотетроза
Q5.2.5
Намалюйте проекції Фішера двох альдогексоз, які відрізняються від чотирьох, наведених на малюнку 5.2.3.
Q5.2.6
Намалюйте енантіомери D-глюкози, D-аллози, D-маннози та D-галактози. (Див. Малюнок 5.2.3).
Q5.2.7
Визначте, чи є кожна з наступних пар діастереомерами? Епімери? (Подивіться структури в розділі або в Інтернеті.)
- D-глюкоза і D-аллоза
- D-глюкоза і D-галактоза
- D-аллоза і D-манноза
- D-аллоза і D-галактоза
Q5.2.8
Для кожної з заданих структур Хаворта визначте цукор як знаходиться у формі α або β.
| а. | 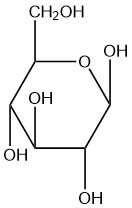 |
| б. | 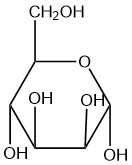 |
| c. | 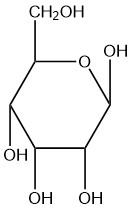 |
| д. | 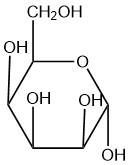 |
| е. | 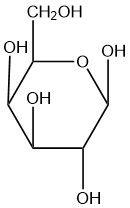 |
Q5.2.9
Відповідаючи на ці питання, зверніться до малюнка 5.2.7.
- Яка група крові є універсальним донором? Чому?
- Яка група крові є універсальним акцептором? Чому?
- Кров типу А можна здати реципієнтам з якими видами крові?
- Реципієнти типу В можуть приймати які типи крові?
Q5.3.1
Визначте електронегативність.
Q5.3.2
Охарактеризуйте періодичні тенденції для значень електронегативності.
Q5.3.3
Розрізняють неполярні і полярні ковалентні зв'язки.
Q5.3.4
Опишіть зв'язок між кожною парою елементів як іонний, полярний ковалентний або неполярний ковалентний. Відповідаючи на це питання, зверніться до таблиці 5.3.1. Для іспиту, якщо потрібні конкретні значення, буде надана таблиця значень електронегативності. Зверніть увагу, що на багато питань можна відповісти без таблиці, знаючи періодичні тенденції.
- Н і О
- С і П
- Si і Cl
- Ал і Ф
- Аль і я
- П і С
- С і Н
- B і Cl
- Be і Br
- Сі і П
Q5.3.5
Помістіть наступні зв'язки в порядку від найменшого до найбільш полярного. Відповідаючи на це питання, зверніться до таблиці 5.3.1.
- Фе-Н
- H-Cl
- Са-О
- С-С
Q5.3.6
Помістіть наступні зв'язки в порядку від найменшого до найбільш полярного. Використовуйте періодичні тенденції для визначення правильного порядку, не дивлячись на значення електронегативності.
- пКл
- ScL
- ПБр
- CBR
Q5.3.7
Позначте кожну з молекул як неполярну або полярну ковалентну.
- СО 2
- ККл 4
- NH 3
Q5.3.8
Опишіть типи молекул, що володіють наступними типами міжмолекулярних сил.
- Лондон розсіювання сил
- дипольно-дипольні сили
- водневий зв'язок
Q5.3.9
Чому міжмолекулярні сили в H 2 O і H 2 S так відрізняються один від одного?
Q5.3.10
Який тип (и) міжмолекулярних сил присутні в кожній з молекул в питанні 5.3.7?
Q5.3.11
Яка залежність між силою міжмолекулярних сил в молекулі і температурою її кипіння?
Q5.3.12
Оцініть наступне в порядку збільшення (найменшої до найбільшої) температури кипіння.
- N 2
- СН 3 ОН
- РН 3
Q5.4.1
Визначте хроматографію.
Q5.4.2
Перерахуйте два види хроматографії.
Q5.4.3
Розрізняють стаціонарну і рухливу фази.
Відповіді
5.1: Ізомери
Q5.1.1
Ізомери - це молекули з тією ж хімічною формулою, але з різною структурою або розташуванням атомів.
Q5.1.2
Обведіть хіральні вуглеці в кожній структурі.
| а. | 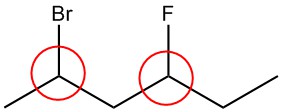 |
| б. | 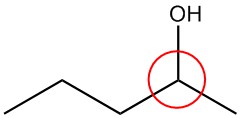 |
| c. | Немає хіральних вуглеців |
| д. | Немає хіральних вуглеців |
| е. | 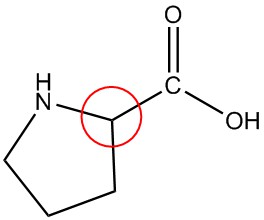 |
| ф. | 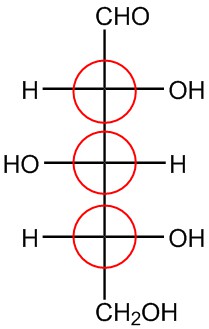 |
| г. | Ніяких хіральних вуглеців. |
| ч. | 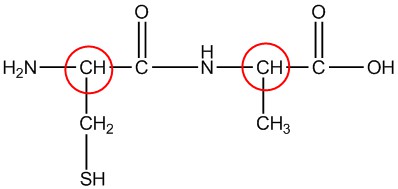 |
| я. | 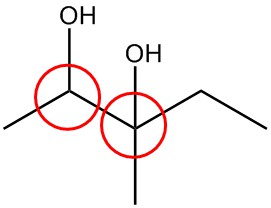 |
| j. | 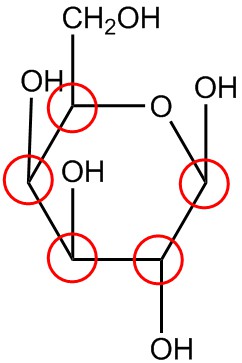 |
Q5.1.3
- Ні, через двох атомів Н на лівій стороні подвійного зв'язку.
- Так, тому що атоми хлору показані транс, але можуть бути намальовані цис.
- Так, тому що дві групи можуть перебувати на одній стороні кільця або з протилежних сторін.
- Ні, тому що вам потрібна подвійна зв'язок або кільце, щоб мати геометричний ізомер.
- Ні, тому що на кільці є тільки одна неводнева група.
- Так, тому що кожен вуглець у подвійному зв'язку має дві різні групи, тому його можна охарактеризувати як цис або транс.
Q5.1.4
Для кожної пари визначте, чи є вони ізомерами. Якщо вони ізомери, визначте тип.
- структурний
- конформаційний
- не ізомери
- структурний
- структурний
- не ізомери
- енантіомери
- та ж молекула
Q5.1.5
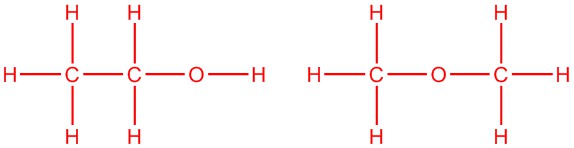
5.2: Вуглеводні структури
Q5.2.1
С 4 Ч 8 З 4
Q5.2.2
Моносахариди являють собою єдину молекулу вуглеводів. Дисахариди мають дві молекули вуглеводів, з'єднані між собою. Полісахариди мають три і більше молекул вуглеводів, з'єднаних між собою.
Q5.2.3
Прості вуглеводи є моносахаридами або дисахаридами і легко розщеплюються в організмі. Складні вуглеводи - це полісахариди, такі як крохмалі та клітковина, і вони займають більше часу, щоб розщеплюватися в організмі.
Q5.2.4
Відповіді будуть відрізнятися залежно від орієнтації H і OH на кожному хіральному вуглецю.
| а. | 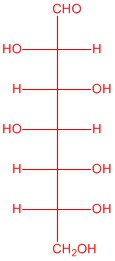 |
| б. | 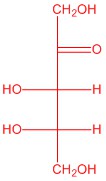 |
| c. | 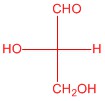 |
| д. | 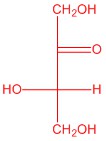 |
Q5.2.5
Будь-які дві структури, показані тут червоним кольором. Структури в чорному кольорі - з малюнка 5.2.3.
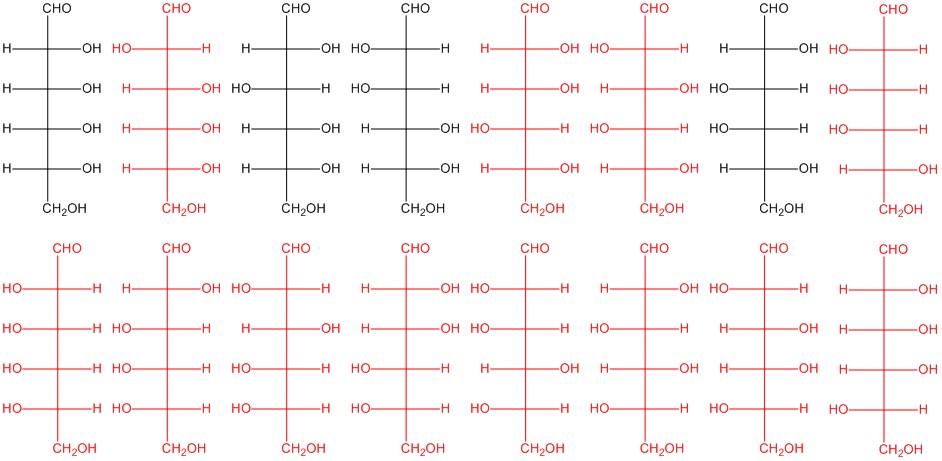
Q5.2.6
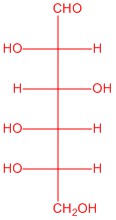 |
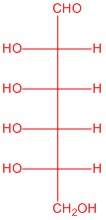 |
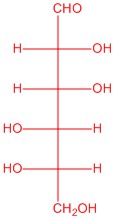 |
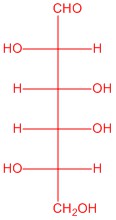 |
| L-глюкоза | L-аллоза | L-манноза | L-галактоза |
Q5.2.7
- Епімери тому, що орієнтація відрізняється у одного хірального вуглецю.
- Діастереомери, оскільки орієнтація відрізняється на множинних (але не всіх) хіральних вуглецях.
- Діастереомери, оскільки орієнтація відрізняється на множинних (але не всіх) хіральних вуглецях.
- Діастереомери, оскільки орієнтація відрізняється на множинних (але не всіх) хіральних вуглецях.
Q5.2.8
- бета
- альфа
- бета
- альфа
- бета
Q5.2.9
- Або тому, що в ньому найменша кількість видів вуглеводів.
- AB, оскільки він має всі вуглеводи, знайдені на еритроцитах.
- А може дати A або AB.
- Б може отримати B або O.
5.3: Полярність і міжмолекулярні сили
Q5.3.1
Електронегативність - це тяжіння атома до електрона в зв'язку.
Q5.3.2
Електронегативність збільшується зліва направо і знизу вгору з максимумом у фтору.
Q5.3.3
Неполярні ковалентні зв'язки мають навіть спільне використання електронів між атомами, тоді як полярні електрони поділяють електрони нерівномірно.
Q5.3.4
- полярний
- неполярний
- полярний
- іонних
- полярний
- неполярний
- полярний
- полярний
- полярний
- неполярний
Q5.3.5
С-С < H-Cl < Fe-N < Са-О
Обчисліть різницю в електронегативності для кожного зв'язку. Чим менше різниця, тим більше неполярна; чим більша різниця, тим полярніше. Якщо зв'язок має досить велику різницю, вона настільки полярна, що вважається іонною.
Q5.3.6
S-Cl < P-Cl < Р-Br < С-Br
- S і Cl є найближчими разом, тому вони матимуть найменшу різницю в електронегативності і будуть найменш полярними.
- S-Cl і P-Cl можна порівняти, оскільки вони мають спільний елемент. P далі лівіше S, тому електронегативність P повинна бути меншою, ніж у S. Тому різниця між P і Cl повинна бути більшою, ніж різниця між S і Cl, оскільки ми порівнюємо їх обидва з одним елементом (Cl).
- Порівняйте P-Cl і P-Br. Оскільки Br знаходиться далі по таблиці Менделєєва, він має більш низьке значення електронегативності, ніж Cl. Тому різниця між P і Cl менше різниці між P і Br. P-Br більш полярний, ніж P-Cl.
- Порівняйте P-Br і С-Br. C знаходиться далі від Br, ніж P, тому різниця в електронегативності більша для C-Br, ніж P-Br, що робить C-Br більш полярним зв'язком.
Q5.3.7
- неполярний
- неполярний
- полярний
 |
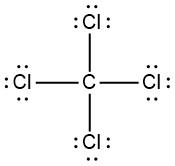 |
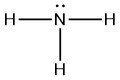 |
Q5.3.8
- всі молекули
- полярні молекули
- молекули з H зв'язаним з F, O або N, який притягується до F, O або N на іншій молекулі
Q5.3.9
H 2 O має водневий зв'язок, тоді як H 2 S - ні.
Q5.3.10
- дисперсія
- дисперсія
- дисперсія, диполь-дипольний та водневий зв'язок
Q5.3.11
Чим сильніше міжмолекулярні сили, тим вище температура кипіння.
Q5.3.12
N 2 < РН 3 < СН 3 ОН
Всі три з цих молекул можна порівняти за розмірами, тому відмінності в силах дисперсії невеликі. N 2 неполярний і має тільки сили розсіювання. РН 3 є полярним, тому він має дисперсійні та дипольно-дипольні сили, але не має водневого зв'язку. CH 3 OH має дисперсійні, дипольно-дипольні та водневі сили зв'язку.
Q5.4.1
Хроматографія використовується для поділу суміші на її компоненти, коли вони рухаються з різною швидкістю в рухомій фазі.
Q5.4.2
Папір, тонкошарова, рідка та газова - найвідоміші види хроматографії
Q5.4.3
Рухлива фаза - це рідина, яка рухається по стаціонарній фазі. Стаціонарна фаза утримує зразок до тих пір, поки рухлива фаза не переміщує його по стаціонарній фазі.