2.6: Іонні сполуки
- Page ID
- 23092
Результати навчання
- Опишіть типи елементів, що утворюють іонний зв'язок.
- Поясніть, як утворюється іонний зв'язок.
- Передбачте формулу іонного з'єднання.
Хімію можна в цілому розділити на два основних класи, виходячи з ідентичності елементів, присутніх в хімічних сполуках. Органічна хімія - це галузь хімії, яка займається сполуками, що містять вуглець. У цьому розділі та наступному ми будемо обговорювати неорганічну хімію, яка є галуззю хімії, що займається сполуками, які не містять вуглецю. Іонні сполуки є прикладами неорганічних сполук.
Типи формул
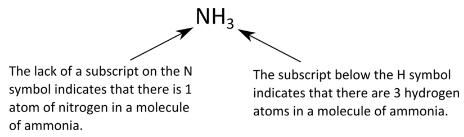
Нагадаємо, що молекули включають в себе два або більше атомів, які були хімічно об'єднані. Хімічна формула, яка вказує, скільки кожного типу атома присутні в одній молекулі, називається молекулярною формулою. Наприклад, молекула аміаку містить один атом азоту і три атома водню, тому вона має наступну молекулярну формулу.
Інший тип хімічної формули, емпірична формула, показує елементи сполуки в їх найнижчому співвідношенні цілого числа. Глюкоза - важливий простий цукор, який клітини використовують в якості свого основного джерела енергії. Його молекулярна формула є\(\ce{C_6H_{12}O_6}\). Так як кожен з індексів ділиться на 6, емпірична формула глюкози є\(\ce{CH_2O}\). Коли хіміки аналізують невідоме з'єднання, часто першим кроком стає визначення його емпіричної формули. Існує безліч сполук, молекулярні та емпіричні формули яких однакові. Якщо молекулярна формула не може бути спрощена до меншого співвідношення цілого числа, як у випадку\(\ce{H_2O}\) або\(\ce{P_2O_5}\), то емпірична формула також є молекулярною формулою.
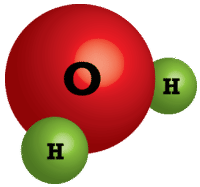
На відміну від молекулярних сполук, іонні сполуки досить різні. Вода та інші молекули існують як колекції окремих молекул (див. Малюнок нижче), тоді як іонні сполуки не існують як дискретні молекулярні одиниці. Натомість іонна сполука складається з великого тривимірного масиву чергуються катіонів і аніонів. Наприклад, хлорид натрію\(\left( \ce{NaCl} \right)\) складається з багатьох\(\ce{Cl^-}\) іонів, розташованих у\(\ce{Na^+}\) структурі, подібній до зображеної (див. Малюнок нижче). Формула для іонних сполук завжди є емпіричною формулою, оскільки вона показує найменше співвідношення цілого числа між катіонами та аніонами. Фактична кількість іонів у зразку іонної сполуки буде дуже великою і буде варіюватися від зразка до зразка.

Найпростіший спосіб описати цю структуру за допомогою хімічної формули - дати найнижче співвідношення цілого числа між двома іонами. У випадку з\(\ce{NaCl}\), в кристалі солі є однакова кількість іонів натрію і хлориду іонів. На відміну від цього, кристал хлориду магнію має вдвічі більше іонів хлориду, ніж іони магнію, тому він має формулу\(\ce{MgCl_2}\).
Написання формул для бінарних іонних сполук
Якщо ви знаєте елементи, що утворюють двійкове іонне з'єднання, можна написати його формулу. Почніть з написання іона металу та його заряду, а потім неметалевий іон з його зарядом. Оскільки загальна сполука повинна бути електрично нейтральною, вирішіть, скільки іонів кожного типу потрібно для того, щоб позитивні та негативні заряди скасували один одного. Розглянемо з'єднання нітриду алюмінію. Заряди на кожному з цих іонів можна визначити, подивившись на групи, в яких знаходяться алюміній і азот, по таблиці Менделєєва. До іонів відносяться:
\[\ce{Al^{3+}} \: \: \: \: \: \: \: \: \: \: \ce{N^{3-}}\]
Оскільки іони мають заряди, рівні за величиною (3, але різні ознаки), 1:1 - це найнижче співвідношення іонів, яке буде виробляти нейтральну сполуку. Так як заряд на алюмінії дорівнює 3+, а заряд на азоті є\(3-\), то сума їх зарядів дорівнює нулю (\(+3\;+\; -3=0\)). В результаті формулу нітриду алюмінію є\(\ce{AlN}\). Інша сполука, оксид літію, містить наступні іони:
\[\ce{Li^+} \: \: \: \: \: \: \: \: \: \: \ce{O^{2-}}\]
При цьому два іони літію, кожен із зарядом 1+, необхідні для збалансування заряду кожного іона оксиду, який має\(2-\) заряд. Формула оксиду літію полягає в\(\ce{Li_2O}\) тому, що з'єднання повинно бути нейтральним. Тому,\(\left( 2\times+1\right) \;+\left( 1\times -2\right)=0\).
Для з'єднань, в яких співвідношення іонів не так очевидно, альтернативним способом визначення правильної формули є використання методу «перехресного». У цьому методі числове значення кожного заряду перетинається, щоб стати індексом протилежного іона. Ознаки звинувачень скинуті. Метод перехресного перехрестя продемонстрований нижче для оксиду алюмінію.
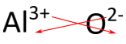
Червоні стрілки вказують на те, що 3 від\(3+\) заряду перетинаються, щоб стати індексом для\(\ce{O}\), тоді як 2 від\(2-\) заряду перетинаються, щоб стати індексом для\(\ce{Al}\). Формула оксиду алюмінію є\(\ce{Al_2O_3}\).
Для оксиду алюмінію метод перехресного хреста безпосередньо видає правильну формулу, але в деяких випадках потрібно ще один крок. Оскільки іонні сполуки завжди описуються їх емпіричними формулами, вони повинні бути записані як найнижче співвідношення цілого числа іонів. У випадку з нітридом алюмінію, перехресний метод дасть формулу\(\ce{Al_3N_3}\), яка не є правильною. Повинен бути виконаний другий крок, при якому індекси зменшуються, але співвідношення зберігається однаковим. \(\ce{Al_3N_3}\)можна звести до\(\ce{AlN}\), тому що обидві формули описують співвідношення іонів алюмінію до іонів нітриду 1:1. Після перехресного методу написання формули оксиду свинцю (IV) буде включати наступні кроки:
Деякі перехідні метали можуть мати більше одного можливого заряду. Коли це відбувається, заряд на катіоні перехідного металу включається в дужки в назві. Наприклад, оксид свинцю (IV) має\(\ce{Pb^{4+}}\) як катіон металу.
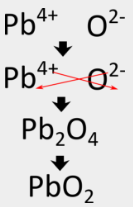
Метод перехресного хреста спочатку дає\(\ce{Pb_2O_4}\) формулу, але це потрібно звести до того\(\ce{PbO_2}\), що є правильною формулою.
Написання формул для іонних сполук, що містять багатоатомні іони
Написання формули для іонного з'єднання з багатоатомними іонами передбачає ті ж кроки, що і для двійкового (двоелементного) іонного з'єднання. Напишіть символ і заряд катіона, а потім символ і заряд аніона. Використовуйте метод перехресного хреста, щоб переконатися, що остаточна формула нейтральна. Нітрат кальцію складається з катіонів кальцію і нітратних аніонів.

Заряд врівноважується наявністю двох нітратних іонів і одного іона кальцію. Круглі дужки використовуються навколо нітратного іона, оскільки потрібно більше одного багатоатомного іона. Якщо у формулі присутній лише один багатоатомний іон, дужки не використовуються. Наприклад, формула карбонату кальцію є\(\ce{CaCO_3}\). Карбонатний іон несе\(2-\) заряд, тому він точно врівноважує\(2+\) заряд іона кальцію і дужки не потрібні навколо багатоатомного іона.
Приклад\(\PageIndex{1}\)
Напишіть формулу фосфату цинку, яка складається з\(PO_4^{3-}\) іонів\(Zn^{2+}\) і.
Рішення
Запишіть катіон металу, а потім неметалевий аніон. Перехрестіть іонні заряди, щоб зробити іонну сполуку нейтральною. Використовуйте дужки навколо багатоатомного іона, якщо в остаточній формулі присутній більше одного. Зменшіть до найнижчого коефіцієнта, якщо це необхідно.
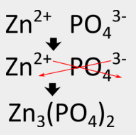
Формула фосфату цинку є\(\ce{Zn_3(PO_4)_2}\). Три катіони цинку із\(2+\) зарядами врівноважують два фосфатних аніони із\(3-\) зарядами.