2.4: Електронні домовленості
- Page ID
- 23064
Результати навчання
- Визначте енергетичні рівні електронів для перших 20 елементів.
- Поясніть актуальність валентних електронів в хімічних процесах.
- Визначте кількість валентних електронів в елементі.
- Опишіть стабільність атома в результаті дотримання правила октета.
Будова атома обговорювалося в попередній одиниці і зараз зупинимося на ролі, яку відіграють електрони в утворенні сполук. Незалежно від типу сполуки або кількості задіяних атомів або електронів, саме електрони тих атомів взаємодіють, утворюючи сполуку.
Розташування електронів
Електрони не випадково розташовані в атомі, і їх положення всередині атома можна описати за допомогою електронних домовленостей, які є спрощеною версією електронних конфігурацій. Для кожного цікавого елемента ми дивимося на кількість електронів в одному атомі, а потім визначаємо, як ці електрони розташовані на основі атомної моделі. Основна ідея електронних домовленостей полягає в тому, що електрони можуть існувати лише на певних енергетичних рівнях. Розуміючи енергетичні рівні електронів в атомі, ми можемо передбачити властивості і зрозуміти поведінку атома.
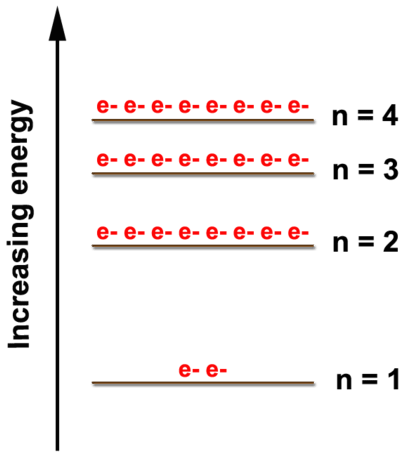
Як показано на малюнку нижче, існує кілька енергетичних рівнів, де можна знайти електрони. Зі збільшенням енергетичного рівня різниця між ними зменшується. Максимум два електрони можна знайти на\(n=1\) рівні; вісім електронів можуть бути в\(n=2\) рівні. Хоча\(n=4\) рівні\(n=3\) та показують лише вісім електронів на цій діаграмі, ці рівні енергії можуть триматися більше, але не до тих пір, поки ми не почнемо дивитися на перехідні метали. Ми будемо стосуватися лише електронного розташування елементів через кальцій,\(\left( Z = 20 \right)\) тому ми поставимо максимум вісім електронів на\(n=3\) рівні та два на\(n=4\) рівні.
Приклад\(\PageIndex{1}\)
Що таке електронне розташування кисню?
Рішення
Кисень має вісім електронів. Перші два електрони підуть в\(n=1\) рівень. Два - це максимальна кількість електронів для рівня, тому інші електрони повинні будуть йти на більш високому енергетичному рівні. \(n=2\)Рівень може вмістити до восьми електронів, тому решта шість електронів підуть на\(n=2\) рівні. Електронне розташування кисню становить (2, 6).
Приклад\(\PageIndex{2}\)
Що таке електронне розташування хлору?
Рішення
Хлор має 17 електронів. Перші два електрони підуть в\(n=1\) рівень. Два - це максимальна кількість електронів для рівня, тому інші електрони повинні будуть йти на більш високих енергетичних рівнях. \(n=2\)Рівень може утримувати до восьми електронів, тому наступні 8 електронів підуть на\(n=2\) рівні. Решта 7 електронів можуть йти на\(n=3\) рівні, так як він утримує максимум 8 електронів. Електронне розташування хлору становить (2, 8, 7).
Електронне розташування також дає інформацію про кількість валентних електронів. Валентні електрони - це електрони на найвищому енергетичному рівні та ті, які беруть участь у утворенні іонів та зв'язків. Знання кількості валентних електронів дозволить передбачити, як той чи інший елемент буде взаємодіяти з іншими елементами. Електрони в нижчих енергетичних рівнях називаються електронами ядра.
Давайте розглянемо малюнок нижче, на якому показана електронна діаграма магнію і його 12 електронів. Перші два електрони знаходяться в\(n=1\) енергетичному рівні, наступні вісім електронів знаходяться в\(n=2\) рівні, а решта два електрона знаходяться в\(n=3\) рівні. Електрони завжди заповнюють найнижчі рівні енергії, доступні до тих пір, поки цей рівень не заповниться, а потім електрони заповнюють наступний енергетичний рівень, поки він не заповниться. Це триває для всіх електронів в атомі. Ми можемо показати розташування електронів як (2, 8, 2), що представляють електрони в\(n=1\)\(n=2\), і\(n=3\) рівні відповідно.
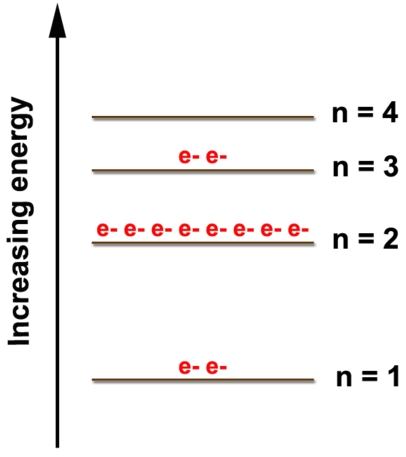
Електронне розташування також показує кількість валентних електронів, яка є двома для магнію, оскільки в\(n=3\) енергетичному рівні є два електрони, який є найвищим займаним рівнем енергії для магнію. Це відповідає\(2+\) заряду, що утворюється при утворенні магнію іона. Він готовий втратити 2 електрони, щоб він мав ті ж електронні композиції, що і найближчий благородний газ, який є неоном (2, 8). Атоми отримають або втратять електрони, щоб виглядати як найближчий благородний газ, оскільки благородні гази нереактивні через стабільність наявності восьми електронів на найвищому енергетичному рівні. Це прагнення атомів мати вісім електронів у своїй зовнішній оболонці відоме як правило октету.
Приклад\(\PageIndex{3}\)
Що таке електронне розташування алюмінію? Скільки валентних електронів він має?
Рішення
Алюміній має 13 електронів, тому він матиме електронне розташування (2, 8, 3), яке представляє два електрони на рівні\(n=1\) енергії, вісім електронів на\(n=2\) рівні та три електрони на\(n=3\) рівні. Алюміній має три валентних електрона (позначаються трьома електронами на\(n=3\) рівні).
Приклад\(\PageIndex{4}\)
Скільки валентних електронів має хлор? Скільки електронів хлор набирає або втратить, утворюючи іон?
Рішення
Хлор має в своїй валентній оболонці 7 електронів. Щоб відповідати правилу октета, він повинен або набрати один електрон, або втратити сім електронів. Отримати один легше, ніж втратити сім, тому він отримає один електрон, щоб мати загалом вісім електронів, коли він утворює іон (тобто заряджену частку).