2.1: Ізотопи та атомна маса
Результати навчання
- Визначте атомні та масові числа.
- Визначте кількість протонів, нейтронів і електронів в атомі.
- Визначте заряд і відносну масу субатомних частинок.
- Позначте розташування субатомних частинок в атомі.
- Визначте ізотоп.
- Напишіть ізотопний символ атома.
- Поясніть поняття середньої атомної маси.
Атоми є основними будівельними блоками всієї матерії і складаються з протонів, нейтронів та електронів. Оскільки атоми електрично нейтральні, кількість позитивно заряджених протонів має дорівнювати числу негативно заряджених електронів. Оскільки нейтрони не впливають на заряд, кількість нейтронів не залежить від кількості протонів і буде варіюватися навіть серед атомів одного і того ж елемента.
Атомний номер
Атомний номер (Z) елемента - це кількість протонів в ядрі кожного атома цього елемента. Атом можна класифікувати як конкретний елемент, виходячи виключно з його атомного номера. Наприклад, будь-який атом з атомним номером 8 (його ядро містить 8 протонів) є атомом кисню, а будь-який атом з різною кількістю протонів був би іншим елементом. Таблиця Менделєєва (див. Малюнок нижче) відображає всі відомі елементи і розташована в порядку збільшення атомного номера. У цій таблиці над символом елемента вказано атомний номер елемента. Водень, у верхньому лівому куті таблиці, має атомний номер 1. Кожен атом водню має один протон у своєму ядрі. Далі на столі знаходиться гелій, атоми якого мають два протони в ядрі. Атоми літію мають три протони, атоми берилію - чотири і так далі.
Оскільки атоми нейтральні, кількість електронів в атомі дорівнює кількості протонів. Всі атоми водню мають один електрон, який займає простір поза ядром. Гелій, з двома протонами, матиме два електрони.
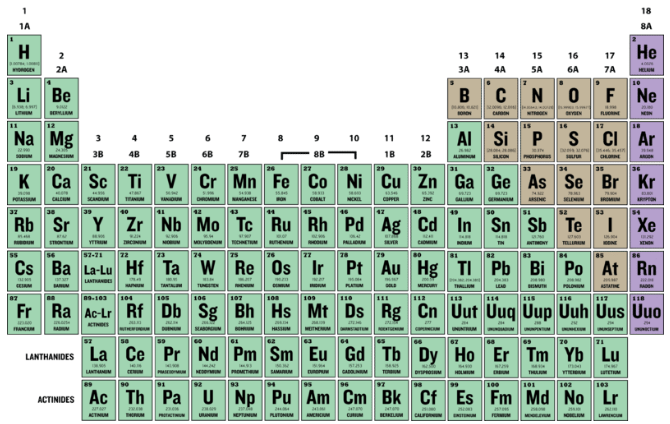
Масове число
Експериментальні дані показали, що переважна більшість маси атома зосереджена в його ядрі, яке складається з протонів і нейтронів. Масове число визначається як загальна кількість протонів і нейтронів в атомі. Розглянемо таблицю нижче, в якій наведені дані з перших шести елементів таблиці Менделєєва.
| Ім'я | Символ | Атомний номер | протони | Нейтрони | Електрони | Масове число |
|---|---|---|---|---|---|---|
| водню | H | 1 | 1 | 0 | 1 | 1 |
| гелій | He | 2 | 2 | 2 | 2 | 4 |
| літію | Li | 3 | 3 | 4 | 3 | 7 |
| берилію | Be | 4 | 4 | 5 | 4 | 9 |
| бор | B | 5 | 5 | 6 | 5 | 11 |
| вуглець | C | 6 | 6 | 6 | 6 | 12 |
Переглянути анімації, що показують атомну структуру перших 11 елементів у таблиці Менделєєва за адресою http://web.visionlearning.com/custom...imations.shtml
Розглянемо елемент гелій. Його атомний номер дорівнює 2, тому в ядрі він має два протони. Його ядро також містить два нейтрони. Так як2+2=4, ми знаємо, що масове число атома гелію дорівнює 4. Нарешті, атом гелію також містить два електрони, так як кількість електронів має дорівнювати числу протонів. Цей приклад може привести вас до думки, що атоми мають однакову кількість протонів і нейтронів, але подальше вивчення таблиці вище покаже, що це не так. Літій, наприклад, має три протони і чотири нейтрона, що дає йому масове число 7.
Знання числа маси і атомного номера атома дозволяє визначити кількість нейтронів, присутніх в цьому атомі шляхом віднімання.
Number of neutrons=mass number−atomic number
Атоми елемента хрому(Cr) мають атомний номер 24 і масове число 52. Скільки нейтронів в ядрі атома хрому? Щоб визначити це, ви віднімаєте, як показано:
52−24=28neutrons in a chromium atom
Склад будь-якого атома можна проілюструвати стенографічним позначенням з використанням атомного номера і числа маси. Обидва написані перед хімічним символом, з масовим числом, записаним у вигляді верхнього індексу, а атомний номер записується як індекс. Розглянутий вище атом хрому буде записаний як:
Cr5224
Ще один спосіб позначення конкретного атома - написати після назви масове число атома, розділене дефісом. Вищезгаданий атом буде записаний як хром-52, з масовим числом, написаним після назви. Атомний номер не повинен бути включений, оскільки всі атоми хрому мають однакову кількість протонів, але можуть змінюватися в атомній масі.
Ізотопи
Як говорилося раніше, не всі атоми даного елемента ідентичні. Зокрема, кількість нейтронів в ядрі може змінюватися для багатьох елементів. Як приклад, природний вуглець існує в трьох формах, які проілюстровані на малюнку нижче.

Кожен атом вуглецю має однакову кількість протонів (6), що дорівнює його атомному номеру. Кожен атом вуглецю також містить шість електронів, що дозволяє атому залишатися електрично нейтральним. Однак кількість нейтронів коливається від шести до восьми. Ізотопи - це атоми, які мають однаковий атомний номер, але різні масові числа через зміну кількості нейтронів. Три ізотопи вуглецю можна назвати вуглецем-12(C126), вуглецем-13(C136) та вуглецем-14(C146). Природні зразки більшості елементів - це суміші ізотопів. Вуглець має всього три природних ізотопа, але деякі більш важкі елементи мають набагато більше. Олово має десять стабільних ізотопів, що є найбільшим з будь-якого відомого елемента. Ядро даного атома вуглецю буде одним з трьох можливих ізотопів, розглянутих вище.
Хоча наявність ізотопів впливає на масу атома, це не впливає на його хімічну реакційну здатність. Хімічна поведінка регулюється кількістю електронів і кількістю протонів. Вуглець-13 поводиться хімічно точно так само, як і більш рясний вуглець-12.
Розмір атомів
Графіт у вашому олівці складається з елемента вуглецю, неметалу. Уявіть, як взяти невеликий шматочок вуглецю і подрібнити його, поки він не стане дрібним пилом. Кожна пляма вуглецю все одно матиме всі фізичні та хімічні властивості вуглецю. Тепер уявіть, що ви могли б якось продовжувати ділити цятку вуглецю на менші та менші шматочки. Врешті-решт, ви досягнете точки, де ваш зразок вуглецю настільки малий, наскільки це можливо. Цю кінцеву частинку називають атомом.
Атоми, як ви, напевно, знаєте, вкрай малі. Насправді графіт в звичайному олівці містить близько5×1020 атомів вуглецю. Це майже незбагненно велика кількість. Населення всієї Землі стосується7×109 людей, а це означає, що у вашому олівці приблизно в7×1010 рази більше атомів вуглецю, ніж людей на Землі! Щоб це було правдою, атоми повинні бути надзвичайно малими. Ми можемо бачити атоми лише за допомогою сучасного приладу, який називається скануючим тунельним мікроскопом. (www.nobelprize.org/освіта... операції/сканування/)
Атомна маса
Маси окремих атомів дуже і дуже малі. Однак за допомогою сучасного приладу під назвою мас-спектрометр можна виміряти і такі незначні маси. Атом кисню-16, наприклад, має масу в2.66×10−23g. Хоча порівняння мас, виміряних у грамах, мали б певну корисність, набагато практичніше мати систему, яка дозволить нам легше порівнювати відносні атомні маси. Вчені вирішили використовувати нуклід вуглецю-12 як еталонний стандарт, за яким будуть порівнюватися всі інші маси. За визначенням, одному атому вуглецю-12 присвоюється маса рівно 12 атомних одиниць маси(amu). Атомна одиниця маси визначається як маса, рівна одній дванадцятій атома вуглецю-12. Маса будь-якого ізотопу будь-якого елемента виражається по відношенню до стандарту вуглець-12. Наприклад, один атом гелію-4 має масу в4.0026amu. Атом сірки-32 має масу в31.972amu.
Атом вуглецю-12 має в своєму ядрі шість протонів і шість нейтронів для масового числа 12. Оскільки на ядро припадає майже вся маса атома, один протон або одиночний нейтрон має масу приблизно1amu. Однак, як видно з прикладів гелію та сірки, маси окремих атомів - це не зовсім цілі числа. Це пов'язано з тим, що на масу атома дуже незначно впливає взаємодія різних частинок всередині ядра, а також включає невелику масу, додану кожним електроном.
Як зазначено в розділі про ізотопи, більшість елементів зустрічаються природним шляхом у вигляді суміші двох або більше ізотопів. Нижче перераховані (див. Таблицю нижче) - це природні ізотопи декількох елементів разом з відсотковим природним достатком кожного.
| Елемент | Ізотоп (символ) | Відсоток природного достатку | Атомна маса(amu) | Середня атомна маса(amu) |
|---|---|---|---|---|
| Водень | H11 | 99.985 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">1.0078 | \ (\ left (\ text {amu}\ праворуч)\)» rowspan="3" style="вертикальне вирівнювання: середина; вирівнювання тексту: по центру; ">1.0079 |
| H21 | 0,015 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">2.0141 | ||
| H31 | незначний | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">3.0160 | ||
| Вуглець | C126 | 98.89 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">12.000 | \ (\ left (\ text {amu}\ праворуч)\)» rowspan="3" style="вертикальне вирівнювання: середина; вирівнювання тексту: по центру; ">12.011 |
| C136 | 1.11 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">13.003 | ||
| C146 | слід | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">14.003 | ||
| Кисень | O168 | 99.759 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">15.995 | \ (\ left (\ text {amu}\ праворуч)\)» rowspan="3" style="вертикальне вирівнювання: середина; вирівнювання тексту: по центру; "> 15.999 |
| O178 | 0,037 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">16.995 | ||
| O188 | 0,204 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; ">17.999 | ||
| хлор | Cl3517 | 75.77 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: по середині; вирівнювання тексту: по центру; ">34.969 | \ (\ left (\ text {amu}\ праворуч)\)» rowspan="2" style="вертикальне вирівнювання: середина; вирівнювання тексту: по центру; ">35.453 |
| Cl3717 | 24.23 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: по середині; вирівнювання тексту: по центру; ">36.966 | ||
| Мідь | Cu6329 | 69.17 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 62.930 | \ (\ left (\ text {amu}\ праворуч)\)» rowspan="2" style="вертикальне вирівнювання: середина; вирівнювання тексту: по центру; "> 63.546 |
| Cu6529 | 30.83 | \ (\ left (\ text {amu}\ праворуч)\)» style="вертикальне вирівнювання: середина; вирівнювання тексту: центр; "> 64.928 |
Для деяких елементів один конкретний ізотоп набагато більш рясний, ніж будь-які інші ізотопи. Наприклад, природний водень - це майже весь воден-1, а природний кисень - майже весь кисень-16. Для багатьох інших елементів, однак, більше одного ізотопу може існувати в значних кількостях. Хлор (атомний номер 17) - жовтувато-зелений токсичний газ. Близько трьох чвертей усіх атомів хлору мають 18 нейтронів, що дає цим атомам масове число 35. Близько чверті всіх атомів хлору мають 20 нейтронів, що дає цим атомам масове число 37. Якби ви просто обчислили середнє арифметичне точних атомних мас, ви б отримали приблизно 36.
34.969+36.9662=35.968
Як бачите, середня атомна маса, наведена в останньому стовпці таблиці вище, значно нижче. Чому? Причина в тому, що нам потрібно враховувати природні відсотки достатку кожного ізотопу, щоб обчислити те, що називається середньозваженим. Атомна маса елемента - це середньозважене значення атомних мас природних ізотопів цього елемента. Середні атомні маси - це значення, які ми бачимо в таблиці Менделєєва.
0.7577(34.969)+0.2423(36.966)=35.453
Середньозважене визначається множенням відсотка природного достатку на фактичну масу ізотопу. Це повторюється до тих пір, поки не залишиться термін для кожного ізотопу. Для хлору існує лише два природних ізотопи, тому існує лише два терміни.
Додаткові ресурси
- Елементи та атоми: http://www.youtube.com/watch?v=IFKnq9QM6_A
- Вступ до Атома: http://www.youtube.com/watch?v=1xSQIwWGT8M
- Атомна історія - коротке відкриття: http://www.pbs.org/wgbh/nova/diamond...dehistory.html
- Все про атоми: http://education.jlab.org/atomtour/index.html
- Збірка і атом: http://phet.colorado.edu/en/simulation/build-an-atom
- Молекулярний верстак - атомна структура: http://workbench.concord.org/databas...vities/47.html
- Див. Всередині діаманта: http://www.pbs.org/wgbh/nova/diamond/insidewave.html
- Ізотопи та атомна маса: http://phet.colorado.edu/en/simulati...nd-atomic-mass
- Атомна структура: freezeray.com/флеш-файли/AtomcStructure.htm
- Атом Будівельник: Freezeray.com/Флешфайли/Atombuilder.htm
- Ізотопи тенісного м'яча: http://www.youtube.com/watch?v=oLnuXpf4hsA
- Математична гра Елемент: http://education.jlab.org/elementmath/index.html
- Кросворд атомів і матерії: http://education.jlab.org/sciencecro... /atoms_01.html
- Атомний номер Огляд #1: www.ScienceGeek.net/Хімія... micNumbers.htm
- Атомний номер Огляд #2: www.ScienceGeek.net/Хімія... t1Numbers2.htm
- Атомна структура: www.ScienceGeek.net/Хімія... Омічна структура/