5.1: Введення в розчин
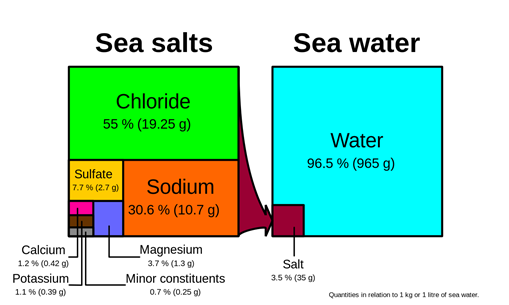
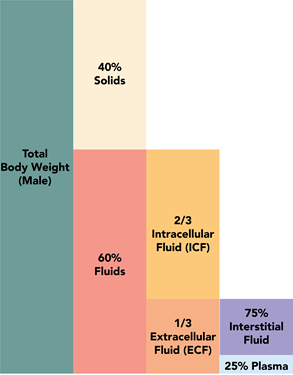
Рішення навколо нас, наприклад, повітря, морська вода, рідини організму, металеві сплави є розчинами. Рис. 5.1.1 ілюструє, що повітря являє собою суміш азоту, кисню, вуглекислого газу і деяких інших газів; рис. 5.1.2 ілюструє, що морська вода являє собою суміш води, хлориду, натрію, сульфату, магнію і деяких інших іонів, а рис. 5.1.3 ілюструє, що близько 60% людського організму складається з розчинів називаються рідинами організму.
Що таке рішення?
- Розчин являє собою однорідну суміш двох і більше чистих речовин.
- Речовина, яка знаходиться у великій кількості в розчині, називається розчинником.
- Речовина, яка знаходиться в менших кількостях в розчині, називається розчиненою речовиною.
Наприклад, повітря - це розчин, в якому азот є розчинником, а вода - розчинником в морській воді та рідинами організму. Кисень, вуглекислий газ та водяні пари є розчиненими речовинами в повітрі; а натрій, хлорид, сульфат, магній та деякі інші іони розчинені в морській воді.
види розчину
Розчини, як правило, класифікуються двома способами: i) виходячи з фізичного стану розчину і розчиненої речовини, і ii) на основі розміру частинок розчиненої речовини.
Види розчину, засновані на фізичному стані розчину і розчиненої речовини
Розчини можна класифікувати на основі фізичного стану розчину, розчинника та розчиненого речовини. Наприклад, повітря - це газ в газовому розчині; газована вода - газ в рідкому розчині; оцет - рідина в рідкому розчині; металеві сплави тверді в твердих розчині. У таблиці 5.1.1 перераховані основні типи розчинів, розчинників і первинних розчинених речовин в них.
|
Тип |
Приклад |
розчинник |
Первинний розчинений |
|---|---|---|---|
|
Газ в газі |
Повітря |
Азот |
Кисень |
|
Газ в рідині |
Газована вода |
Вода |
Вуглекислий газ |
|
Рідина в рідині |
Оцет |
Вода |
оцтова кислота |
|
Тверда речовина в рідині |
Морська вода |
Вода |
Хлорид натрію |
|
Твердий в твердому вигляді |
Латунь |
Мідь |
Цинк |
Види розчинів на основі розміру частинок розчиненої речовини
Розчин являє собою однорідну суміш, що містить менші компоненти/s, які називаються розчинними/s малих молекул або іонів, порівнянних за розміром з молекулами більшого компонента, званого розчинником.
Наприклад, розчинений у воді NaCl є розчином. Розчинена речовина практично рівномірно розподіляється в розчиннику, утворюючи однорідну суміш. Розчинена речовина не відокремлюється фільтрацією або напівпроникною мембраною, але може бути розділена якимось іншим фізичним процесом. Наприклад, процес дистиляції відокремлює тверду речовину в рідині або рідину на рідкий розчин. Розчин прозорий, хоча може бути кольоровим. Світло, що проходить через розчин, не видно, як показано на рис.5.1.4.


Суспензія являє собою гетерогенну суміш розчинника і розчинених частинок розміром більше 10 000 Å.
Наприклад, каламутна вода - суспензія. Якщо суспензії дати відстоятися, зважені частинки осідають і відокремлюються. Зважені частинки можуть бути відфільтровані. Деякі ліки, наприклад, молоко магнезії, є суспензіями. Доручено струсити безпосередньо перед введенням ліки, щоб повторно призупинити відстояну суспензію.
Колоїд потрапляє між розчином і суспензією. Колоїдні частинки - це більші молекули, такі як білки або групи молекул або іонів.
На відміну від суспензії, колоїди зазвичай не осідають, якщо дають настоятися. Колоїдні частинки не можуть бути відфільтровані, але можуть бути розділені напівпроникною мембраною. Коли світловий промінь проходить через колоїд, він розсіюється колоїдними частинками, званими ефектом Тиндалла, і стає видимим, як показано на рис.5.1.4.
Приклади колоїдів включають:
- туман і хмари, які представляють собою рідкі краплі води, розсіяні в повітрі;
- дим, який представляє собою тверді частинки вуглецю, дисперговані в повітрі;
- збиті вершки, які розсіюються на повітрі в рідині;
- пінопласт - це газ, диспергований у твердому тілі; і
- ager середовище, яке є рідким, диспергованим у твердому середовищі.
Вода — універсальний розчинник
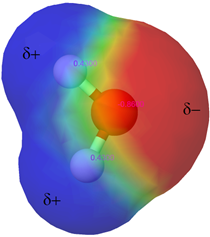
Вода (Н 2 О) є необхідною речовиною для життєдіяльності. Вона охоплює більше 70% земної поверхні (рис. 5.1.5), і в неї входить більше 60% людського тіла (5.1.3). Крім того, що є найпоширенішим розчинником, вода є універсальним розчинником, оскільки це полярна молекула з частковим негативним зарядом кисню та частковим позитивним зарядом на атомах водню, як показано на рис. 5.1.6. Полярність молекул води дозволяє їм взаємодіяти з іншими молекулами води, а також з іншими полярними сполуками через дипольно-дипольні взаємодії та з іншими іонами через іон-дипольні взаємодії. Ці взаємодії допомагають розчинити багато полярних та іонних сполук, які знаходяться в нас і навколо нас.

Як вода розчиняє полярні та іонні сполуки?
Молекули води встановлюють електростатичну взаємодію, звану водневим зв'язком, через частковий +ve кінець однієї молекули з частковим —ve кінцем сусідньої молекули. Ці взаємодії надають воді унікальні властивості, такі як її порівняно вища температура кипіння та температура плавлення порівняно з іншими речовинами подібної молекулярної маси. Інші полярні речовини мають подібні взаємодії, наприклад, етанол має водневий зв'язок, подібний до води, як показано на рис. 5.1.7.
Коли вода змішується з іншими полярними речовинами, такими як етанол, частина водневого зв'язку між молекулами води замінюється подібним водневим зв'язком з молекулами етанолу. Оскільки електростатична потенційна енергія подібна, природна тенденція йти до більшої дисперсії приводить дисперсію молекул етанолу рівномірно у воді, що призводить до розчину.
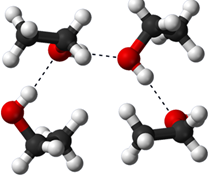
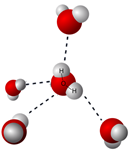
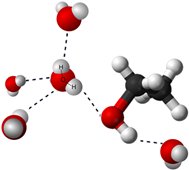
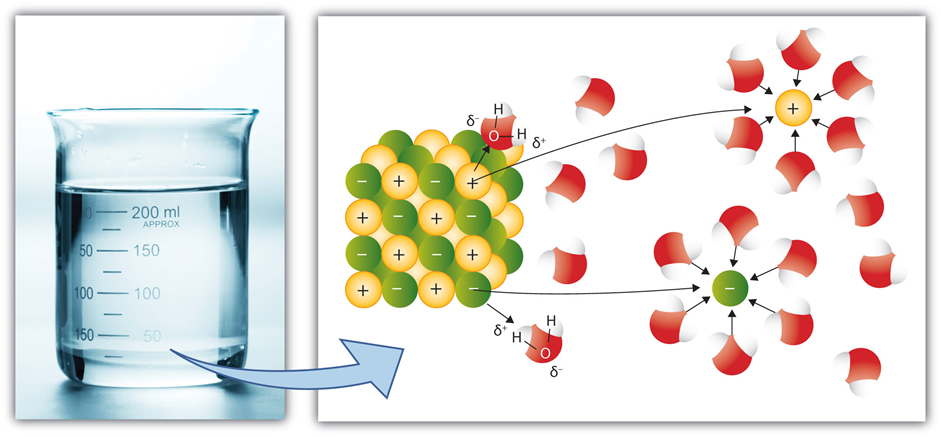
Іонні сполуки утримуються електростатичними силами між протилежними іонами, тобто іонними зв'язками. Коли до води додається іонна сполука, молекули води оточують катіон і встановлюють іонно-дипольну взаємодію, орієнтуючи їх частковий -ве кінець на катіон. Аналогічно молекули води встановлюють іонно-дипольну взаємодію з аніонами шляхом орієнтації їх часткового +ev кінця в бік аніона, як показано на рис. 5.1.8
Іонно-дипольні взаємодії, поряд із тенденцією природи до розсіювання частинок, зазвичай досить сильні, щоб подолати іонні зв'язки, дисоціювати сполуки на іони та майже рівномірно розсіяти їх у воді.
Відділення катіонів від аніонів іонного з'єднання називається дисоціацією.
Освіта шару молекул води навколо іонів, керованого іонно-дипольними взаємодіями, називається гідратацією.
Неполярні речовини, як рослинне масло або бензин, не розчиняються у воді. Молекули в неполярних речовині мають лише лондонські сили дисперсії. Вони легко розчиняються в неполярних розчинниках, таких як гексан або тетрахлорид вуглецю, які мають подібні лондонські сили дисперсії серед своїх молекул.
Той факт, що іонні і полярні речовини розчиняються в полярних розчинниках, а неполярні речовини розчиняються в неполярних розчинниках аналогічних міжмолекулярних взаємодій, називається «подібним розчиняється подібно».
