23.11: Гальванічне покриття
- Page ID
- 19240
Астролябія була пристроєм, який використовувався для вивчення рухів планет та проведення геодезії; більшість з них виготовлялися з латуні. Перські містики також використовували астроляби для проходження зірок і складання астрологічних прогнозів.
Гальванічне покриття
Багато декоративні предмети, як ювелірні вироби, виготовляються за допомогою електролітичного процесу. Гальванічне покриття - це процес, при якому іон металу відновлюється в електролітичній комірці, а твердий метал наноситься на поверхню. На малюнку нижче показана комірка, в якій мідний метал повинен бути покритий на другий метал.
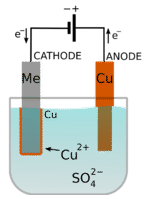
Осередок складається з розчину мідного купоросу і смужки міді, яка виконує роль анода. Металом\(\left( \ce{Me} \right)\) є катод. Анод підключений до позитивного електрода батареї, в той час як метал з'єднаний з негативним електродом.
При замиканні ланцюга метал міді з анода окислюється, дозволяючи іонам міді потрапляти в розчин.
\[\text{anode:} \: \: \: \ce{Cu^0} \left( s \right) \rightarrow \ce{Cu^{2+}} \left( aq \right) + 2 \ce{e^-}\nonumber \]
Тим часом іони міді з розчину відновлюються до мідного металу на поверхні катода (другого металу):
\[\text{cathode:} \: \: \: \ce{Cu^{2+}} \left( aq \right) + 2 \ce{e^-} \rightarrow \ce{Cu^0} \left( s \right)\nonumber \]
Концентрація іонів міді в розчині ефективно постійна. Це пояснюється тим, що процес гальванічного покриття переносить метал від анода до катода осередку. Інші метали, які зазвичай покриваються предметами, включають хром, золото, срібло та платину.