15.1: Структура води
- Page ID
- 19558
У своїй відомій поемі «Римство стародавнього мореплавця» Семюель Колрідж писав «вода, вода всюди, ні краплі пити». Колрідж говорив про те, щоб бути на океані, але не мав води, тому що він вбив альбатроса (мабуть, приносячи невдачу всім на кораблі). Близько\(75\%\) поверхні Землі знаходиться вода. Основною складовою людського тіла (над\(60\%\)) є вода. Ця проста молекула відіграє важливу роль у всіляких процесах.
будова води
Вода являє собою просту молекулу, що складається з одного атома кисню, зв'язаного з двома різними атомами водню. Через більш високу електронегативності атома кисню зв'язки є полярними ковалентними (полярними зв'язками). Атом кисню притягує спільні електрони ковалентних зв'язків в значно більшій мірі, ніж атоми водню. В результаті атом кисню набуває частковий негативний заряд\(\left( \delta - \right)\), тоді як атоми водню кожен набувають частковий позитивний заряд\(\left( \delta + \right)\). Молекула приймає зігнуту структуру через двох одиноких пар електронів на атомі кисню. Кут\(\ce{H-O-H}\) зв'язку приблизно\(105^\text{o}\), трохи менше\(109.5^\text{o}\) ідеалу\(sp^3\) гібридизованої атомної орбіти.
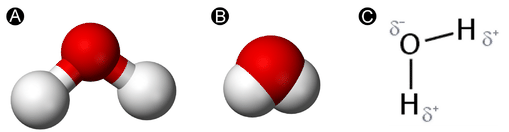
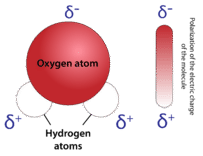
Зігнута форма молекули води має вирішальне значення, оскільки полярні\(\ce{O-H}\) зв'язки не скасовують один одного і молекула в цілому полярна. На малюнку нижче показана чиста полярність молекули води. Кисень є негативним кінцем молекули, тоді як площа між атомами водню є позитивним кінцем молекули.
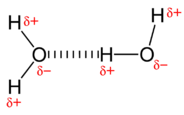
Полярні молекули притягують один одного дипольно-дипольними силами, так як позитивний кінець однієї молекули притягується до негативного кінця сусідньої молекули. У випадку з водою високополярні\(\ce{O-H}\) зв'язки призводять до дуже невеликої щільності електронів навколо атомів водню. Кожен атом водню сильно притягується до однопарних електронів на сусідньому атомі кисню. Вони називаються водневими зв'язками і міцніші, ніж звичайні дипольно-дипольні сили.
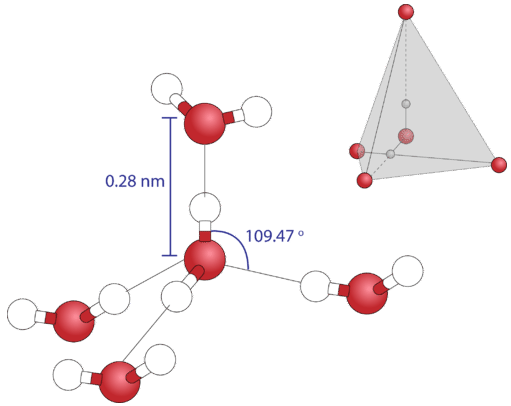
Оскільки кожен атом кисню має дві одинокі пари, він може утворювати водневі зв'язки з атомами водню двох окремих інших молекул. На малюнку нижче показаний результат - приблизно чотиригранна геометрія навколо кожного атома кисню, що складається з двох ковалентних зв'язків і двох водневих зв'язків.
Резюме
- Вода являє собою молекулярне з'єднання, що складається з полярних молекул, які мають зігнуту форму.
- Атом кисню набуває частковий негативний заряд, в той час як атом водню набуває частковий позитивний заряд.