13.15: Класи кристалічних твердих речовин
- Page ID
- 19274

Які звичайні речі ми підключаємо до проводів?
Ми часто сприймаємо багато речей як належне. Ми просто припускаємо, що отримаємо електроенергію, коли підключимо вилку до електричної розетки. Провід, який містить цю розетку, майже завжди мідний, матеріал, який добре проводить електрику. Унікальні властивості твердої міді дозволяють електронам вільно протікати через дріт і в будь-який пристрій, до якого ми його підключаємо. Тоді ми можемо насолоджуватися музикою, телебаченням, роботою за комп'ютером чи будь-якою іншою діяльністю, яку ми хочемо здійснити.
Класи кристалічних твердих тіл
Кристалічні речовини можуть бути описані типами частинок в них, і типами хімічного зв'язку, що відбуваються між частинками. Існує чотири типи кристалів: (1) іонні, (2) металеві, (3) ковалентні мережі та (4) молекулярні. Властивості і приклади кожного типу описані в таблиці нижче.
| Тип кристалічної твердої речовини | Приклади (формули) | Точка плавлення\(\left( ^\text{o} \text{C} \right)\) | Нормальна температура кипіння\(\left( ^\text{o} \text{C} \right)\) |
|---|---|---|---|
| Іонні | \(\ce{NaCl}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; "> 801 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">1413 |
| \(\ce{CaF_2}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">1418 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; "> 1533 | |
| Металеві | \(\ce{Hg}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-39 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; "> 630 |
| \(\ce{Na}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">371 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">883 | |
| \(\ce{Au}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">1064 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">2856 | |
| \(\ce{W}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">3410 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">5660 | |
| Ковалентна мережа | \(\ce{B}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">2076 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">3927 |
| \(\ce{C}\)(алмаз) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">3500 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">3930 | |
| \(\ce{SiO_2}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">1600 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; "> 2230 | |
| Молекулярний | \(\ce{H_2}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-259 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-253 |
| \(\ce{I_2}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">114 | \ (\ ліворуч (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">184 | |
| \(\ce{NH_3}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-78 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; ">-33 | |
| \(\ce{H_2O}\) | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; "> 0 | \ (\ left (^\ text {o}\ text {C}\ праворуч)\)» style="вертикальне вирівнювання: середина; "> 100 |
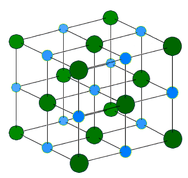
1. Іонні кристали: Іонна кристалічна структура складається з чергуються позитивно заряджених катіонів і негативно заряджених аніонів (див. Малюнок нижче). Іони можуть бути одноатомними або багатоатомними. Як правило, іонні кристали утворюються з комбінації металів групи 1 або 2, а групи 16 або 17 неметалів або неметалічних багатоатомних іонів. Іонні кристали тверді, крихкі і мають високі температури плавлення. Іонні сполуки не проводять електрику як тверді речовини, але проводять при розплавленні або у водному розчині.
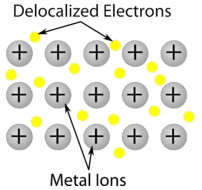
2. Металевий кристал: Металеві кристали складаються з катіонів металів, оточених «морем» рухомих валентних електронів (див. Малюнок нижче). Ці електрони (їх також називають делокалізованими електронами) не належать якомусь одному атому, але здатні рухатися по всьому кристала. В результаті метали є хорошими провідниками електрики. Як видно з таблиці вище, температури плавлення металевих кристалів охоплюють широкий діапазон.
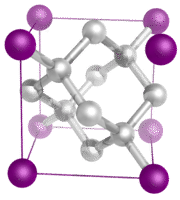
3. Кристали ковалентної мережі: Кристал ковалентної мережі складається з атомів у точках решітки кристала, причому кожен атом ковалентно пов'язаний зі своїми найближчими сусідніми атомами (див. Малюнок нижче). Ковалентно зв'язана мережа тривимірна і містить дуже велику кількість атомів. Мережеві тверді речовини включають алмаз, кварц, багато металоїдів та оксиди перехідних металів і металоїдів. Тверді речовини мережі тверді та крихкі, з надзвичайно високими температурами плавлення та кипіння. Будучи складаються з атомів, а не іонів, вони не проводять електрику ні в якому стані.
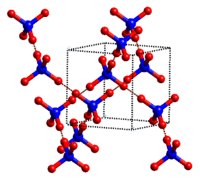
4. Молекулярні кристали: Молекулярні кристали зазвичай складаються з молекул в точках решітки кристала, скріплених між собою відносно слабкими міжмолекулярними силами (див. Малюнок нижче). Міжмолекулярні сили можуть бути силами дисперсії у випадку неполярних кристалів або дипольно-дипольними силами у випадку полярних кристалів. Деякі молекулярні кристали, такі як лід, мають молекули, що утримуються водневими зв'язками. Коли один з благородних газів охолоджується і затвердіє, точки решітки - це окремі атоми, а не молекули. У всіх випадках міжмолекулярні сили, що утримують частинки разом, набагато слабкіші, ніж іонні або ковалентні зв'язки. В результаті температури плавлення і кипіння молекулярних кристалів значно нижче. Не маючи іонів або вільних електронів, молекулярні кристали є поганими електричними провідниками.
Резюме
- Іонні кристали складаються з чергуються позитивних і негативних іонів.
- Металеві кристали складаються з катіонів металів, оточених «морем» рухомих валентних електронів.
- Ковалентні кристали складаються з атомів, які ковалентно пов'язані один з одним.
- Молекулярні кристали утримуються між собою слабкими міжмолекулярними силами.
Рецензія
- Що таке іонний кристал?
- Який тип кристала являє собою алмаз?
- Які сили утримують молекулярні кристали разом?
- Який тип кристала є хорошим провідником електрики?