9.19: Водневе зв'язування
- Page ID
- 19186
✅
Яка різниця між цими двома молекулами?
Грубе правило полягає в тому, що більш високі молекулярні матеріали мають більш високі температури кипіння, ніж їх нижчі молекулярні аналоги. Більше енергії потрібно для переміщення більшої молекули з рідкого стану в пароподібний стан. Однак аміак має температуру кипіння\(-33.34^\text{o} \text{C}\) і молекулярну масу 17, тоді як азот (молекулярна маса 28) має температуру кипіння\(-195.8^\text{o} \text{C}\). Легша молекула аміаку повинна мати інші фактори, що впливають на її фізичні властивості.
водневе склеювання
Приваблива сила між молекулами води являє собою дипольну взаємодію. Атоми водню пов'язані з високоелектронегативним атомом кисню (який також володіє двома одинокими парними наборами електронів, що робить дуже полярний зв'язок). Частково позитивний атом водню однієї молекули потім притягується до атома кисню сусідньої молекули води (див. Малюнок нижче).
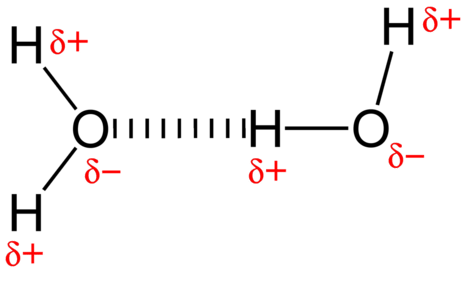
Водневий зв'язок - це міжмолекулярна сила привабливості, в якій атом водню, ковалентно пов'язаний з невеликим високоелектронегативним атомом, притягується до самотній парі електронів на атомі в сусідній молекулі. Водневі зв'язки дуже міцні порівняно з іншими дипольними взаємодіями. Сила типового водневого зв'язку приблизно\(5\%\) така, як у ковалентного зв'язку.
Водневий зв'язок відбувається тільки в молекулах, де водень ковалентно пов'язаний з одним з трьох елементів: фтором, киснем або азотом. Ці три елементи настільки електронегативні, що виводять більшу частину електронної щільності в ковалентному зв'язку з воднем, залишаючи\(\ce{H}\) атом дуже електронно-дефіцитним. \(\ce{H}\)Атом майже діє як оголений протон, залишаючи його дуже притягнутим до одиноких парних електронів на сусідньому атомі.
Водневе з'єднання, яке відбувається у воді, призводить до деяких незвичайних, але дуже важливих властивостей. Більшість молекулярних сполук, які мають масу, подібну до води, є газами кімнатної температури. Через міцних водневих зв'язків молекули води здатні залишатися конденсованими в рідкому стані. На малюнку нижче показано, як зігнута форма та два атоми водню на молекулу дозволяють кожній молекулі води мати можливість зв'язуватися з двома іншими молекулами.
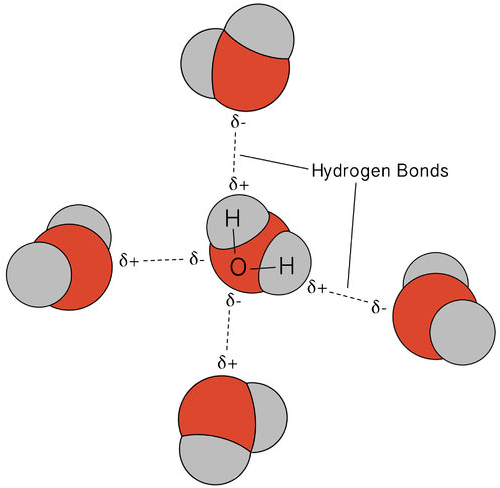
У рідкому стані водневі зв'язки води можуть розриватися і реформуватися в міру перетікання молекул з одного місця в інше. Коли вода охолоджується, молекули починають сповільнюватися. Зрештою, коли вода замерзає до льоду, водневі зв'язки стають постійними і утворюють дуже специфічну мережу (див. Малюнок нижче).
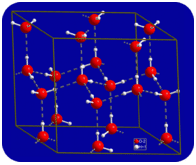
Зігнута форма молекул призводить до розривів у водневій мережі зв'язку льоду. Лід має дуже незвичайну властивість - його твердий стан менш щільний, ніж його рідкий стан. Лід плаває у воді. Практично всі інші речовини щільніше в твердому стані, ніж в рідкому. Водневі зв'язки відіграють дуже важливу біологічну роль у фізичних структурах білків і нуклеїнових кислот.
Чому вода утворює краплі? Підказка: це пов'язано з тяжінням між молекулами води. Дізнайтеся більше (і подивіться, скільки крапель води ви можете отримати копійки може вмістити) в цьому моделюванні.
Резюме
- Водневі зв'язки утворюються\(\ce{N}\), коли\(\ce{H}\) приєднаний до\(\ce{O}\), або\(\ce{F}\) атом взаємодіє з іншим\(\ce{N}\)\(\ce{O}\), або\(\ce{F}\) атомом.
Рецензія
- Наскільки міцна воднева зв'язок?
- Що відбувається, коли H ковалентно пов'язаний з N, O або F?
- Як форма молекули води впливає на властивості льоду?