8.6: Іонне склеювання
- Page ID
- 19637
Чи дійсно в морі є сіль?
Ми можемо отримати звичайну кухонну сіль з декількох джерел. Його можна добувати в твердому вигляді в соляних шахтах, або знайти як тверду речовину в родовищах. Ми також можемо отримати сіль з океану, але вона насправді не існує як сіль, коли в розчині. Іони натрію і хлоридні іони розчиняються, але не об'єднуються в структуру, поки вся вода не буде видалена.
Більшість порід і мінералів, що входять до складу земної кори, складаються з позитивних і негативних іонів, що утримуються разом іонним зв'язком. Іонне з'єднання являє собою електрично нейтральне з'єднання, що складається з позитивних і негативних іонів. Ви добре знайомі з деякими іонними сполуками, такими як хлорид натрію\(\left( \ce{NaCl} \right)\). Кристал хлориду натрію складається з рівних чисел позитивних іонів натрію\(\left( \ce{Na^+} \right)\) і негативних іонів хлориду\(\left( \ce{Cl^-} \right)\).
Іонні облігації
Протилежно заряджені частинки притягують один одного. Цю силу привабливості часто називають електростатичною силою. Іонний зв'язок - це електростатична сила, яка утримує іони разом в іонній сполуці. Міцність іонного зв'язку безпосередньо залежить від кількості зарядів і обернено залежить від відстані між зарядженими частинками. Катіон із\(2+\) зарядом зробить більш міцну іонну зв'язок, ніж катіон із\(1+\) зарядом. Більший іон робить слабший іонний зв'язок через більшу відстань між його електронами і ядром протилежно зарядженого іона.
Електронні точкові діаграми
Ми будемо використовувати хлорид натрію як приклад, щоб продемонструвати природу іонного зв'язку і як він утворюється. Як відомо, натрій є металом і втрачає свій один валентний електрон, щоб стати катіоном. Хлор є неметалом і отримує один електрон, перетворюючись на аніон. Обидва досягають дворянської електронної конфігурації газу. Однак електрони не можуть бути просто «втрачені» в нікуди зокрема. Більш точний спосіб опису того, що відбувається полягає в тому, що один електрон переноситься від атома натрію до атома хлору, як показано нижче.
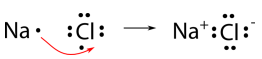
Іонний зв'язок - це тяжіння\(\ce{Na^+}\) іона для\(\ce{Cl^-}\) іона. Зазвичай показувати катіон без крапок навколо символу, щоб підкреслити, що початковий енергетичний рівень, який містив валентний електрон, тепер порожній. Аніон тепер показаний з повним октетом електронів.
Для такого з'єднання, як хлорид магнію, це не так просто. Оскільки магній має два валентні електрони, йому потрібно втратити обидва для досягнення конфігурації благородного газу. Тому знадобляться два атома хлору.
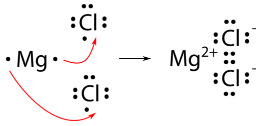
Остаточна формула хлориду магнію є\(\ce{MgCl_2}\).
Резюме
- Іонна сполука містить позитивні і негативні іони.
- Іонний зв'язок має електростатичну природу.
- Електронні точкові діаграми можуть бути використані для ілюстрації руху електронів та утворення іонів.
Рецензія
- Що таке іонне з'єднання?
- Що таке іонний зв'язок?
- Який катіон (Na + або Ca 2 +) утворює більш міцну іонну зв'язок з Cl -?